牛磺熊去氧膽酸對DSS誘導大鼠潰瘍性結腸炎的治療作用及可能機制*
蔡達興 黃思付 房太勇
潰瘍性結腸炎(ulcerative colitis,UC)是一種慢性非特異性腸道炎癥性疾病,隨著國民生活方式日趨西化,近年來我國UC的發病率呈明顯上升趨勢[1]。但其病因和發病機制尚不明確,目前多認為該病的發生是由遺傳、環境、微生物和免疫等多種因素相互作用所致。而近年來,越來越多研究發現,內質網應激(endoplasmic reticulum stress,ERS)在UC的發生發展中起著重要作用[2]。目前臨床上治療UC的常用藥物為氨基水楊酸制劑、糖皮質激素、免疫抑制劑及單克隆抗體。然而這些藥物存在著不良反應多、價格昂貴等缺點,使臨床應用受到限制。國外文獻[3]報道,牛磺熊去氧膽酸能夠減輕腸道炎癥反應和氧化應激,抑制類似炎癥性腸病的腸炎。本實驗采用牛磺熊去氧膽酸(TUDCA)干預DSS誘導的潰瘍性結腸炎大鼠,比較疾病活動指數(disease activity index,DAI)評分、結腸組織損傷指數(histological index,HI)評分,評判療效。研究ERS相關指標的變化,探討其可能機制,現報道如下。
1 材料與方法
1.1 一般材料
健康成年雄性Sprague-Dawley(SD)大鼠30只,清潔級,體重300~350 g,購自上海斯萊克實驗動物有限責任公司[許可證號:SCXK(滬)2012-0002],飼養于泉州醫學高等專科學校實驗動物中心[實驗動物使用許可證號:SYXK(閩)2016-0001]。
葡聚糖硫酸鈉(Dextran Sulphate Sodium,DSS)購自美國MP biomedicals公司(批號Q8356),牛磺熊去氧膽酸(Tauroursodeoxycholic Acid,TUDCA)購自美國 Sigma公司(批號102382735),GRP78、PERK、eIF2α、ATF4、CHOP、GAPDH一抗、羊抗兔二抗購自美國Abcam公司(批號ab20735、ab229742、ab182412、ab21735、ab176813、ab9536、ab160047)。
1.2 方法
健康成年雄性SD大鼠30只,稱重編號,隨機均分為正常組、模型組、治療組,每組10只。正常組自由飲水,其余兩組大鼠自由飲用5%DSS溶液,7 d建立大鼠實驗性潰瘍性結腸炎模型。
造模后,正常組、模型組予0.9%氯化鈉注射液灌胃,治療組予用200 mg/kg TUDCA灌胃,藥物溶于0.9%氯化鈉注射液中,1次/d,連續7 d。第8天深度麻醉處死大鼠,留取結腸標本。
1.3 觀察指標及評價標準
1.3.1 一般情況及DAI評分 每天固定時間觀察大鼠一般情況,包括飲食、活動、體質量改變、大便性狀、便血情況等,并在第7天根據Wirtz等[4]的標準行DAI評分,具體為,(1)體質量下降:無、<5%、5%~10%、11%~15%分別記分為0、1、2、3、4分;(2)大便形狀:正常大便、不成形松散大便、糊狀大便分別記分為0、2、4分;(3)便血情況:無、隱血便、肉眼血便分別積分為0、2、4分。DAI=(體質量下降分數+大便性狀分數+便血分數)/3。
1.3.2 病理表現及HI評分 取病變最明顯處結腸組織,10%甲醛溶液固定,脫水,石蠟包埋,切片,常規HE染色,參考Dieleman等[5]的標準行HI評分,具體為,(1)潰瘍:無潰瘍、小潰瘍<3 mm、大潰瘍>3 mm分別記分為0、1、2分;(2)炎癥:無、輕度、重度分別記分為0、1、2分;(3)肉芽腫:無、有分別記分為0、1分;(4)病變深度:無、黏膜下層、肌層、漿膜層分別記分為0、1、2、3分;(5)纖維化:分別記分為0、1、2分。HI=各分值總和。
1.3.3 結腸組織 GRP78、PERK、eIF2α、ATF4、CHOP基因蛋白水平檢測 Western-blot檢測大鼠結腸組織GRP78、PERK、eIF2α、ATF4、CHOP基因蛋白水平。所得蛋白條帶經掃描所得灰度值經內參基因標準化后所得灰度比值。
1.4 統計學處理
本研究數據采用SPSS 19.0統計學軟件進行分析和處理,符合正態分布的計量資料以(±s)表示,組間比較,采用LSD檢驗,計數資料以率(%)表示,采用χ2檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 三組大鼠一般情況比較
正常組大鼠飲食、活動正常,體質量逐步增加,肛周無黏液便、肉眼血便。模型組大鼠在造模后第2~3天癥狀達高峰,飲食、活動明顯減少,伴毛發稀疏凌亂,體質量下降,部分大鼠肛周出現黏液便、肉眼血便。治療組大鼠在藥物干預后第2天開始,飲食、活動逐步增加,體質量逐步回升,大便由黏液便逐漸變為軟便,無肉眼血便。
2.2 三組大鼠結腸組織大體形態、病理表現比較
正常組大鼠結腸黏膜面光滑,無糜爛、潰瘍。光鏡下,結腸黏膜上皮細胞排列整齊,腺體完整,隱窩結構正常,杯狀細胞豐富,無炎性細胞浸潤。模型組大鼠結腸糜爛、潰瘍,部分增厚粘連,腸管變形。光鏡下,黏膜各層大量中性粒細胞、淋巴細胞等炎性細胞浸潤,腺體破壞,隱窩結構缺失,杯狀細胞明顯減少。治療組大鼠糜爛、潰瘍基本愈合。光鏡下,腺體排列較規則,見少到中量炎性細胞浸潤,隱窩結構及杯狀細胞較模型組明顯增多,見圖1、圖 2。

圖1 三組大鼠結腸大體標本
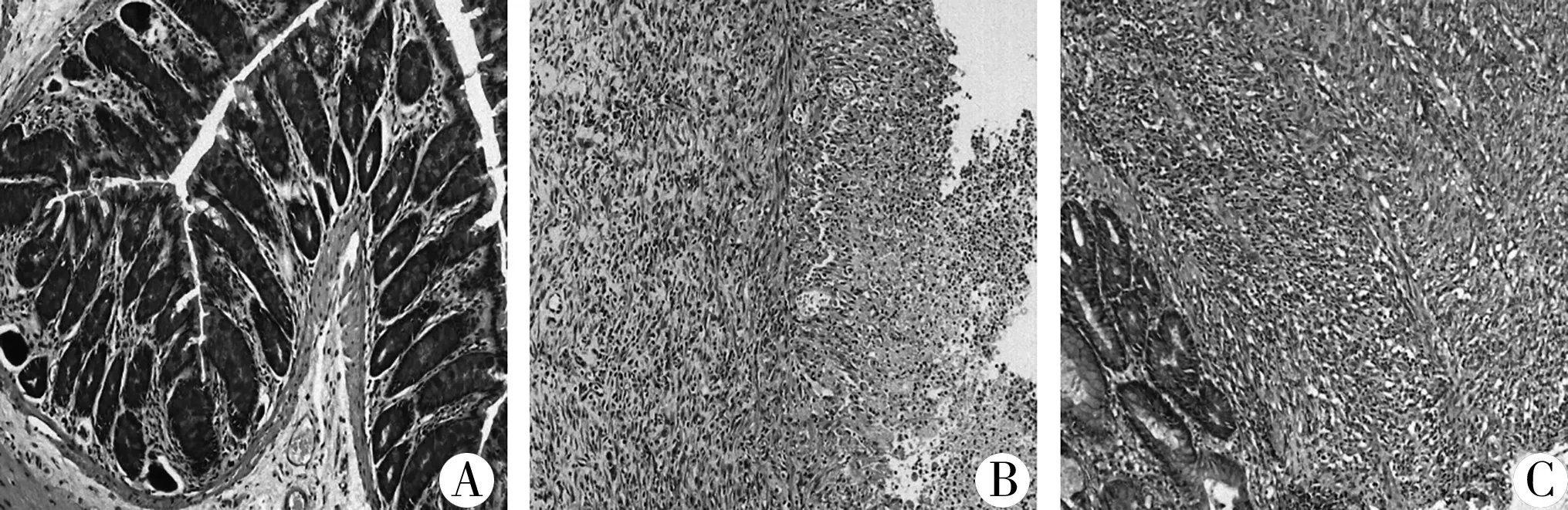
圖2 三組大鼠結腸組織HE染色(×100)
2.3 三組DAI評分及HI評分比較
模型組、治療組DAI評分均明顯高于正常組(P<0.05),而治療組低于模型組(P<0.05)。模型組、治療組HI評分均明顯高于正常組(P<0.05),而治療組低于模型組(P<0.05),見表1。
表1 三組DAI評分及HI評分比較 [分,(±s)]

表1 三組DAI評分及HI評分比較 [分,(±s)]
*與正常組比較,P<0.05;#與模型組比較,P<0.05。
組別 DAI評分 HI評分正常組(n=10) 0.00±0.00 0.00±0.00模型組(n=10) 2.87±0.65* 6.90±1.52*治療組(n=10) 1.13±0.39*# 3.10±1.37*#
2.4 三組大鼠結腸組織GRP78、PERK、eIF2α、ATF4、CHOP基因蛋白水平表達
模型組、治療組結腸組織GRP78、PERK、eIF2α、ATF4、CHOP蛋白表達水平均明顯高于正常組(P<0.05);而治療組低于模型組(P<0.05),見圖3、表 2。
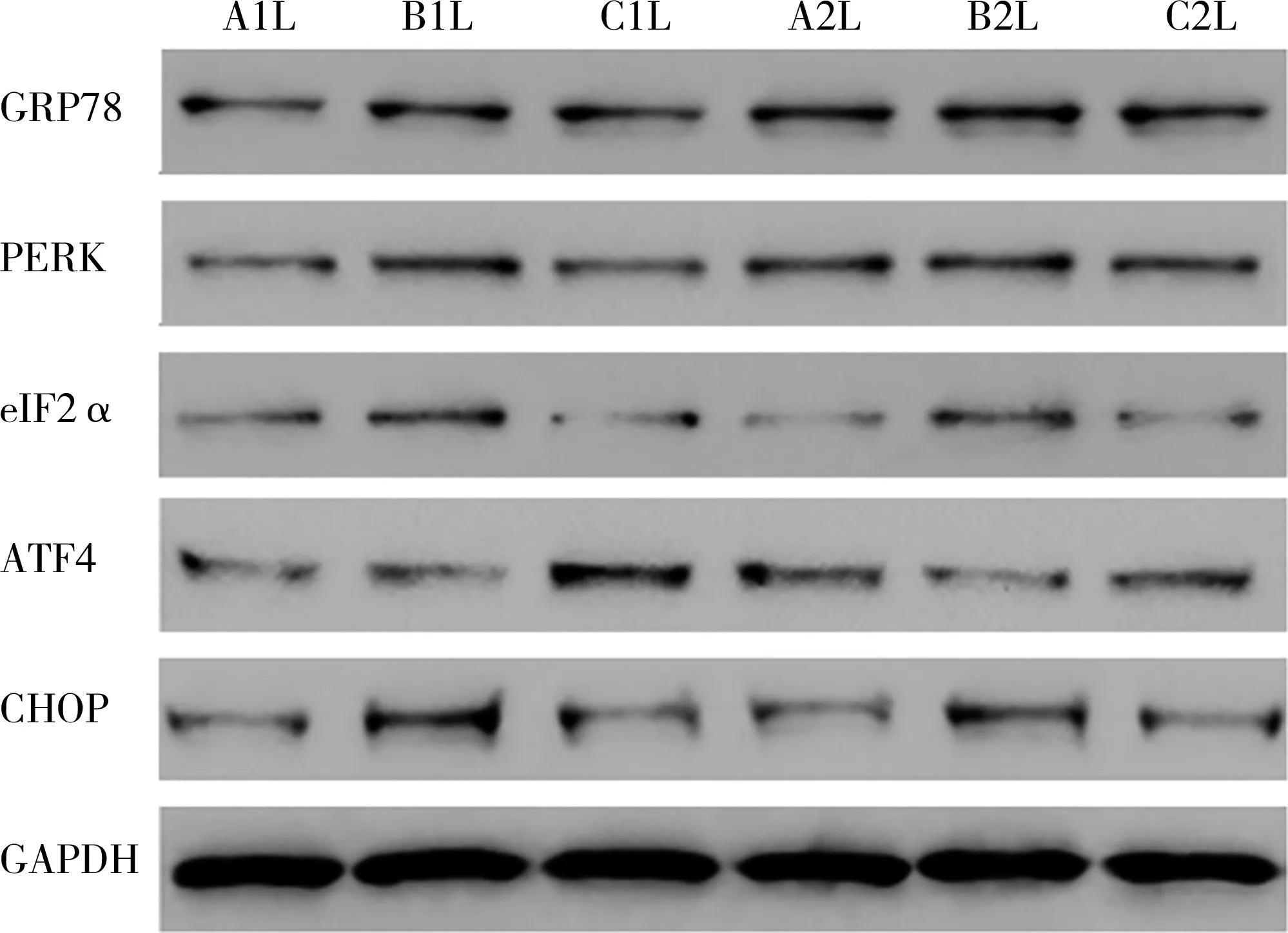
圖3 三組大鼠結腸組織GRP78、PERK、eIF2α、ATF4、CHOP蛋白表達
表2 三組大鼠結腸組織GRP78、PERK、eIF2α、ATF4、CHOP蛋白表達 (±s)
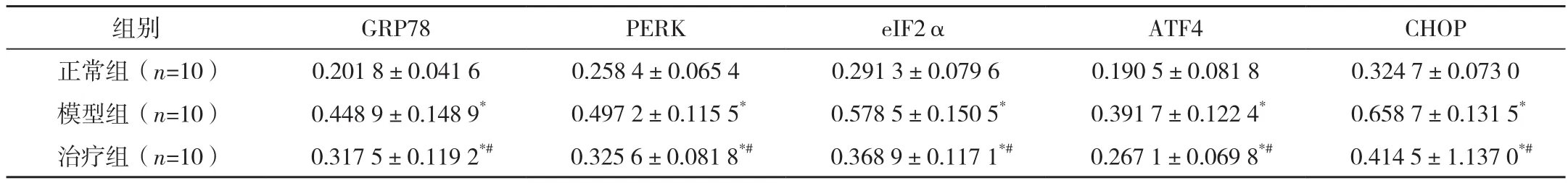
表2 三組大鼠結腸組織GRP78、PERK、eIF2α、ATF4、CHOP蛋白表達 (±s)
*與正常組比較,P<0.05;#與模型組比較,P<0.05。
組別 GRP78 PERK eIF2α ATF4 CHOP正常組(n=10) 0.201 8±0.041 6 0.258 4±0.065 4 0.291 3±0.079 6 0.190 5±0.081 8 0.324 7±0.073 0模型組(n=10) 0.448 9±0.148 9* 0.497 2±0.115 5* 0.578 5±0.150 5* 0.391 7±0.122 4* 0.658 7±0.131 5*治療組(n=10) 0.317 5±0.119 2*# 0.325 6±0.081 8*# 0.368 9±0.117 1*# 0.267 1±0.069 8*# 0.414 5±1.137 0*#
3 討論
ERS是指細胞受到內外因素的刺激時,如缺血、低氧、毒素等,內質網形態、功能的平衡狀態受到破壞后發生分子生化的改變,蛋白質加工運輸受阻,內質網內累積大量未折疊或錯誤折疊的蛋白質,細胞會通過一系列信號轉導途徑,對其進行應答,緩解內質網壓力,促進內質網正常功能的恢復。如果內質網功能紊亂持續,細胞將最終啟動Caspase-12依賴的細胞凋亡程序,這些反應被統稱為未折疊蛋白質反應(unfolded protein response,UPR)。UPR主要包括跨膜蛋白內質網跨膜蛋白激酶-1α(inostitol requiring enzyme 1,IRE-1α,又稱核酸內切酶)、激活作用轉錄因子(activating transcription factor 6,ATF6)和胰真核細胞翻譯起始因子2激酶(pancreatic elF-2 kinase,PERK)在轉錄及翻譯水平的三條不同信號通路。當細胞處于穩態時,這三種應激感受蛋白都與葡萄糖調節蛋白78(glucose reg- ulatory protein 78,GRP78)結合。ERS出現時,GRP78從這三種感受器上解離而去結合錯誤折疊的蛋白,GRP78表達升高,因而GRP78被廣泛地用作ERS激活的標志物[6]。而這三條信號通路中,PERK所啟動的PERK-eIF2α-ATF4-CHOP通路是十分重要的凋亡信號轉導途徑。與GRP78解離后的PERK通過同源二聚化而磷酸化激活自身,隨后催化底物真核翻譯起始因子2α發生磷酸化,eIF2α磷酸化后一方面抑制蛋白質的翻譯和合成,減輕內質網壓力;另一方面選擇性的誘導轉錄活化因子4(the activating transcription factor 4,ATF4)的翻譯表達,最終激活ERS獨特的凋亡標志蛋白CHOP的基因轉錄,后者通過調控死亡受體途徑和線粒體途徑兩大經典方式激活凋亡效應子Caspase-3執行細胞凋亡發生[7]。
近年來,越來越多的證據支持ERS對炎癥性腸病(IBD)的介導地位。Cao等[8]的研究發現,在DSS誘導的小鼠結腸炎實驗中,野生型結腸炎小鼠發生ERS,GRP78、ATF4、CHOP表達增加。Hino等[9]的研究也發現,DSS誘導的結腸炎小鼠腸上皮細胞中,ERS標記蛋白GRP78和CHOP表達明顯增加,提示小鼠腸炎中存在著ERS。除動物模型外,在人體研究中也發現了ERS與UC聯系的相關證據。一項研究表明,UC患者的結腸標本中,eIF2α通路控制蛋白質的翻譯和細胞應激反應[10]。
本研究選用GRP78作為ERS的標志蛋白,用于檢測ERS的程度。研究顯示,與正常組相比,DSS誘導潰瘍性結腸炎模型組結腸組織中GRP78蛋白水平明顯升高,提示潰瘍性結腸炎模型結腸組織中存在ERS。并且,模型組大鼠結腸組織較正常組PERK、eIF2α、ATF4、CHOP蛋白水平明顯升高,提示PERK通路與UC的發生發展可能存在相關性。這說明DSS誘導的大鼠潰瘍性結腸炎模型中ERS起著重要作用。
TUDCA是一種天然膽汁酸酰胺化合物,在體內是熊去氧膽酸(UDCA)與牛磺酸結合形成的一種親水性膽汁酸。同時TUDCA是細胞凋亡的抑制劑,通過干擾細胞凋亡的線粒體上游通路,抑制氧自由基的產生,減少內質網的應力,穩定未折疊蛋白反應[11]。已被證明TUDCA在肥胖,外傷性腦損傷、心臟病、急性腎損傷中是潛在的治療靶點[12-15]。
最近的相關研究證實,作為分子伴侶,TUDCA可以起到降低體外培養IESs的ERS的作用,而且在動物實驗中,通過TUDCA干預可以改善IBD小鼠模型的腸黏膜炎癥,其機制之一正是由于TUDCA對ERS的調節[16]。
本研究通過DSS誘導大鼠潰瘍性結腸炎模型,予TUDCA進行藥物干預,結果顯示,治療組大鼠一般情況明顯優于模型組,其組織病理嚴重程度明顯減低,DAI、HI評分降低,并且治療組大鼠結腸組織PERK、eIF2α、ATF4、CHOP蛋白水平較模型組明顯降低,證明TUDCA對DSS誘導的大鼠潰瘍性結腸炎模型具有治療作用,其機制可能是通過抑制PERK-eIF2α-ATF4-CHOP通路發揮分子生物學作用,這對于臨床使用TUDCA治療潰瘍性結腸炎具有重要指導意義。
綜上所述,TUDCA能夠改善DSS誘導的大鼠潰瘍性結腸炎,其機制可能是通過抑制PERK-eIF2α-ATF4-CHOP通路發揮分子生物學作用。這為其臨床應用價值提供一定的理論依據,但仍需進行大量臨床試驗以進一步證實。

