小麥葉綠素酸酯a氧化酶(TaCAO)基因的克隆與表達分析
王 重,樊哲儒,張躍強,李劍峰,高 新,時 佳
(1.新疆農業科學院核技術生物技術研究所,烏魯木齊 830091;2.農業部荒漠綠洲作物生理生態與耕作重點實驗室,烏魯木齊 830091;3.新疆農作物生物技術重點實驗室,烏魯木齊 830091)
0 引 言
【研究意義】新疆南疆三地州(喀什地區、和田地區和克孜勒蘇柯爾克孜自治州)果麥間作比例占70%左右,形成了南疆三地州特有的林果與種植業復合生產模式[1]。農林復合系統中,林果植物冠層對入射光產生攔截作用,改變了小麥接收到的入射光質量,降低小麥光合有效輻射和產量[2,3]。【前人研究進展】高等植物體內參與光合作用的重要物質是葉綠素,包括葉綠素a、葉綠素b和類胡蘿卜素等,其中葉綠素a和葉綠素b主要發揮吸收光能的作用,前者偏向對紅光的吸收,而后者更偏向對藍紫光的吸收。農林復合系統中由于木本植物林冠層的遮蔽作用減少了小麥接收到的入射光,漫射光增加,紅光減少,藍紫光增加,葉片單位葉面積葉綠體體積增大,數量減少,葉綠素含量尤其是葉綠素b的含量增加,葉綠素a/b值下降[4,5],捕捉漫射光中含量較高的較短波長藍紫光,提高光能利用效率;提高捕光色素復合體LHCP的含量,增加基粒數與基粒片層[6,7];均衡激發光能在光系統PS I和PS II間的分配[7,8];葉綠素b含量增加后,葉綠素a/b值下降,對于光合電子傳遞具有重要影響;葉綠素a/b值下降,增加了葉綠體對2,6-二氯酚靛酚的還原能力,增強了葉綠體的光合磷酸化活性,使捕光色素維持在較高水平,可吸收更多光能[9,10]。【本研究切入點】葉綠素b是葉綠素a經葉綠素酸酯a氧化酶和葉綠素合成酶共同作用形成的,此途徑是葉綠素b形成的惟一途徑,葉綠素酸酯a氧化酶(CAO)基因是催化葉綠素b合成的唯一主控基因[11,12]。研究小麥葉綠素酸酯a氧化酶(TaCAO)基因的克隆與表達分析。【擬解決的關鍵問題】根據GenBank上的已知序列,結合小麥基因組測序信息,以新疆南疆果麥間作主栽小麥品種新冬20號為材料,克隆小麥葉綠素酸酯a氧化酶(CAO)基因ORF,并對其編碼的蛋白質序列進行理化性質、進化關系等生物信息學分析,在不同光照強度下通過半定量PCR方法分析TaCAO的表達差異,為農林復合系統中小麥對于弱光環境在葉綠素合成層面的響應奠定基礎。
1 材料與方法
1.1 材 料
取新冬20號旗葉迅速置于液氮中,凍存于-80℃冰箱中備用。
Trizol、MightyScript第一鏈cDNA合成Master Mix、2X 高保真PCR Mix預混液、瓊脂糖凝膠回收試劑盒、T4DNA連接酶、TA克隆載體pUCm-T Vector、大腸桿菌(Escherichia coli)菌株DH5α感受態細胞購自上海生工,6×Loading buffer購自TAKARA公司,2×PCR Master Mix購自博邁德公司,GoldViewTM、DL2000購自北京莊盟生物,其余試劑為進口或國產分析純。PCR引物合成及DNA測序服務均由上海生工提供。
1.2 方 法
1.2.1 RNA提取及反轉錄
采用Trizol法提取小麥旗葉總RNA,取1 μL進行檢測,使用Nanodrop分光光度計檢測RNA質量,并跑瓊脂糖凝膠電泳瓊脂糖凝膠電泳檢測RNA純度。使用MightyScript第一鏈cDNA合成Master Mix進行反轉錄,獲得的cDNA凍存于-20℃冰箱中備用。
1.2.2CAO基因ORF克隆
根據GenBank上公布的擬南芥CAO基因序列在小麥基因組數據庫中進行Blast,篩選出位于3號染色體上的TaCAO基因序列。利用Primer Premier 5.0軟件參照序列設計特異性引物:TaCAO-F:GCGTCCATGACCACAGTG;TaCAO-R:TGTTTGCCTATGATCCACTC。
以小麥cDNA為模板進行RT-PCR,將擴增產物在1.0%瓊脂糖凝膠進行電泳檢測,獲得的cDNA為模板進行RT-PCR擴增目的基因,退火溫度49~52℃。使用1%瓊脂糖凝膠電泳檢測PCR產物,回收大小正確條帶連接至pUCm-T載體,轉化大腸桿菌DH 5α后37℃暗培養20 h。挑取白斑進行PCR驗證,陽性克隆送至上海生工測序。
1.2.3 生物信息學
將測序結果通過NCBI數據庫(https://www.ncbi.nlm.nih.gov/)的ORF Finder、BLAST、CD-search等工具進行在線比對,確定序列完整編碼框、同源序列及保守結構域;使用序列處理在線工具包(http://www.bio-soft.net/sms/index.html)分析TaCAO編碼蛋白的氨基酸序列;使用蛋白分析系統ExPASy(http://www.expasy.org/protparam)分析蛋白質基本理化性質[13];使用SoftBerry在線軟件(http://linux1.softberry.com/berry.phtml)對蛋白的亞細胞定位進行預測;使用在線工具TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)分析蛋白質跨膜結構域;使用在線分析工具ProtScale(https://web.expasy.org/protscale/)分析蛋白的疏水性/親水性[14,15];使用在線軟件SOPMA分析蛋白二級結構(https://npsa-prabi.ibcp.fr/NPSA/npsa_sopma.html)[16];使用在線工具Smart(http://smart.embl.de/smart/)分析該蛋白的功能結構域[17,18];通過DNAMAN軟件進行同源性比對分析[19],使用MEGA 7.0軟件構建進化樹[20,21]。
1.2.4 不同光強下TaCAO表達變化
新冬20號生長至三葉一心期,分別置于900、1 800、3 600和7 200 lx光照強度下處理3 h,提取葉片RNA并反轉錄,以β-actin為內參,進行半定量PCR。
2 結果與分析
2.1 小麥RNA提取與反轉錄
研究表明,OD260/280=1.94,28S條帶最亮,提取RNA質量較好。圖1
2.2 TaCAO克隆
研究表明,在1.6 KB左右有明顯特異性條帶,與已知CAO基因的ORF全長接近,回收目的片段并構建克隆載體進行測序。圖2
2.3 TaCAO基因的核酸與蛋白質序列
研究表明,小麥CAO基因開放閱讀框的長度為1 653 bp;GC含量為53.4%,編碼包含550個氨基酸的蛋白質,含量最高的氨基酸為亮氨酸(11.5%)和絲氨酸(7.8%),半胱氨酸(2.4%)和色氨酸(2.5%)含量最少。表1
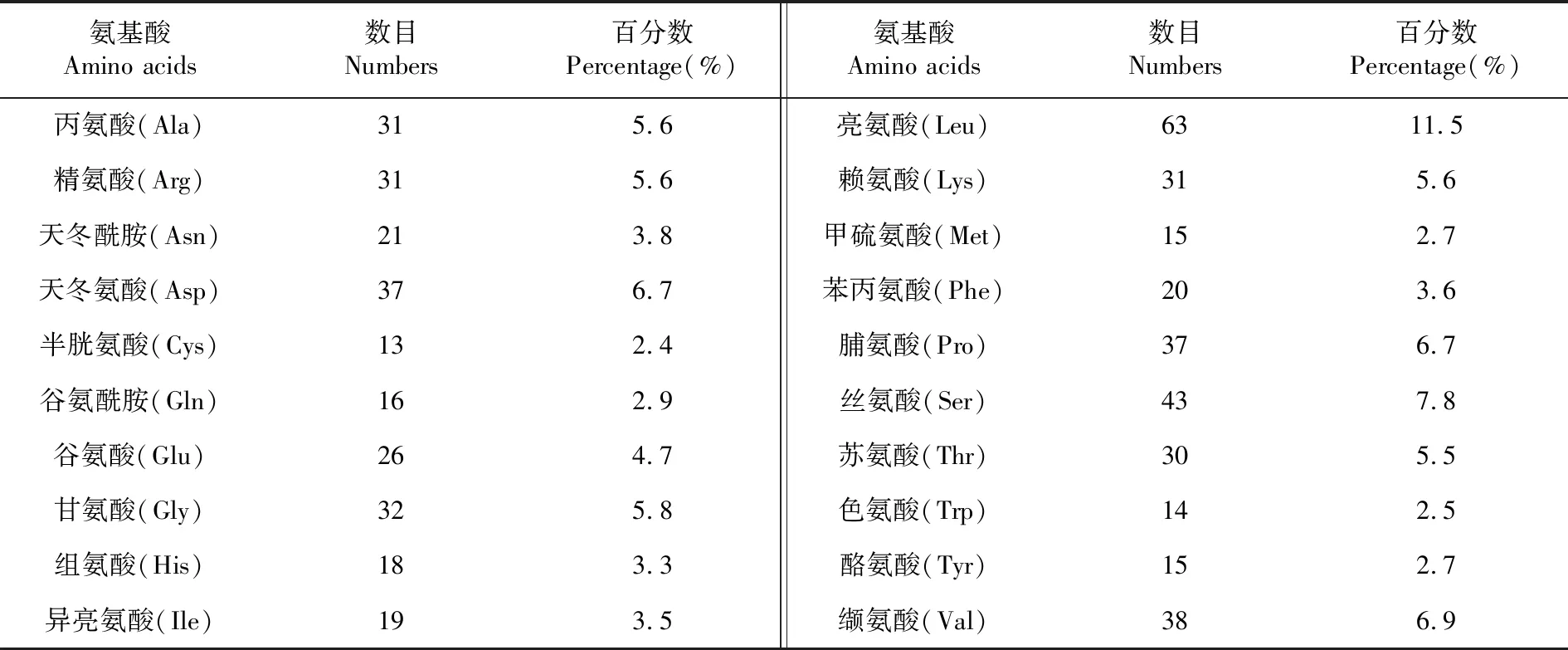
表1 TaCAO編碼蛋白的氨基酸組成Table 1 Amino acid composition of the protein encoded by TaCAO
2.4 TaCAO編碼蛋白的基本理化性質
研究表明,TaCAO編碼蛋白的大小約為62.12 KD,原子總數為8 696,理論等電點為7.00,其負電荷殘基總數(Asp+Glu)為63個,正電荷殘基總數(Arg+Lys)為62個;脂肪指數為83.82;不穩定指數(II)為37.12(不穩定指數<40時,表示穩定),親水性平均值為-0.309(親水性平均值<0代表親水性),小麥CAO為親水性的穩定蛋白。TaCAO編碼蛋白包含一個35個氨基酸殘基的葉綠體轉運肽,定位于葉綠體中。表2
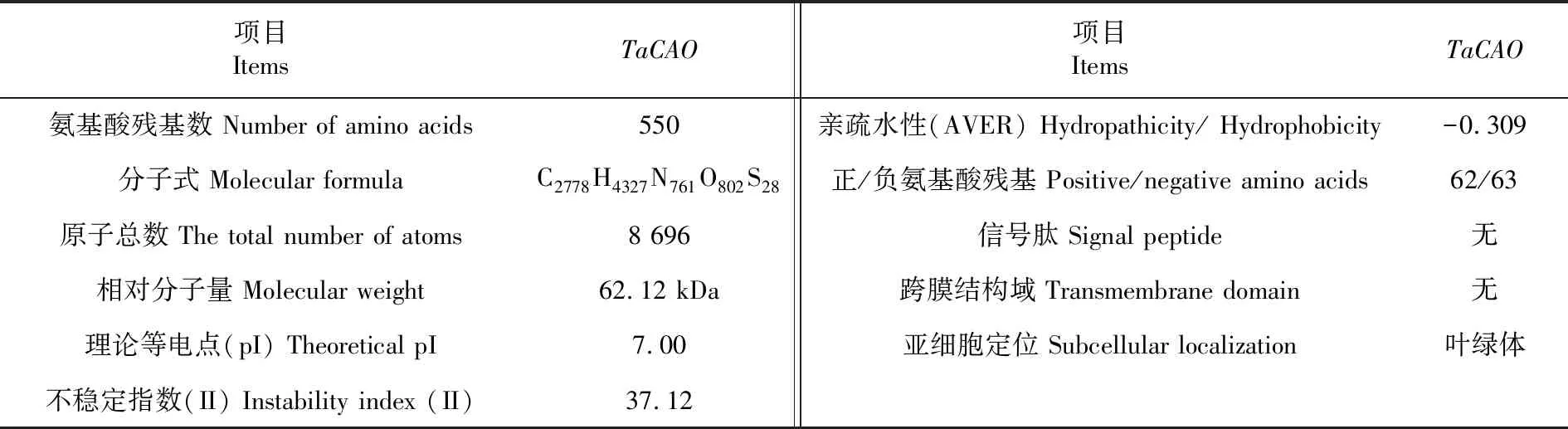
表2 TaCAO編碼蛋白的基本理化性質Table 2 The physical and chemical properties analysis of the protein encoded by TaCAO
2.5 TaCAO編碼蛋白的二級結構預測
研究表明,該蛋白二級結構主要由無規則卷曲、α-螺旋和延伸鏈以及β-轉角組成,其中無規則卷曲(44.18%)和α-螺旋(37.64%)的含量最高,β-轉角(5.09%)含量最低。無規則卷曲均勻分布于整條肽鏈,而α-螺旋則較為集中的分布于多肽鏈兩端。表3,圖3

表3 TaCAO編碼蛋白的二級結構比例Table 3 Proportion of secondary structure of the protein encoded by TaCAO
2.6 TaCAO編碼蛋白功能結構域的預測
研究表明,該蛋白質包含5個保守結構域,分別是PLN02281、Rieske_RO_Alpha_CAO、Rieske、HcaE和nirD_assim_sml。其中PLN02281和Rieske_RO_Alpha_CAO均是與葉綠素酸酯a氧化酶功能相關的結構域。圖4
2.7 TaCAO編碼蛋白的同源性
研究表明,TaCAO編碼蛋白與大麥(Hordeumvulgare,AF173228.1)同源性最高,為99.45%,二穗短柄草(Brachypodiumdistachyon,XP_003565123.1)次之,同源性為94.73%,與水稻(OryzasativaJaponicaGroup,XP_015614086.1)、矢竹(Pseudosasajaponica,AMH40452.1)、糜子(Panicummiliaceum,RLN22716.1)、高粱(Sorghumbicolor,XP_002459143.1)、玉米(Zeamays,NP_001151343.1)、小米(Setariaitalica,XP_004971349.1)、擬南芥(Arabidopsisthaliana,NP_175088.1)的同源性分別為86.18%、86.18%、84.91%,84.03%、83.67%、83.43%和67.39%。不同植物CAO氨基酸序列具有較高保守性,TaCAO編碼蛋白可能與其他植物的CAO具有相同的進化起源。小麥CAO與大麥CAO親緣關系最近,與糜子和小米親緣關系較遠。圖5,圖6
2.8 不同光強下TaCAO表達
研究表明,TaCAO相對表達量隨著光照強度減弱而逐步增強,呈現遞增關系。900 lx光照強度下TaCAO相對表達量最高,7 200 lx光照強度下TaCAO相對表達量最低,弱光環境下TaCAO表達是上調的。圖7
3 討 論
葉綠素酸酯a加氧酶(CAO)是一種Rieske型單加氧酶,能夠專一性的識別葉綠素酸酯a,通過對其C7側鏈上的甲基(-CH3)進行兩步氧化反應使其形成甲酰基(-CHO),轉變為葉綠素酸酯b[22];然后再由葉綠素合酶催化在葉綠素酸酯b的D環上加一個植醇合成葉綠素b。葉綠素酸酯a 氧化酶(CAO)在葉綠素a、b的轉化和平衡中具有極其重要的作用。
在線分析氨基酸序列,在試驗中克隆得到的TaCAO編碼蛋白含有一個35個氨基酸殘基的葉綠體轉運肽,還存在Rieske_RO_Alpha_CAO和Rieske鐵硫配位中心2個保守結構域,與姜可以[23]、Yamasato[24]等的研究結果一致。在該蛋白序列中還存在苯丙氨酸雙加氧酶和亞硝酸還原酶2個活性位點,可能在葉綠素b合成過程中參與了表達調控作用。
對獲得的氨基酸序列進行同源性分析,禾本科植物中的CAO相似性全都在80%以上,大麥、二穗短柄草等親緣關系較近的植物相似性更是達到了90%以上,進化分析結果表明,小麥CAO與大麥CAO的親緣關系最近,同時擬南芥CAO與高粱、玉米CAO的親緣關系也較近,在高等植物中CAO可能存在相同的進化起源,也具有高度的保守性。
通過半定量PCR對TaCAO在不同光照強度下的相對表達量進行分析,弱光環境下該基因表達上調,其相對表達量與光照強度呈現出反比關系。TaCAO表達量的提高能夠增加小麥葉片中葉綠素b含量,增強對于較短波長的藍紫光的吸收能力,使小麥在弱光環境下仍然能夠保持較高水平的光合效率。
4 結 論
由小麥品種新冬20號中克隆了小麥葉綠素酸酯a氧化酶基因TaCAO,該基因ORF長度為1 653 bp,編碼由550個氨基酸殘基組成的蛋白,大小為62.12 kD,含有葉綠素轉運肽和Rieske_RO_Alpha_CAO結構域,還存在一個Rieske鐵硫配位中心和鐵結合位點,具有完整的CAO活性。該蛋白與大麥的親緣關系最近,并具有較高的保守性。該基因的表達與光照強度呈現反比關系,在小麥適應弱光環境中可能發揮了保持光合效率的作用。

