以咯血為主要臨床表現的原發性肺動脈肉瘤并肺血栓栓塞癥一例報道
康世威,宮小薇,何平,崔江華,袁雅冬
原發性肺動脈肉瘤(primary pulmonary artery sarcoma,PPAS)是一種主要起源于肺動脈內膜或內膜下層并于肺動脈腔內生長的罕見惡性腫瘤,其發病機制目前尚未明確[1]。PPAS患者的臨床表現不典型,亦無特異性的影像學特征,較易誤診為急性或慢性肺血栓栓塞癥(pulmonary thromboembolism,PTE),常通過手術或尸檢確診。PPAS發病率、確診率均較低,但病情進展快,對癥治療效果及預后極差。有研究表明,PPAS患者經內科保守治療后的生存期僅為1.5個月,外科手術治療后的生存期可延長至10~18個月[2]。因此,早期識別、診治PPAS至關重要。本文報道了1例以咯血為主要臨床表現的PPAS并PTE患者的診療經過,以期提高臨床醫生對該病的診療水平。
1 病例簡介
患者,男,63歲,漢族,已婚,因“間斷咯血11個月,加重1 d”于2018-12-12就診于河北醫科大學第二醫院呼吸與危重癥醫學二科。患者于11個月前無明顯誘因出現痰中帶血,但未予以重視,后因該癥狀間斷發作并逐漸加重,咯血量約為10 ml/d,遂于2018-09-06就診于河北醫科大學第四醫院,行胸部增強CT掃描示:右肺動脈主干及其分支、左下肺分支內動脈栓塞,左肺門增大伴軟組織結節,左肺下葉炎癥。電子支氣管鏡檢查示:左肺上葉舌段開口處可見黃豆粒大小的新生物,表面可見新鮮滲血,因觸之出血,未能成功取得病理組織,采用氬氣刀噴凝止血。痰液及支氣管肺泡灌洗液均未檢測出異常細胞。正電子發射斷層顯像(positron emission tomography,PET)-CT掃描示:左肺下葉基底段近肺門處見軟組織結節影,邊緣光滑,考慮良性肺結節可能性大。患者接受止血、抗感染等綜合治療后,病情好轉出院。此后,患者因反復咯血入住河北省胸科醫院,住院期間患者家屬攜帶患者住院資料前往中國醫學科學院阜外醫院咨詢,考慮PTE可能性大。故患者在入住河北省胸科醫院期間接受止血、抗感染等綜合治療,待咯血停止后遵中國醫學科學院阜外醫院意見予以低分子肝素4 100 U/d,25 d后因患者出現痰中帶血停用該藥,待出血停止后出院。出院后,患者偶爾咳少量血性痰。2018-11-12,患者于河北省胸科醫院復查增強CT示:右肺動脈干、右肺上葉后段肺動脈、左下肺動脈、左肺上葉下舌段動脈栓塞,較2018-09-06檢查結果部分減輕,左肺門、左下肺動脈處軟組織出現不均勻的輕中度增強,不排除腫瘤的可能。
1 d前患者咯血量增加,最多約150 ml,為求進一步診治而就診于河北醫科大學第二醫院。患者自發病以來無發熱、盜汗、乏力、胸痛,飲食、睡眠欠佳,二便及體質量無明顯異常,既往體健,無特殊個人史、家族史。入院查體:體溫36.5 ℃,脈搏78次/min,呼吸頻率20次/min,血壓110/80 mm Hg(1 mm Hg=0.133 kPa)。全身淺表淋巴結未觸及腫大,無頸靜脈怒張;胸廓對稱,左側呼吸動度減低,左下肺觸覺語顫減弱,左肺呼吸音低,雙肺可聞及散在的濕啰音;心臟聽診P2>A2,未聞及病理性雜音;腹部、四肢及神經系統檢查無明顯異常。血氣分析結果:pH值為7.42,動脈血氧分壓(arterial partial pressure of oxygen,PaO2)為 62.60 mm Hg,動脈血二氧化碳分壓(arterial partial pressure of carbon dioxide,PaCO2)為40.42 mm Hg,鼻導管吸氧量為3 L/min。D-二聚體為1.29 mg/L,腫瘤標志物、易栓癥篩查、自身抗體、血管炎譜及抗心磷脂抗體檢查均無明顯異常。胸部CT檢查示:左肺支氣管阻塞,左肺不張,縱隔左移,左側胸腔積液,右肺上葉后段及下葉背段炎癥,見圖1A、B。CT肺動脈血管造影(computed tomography pulmonary angiography,CTPA)檢查示:左下肺動脈未顯影,左肺不張,見圖1C、D。心臟彩色多普勒超聲檢查示:肺動脈壓為56 mm Hg,左房室瓣、右房室瓣輕度關閉不全。顱腦及腹部CT檢查均未見明顯異常,腹部及雙下肢靜脈彩色超聲檢查均未見血栓形成。初步診斷為PTE、左肺占位(性質待查)。
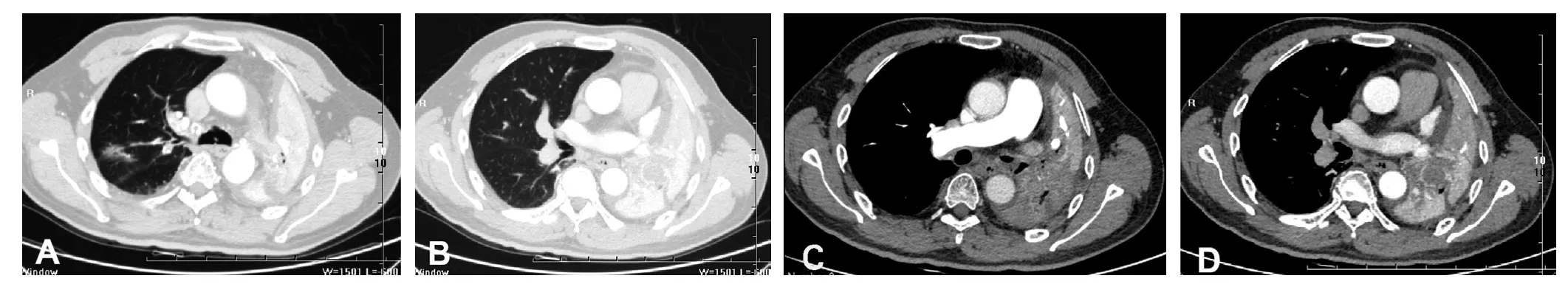
圖1 患者胸部CT檢查結果Figure 1 Chest CT results of the patient
入院后,給予患者甲磺酸酚妥拉明、酚磺乙胺、氨基己酸、鹽酸左氧氟沙星等藥物進行止血、抗感染等綜合治療,而后患者咯血癥狀消失,病情趨于穩定。2018-12-20,患者行電子支氣管鏡檢查顯示:鏡下可見大量血凝塊阻塞左肺主支氣管管腔,予以充分吸引及鉗夾處理。左肺舌葉開口充血糜爛,因吸引后易出血,故未取得管腔內新生物活檢,予以局部止血治療,見圖2。同期行超聲支氣管鏡檢查顯示:左肺下葉基底段開口處見低回聲腫塊影,其內見點狀血流信號,見圖3。行超聲支氣管鏡引導下經支氣管針吸活檢術(endobronchial ultrasound-guided transbronchial needle aspiration,EBUSTBNA),取出組織條并刷片,發現有惡性腫瘤細胞,免疫表型符合肉瘤,見圖4。免疫組化檢查示:CD20(-),CD31(+),CD34(-),CD56(-),CD99(+),CgA(-),CKpan(-),cyclin D1(-),LCA(-),NSE(-),P53(-),S100(+),TTF-1(-),Vimentin(+),WT1(-)。患者無不良反應。經支氣管鏡腔內治療后,患者咯血癥狀好轉。2018-12-24,復查胸部X線檢查提示左肺復張。最終診斷為PPAS伴肺內轉移,PTE。建議患者針對腫瘤行手術或放化療治療,但患者及家屬表示拒絕,并待咯血癥狀停止后自動出院,3個月后于家中病亡。
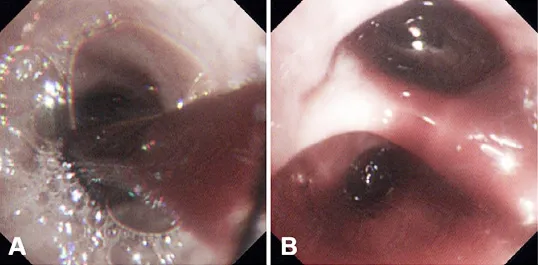
圖2 患者電子支氣管鏡檢查結果Figure 2 Results of electronic bronchoscopy of the patient
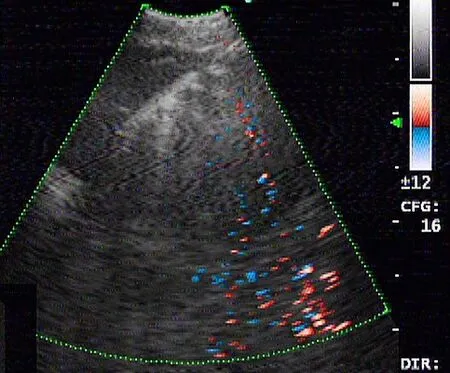
圖3 患者超聲支氣管鏡檢查結果Figure 3 Results of ultrasonic bronchoscopy of the patient
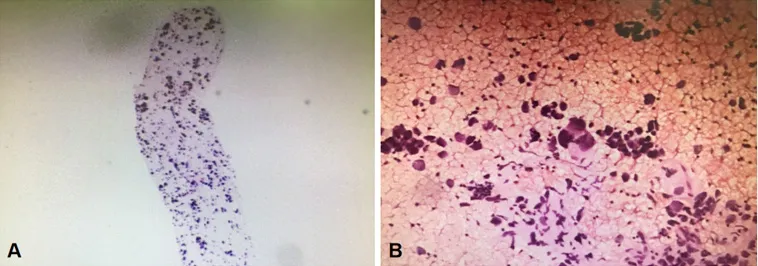
圖4 患者超聲支氣管鏡引導下經支氣管針吸活檢術病理檢查結果Figure 4 Pathological examination results of endobronchial ultrasoundguided transbronchial needle aspiration of the patient
2 討論
PPAS在臨床中較罕見,其中以分化不良、侵襲性、致命性較高的肺血管肉瘤較多見。PPAS是起源于肺血管內皮細胞的一種惡性腫瘤,屬于深部軟組織血管肉瘤,最早于1923年由MANDELSTAMM在尸檢中發現并報道[3]。研究表明,PPAS發病率為0.001%~0.030%,平均發病年齡為52歲,男性發病率較高,占確診患者的55%[4-5]。
PPAS的發病機制目前尚不明確。有研究發現,PPAS患者血小板源生長因子受體α(platelet-derived growth factor receptor alpha,PDGFRα)及鼠雙微染色體2(murine double minute 2,MDM2)基因擴增及過度表達,二者可能是PPAS的潛在標志物,但其在PPAS分子遺傳學方面的具體機制仍有待研究[6]。WHO將PPAS分為管壁肉瘤(主要為平滑肌肉瘤)和內膜肉瘤,其中內膜肉瘤較常見,且肺動脈起源的內膜肉瘤患病人數約是主動脈起源者的2倍[7]。COX等[8]分析了138例PPAS患者的病理組織結果發現,未分化肉瘤(31.2%)、平滑肌肉瘤(15.9%)、梭狀細胞肉瘤(13.8%)、惡性纖維組織肉瘤(7.2%)及纖維肉瘤(5.1%)是臨床最常見的5種病理類型。PPAS起病隱匿,早期臨床癥狀并不典型,臨床發病率、確診率均較低,其呈區域性生長,極易轉移至鄰近肺組織或縱隔淋巴結[9-10],主要臨床表現為胸悶、胸痛、咯血、發紺、進行性呼吸困難甚至暈厥,亦可出現體質量下降、發熱、乏力、惡病質等惡性腫瘤相關表現。隨著疾病進展,可查及頸靜脈怒張、劍下心音增強、P2亢進、肝區增大、下肢水腫等肺動脈高壓、右心功能失代償相關體征,實驗室檢查可發現低氧血癥、C反應蛋白水平增高,但D-二聚體水平在參考范圍,因此D-二聚體水平可作為PPAS與PTE的鑒別診斷依據,若D-二聚體水平升高則需警惕兩種疾病同時存在。
PPAS常可累及主肺動脈干、肺動脈瓣或右心室流出道,并向左、右肺動脈生長、延伸[8]。經胸或食管超聲心動圖檢查可協助診斷PPAS,并有助于了解肉瘤與肺血管瓣膜間的關系,同時可測定肺動脈壓,便于綜合評估患者心臟擴張或心室流出道梗阻程度。在影像學表現上,PPAS患者的CT平掃主要表現為肺門陰影擴大、單側或雙側肺動脈近端分支擴張、心影擴大等;CTPA檢查主要表現為主肺動脈及左、右肺動脈腔內腫塊影,呈息肉狀或分葉狀膨脹、浸潤性生長,病灶連續,腫塊內部血供豐富并呈不均勻強化[11]。PTE是由血流沖擊及血液纖溶系統綜合作用所致,面向血流面常呈“杯口狀”改變,血管造影檢查表現為密度均勻的充盈缺損[11]。PETCT常用于評估腫瘤的分期、轉移、復發和療效的判定。有研究表明,PET-CT對PPAS具有較高的診斷價值[12]。PPAS可對18-氟脫氧葡萄糖(18-fluorodeoxyglucose,18F-FDG)攝取增加,標準攝取值(standard uptake value,SUV)為(7.63±2.21),而血栓SUV較低,為(2.31±0.41)[13]。MRI具有良好的空間分辨率優勢,可較好地顯示肺動脈腔內腫塊與鄰近瓣膜、周圍組織的關系。肺動脈肉瘤在T1加權像(T1 weighted image,T1WI)上顯示中、低信號,在T2加權像(T2 weighted image,T2WI)上顯示高信號,并且表現出異質性增強效果;而血栓多數情況下在T1WI、T2WI上呈高信號,且血栓時期不同,表現出的信號不同[14-15]。肺通氣/灌注顯像作為一種功能性檢查,僅能明確肺血管內有無占位,尚不能明確占位性質。
本例患者為老年男性,以間斷咯血為主要臨床表現,并呈進行性加重,外院診斷為PTE,給予對癥治療后病情好轉出院。但患者出院后仍出現反復咯血,經本院CTPA檢查示PTE較前減輕,但左下肺動脈未顯影,外加外院增強CT檢查示左下肺動脈、左肺門軟組織不均勻強化,因此不能排除肺血管腫瘤;鑒于本院超聲支氣管鏡檢查下見左肺舌葉開口處有新生物生成,質軟易出血,腫瘤轉移可能性大;待患者病情平穩后行EBUS-TBNA,病理結果符合肉瘤表現,最終診斷為PPAS伴肺內轉移、PTE。
本例患者與既往病例報道不同之處在于其同時合并兩種肺栓塞相關性疾病,栓子性質包括瘤栓及血栓。有研究表明,若患者未出現下肢深靜脈血栓形成(deep venous thrombosis,DVT),則考慮診斷 PPAS[16-17]。但董帥等[18]報道了 1例PPAS合并下肢DVT患者,與上述結論不符。且本例患者無下肢DVT,但同時存在PPAS與PTE,亦不支持上述結論。考慮本例患者出現血栓、D-二聚體水平升高的原因與腫瘤細胞釋放的多種細胞因子增強了血小板活性、直接或間接激活凝血與纖溶過程相關[19],因而PPAS診斷與鑒別診斷仍需根據組織病理學檢查而非單純依賴凝血功能指標或下肢超聲檢查結果。腫瘤標志物指癌細胞分泌、脫落,或宿主對體內新生物反應而產生并進入到體液或組織中的物質。本例患者雖確診為PPAS,但腫瘤標志物為陰性,分析原因可能與瘤體中腫瘤細胞數量少、腫瘤生長緩慢等有關,但其具體機制仍有待進一步研究。PET-CT雖對PPAS具有較高的診斷價值[20-21],但仍有部分研究報道了18F-FDG低攝取或無攝取的肺血管腫物經手術證實為腫瘤的案例[22-23],本例患者與之相似。故對于PPAS可能性大但PET-CT檢查為陰性結果的患者亦不能排除診斷。
既往臨床常采用肺或肺葉切除術、肺動脈內膜剝脫術等外科手術方式取得病理標本,近年經皮血管內活檢術及EBUS-TBNA被逐步應用于臨床。XIE等[24]研究表明,血管內導管引導鉗活檢術(catheter guided forceps biopsy,CGFB)對PPAS的確診率可達75%,但該方法存在腫瘤種植、出血等并發癥發生風險[25]。EBUS-TBNA能較好地顯示腫瘤位置及其周圍血流信號,但考慮PPAS患者常合并肺動脈高壓,采用EBUS-TBNA可增加患者肺動脈穿孔、致命性大咯血、窒息等發生風險[26]。BOTANA-RIAL等[27]報道行EBUS-TBNA患者可出現自限性血管壁內血腫及縱隔氣腫。而CHAN等[28]報道了1例右肺動脈內非均質性低密度占位并縱隔腫瘤患者,通過EBUS-TBNA直接獲取其肺動脈外、縱隔內的病灶組織,最終證實為肺動脈肉瘤,并未出現肺動脈穿刺相關并發癥。綜上,EBUS-TBNA能否安全、成功地獲取病變組織與腫瘤細胞是否發生肺門和縱隔淋巴結轉移關系密切。
近年隨著EBUS-TBNA日益成熟,目前無絕對禁忌證,但針對肺動脈高壓、咯血等肺穿刺相關并發癥發生風險較高的腫瘤疑似患者,檢查前仍需綜合分析其病情,慎重權衡利弊。患者在行EBUS-TBNA前應進行出血風險評估,詳細詢問患者病史,并進行體格檢查,完善血常規、凝血功能等必要的實驗室檢查,按需調整口服抗凝藥及抗血小板藥物,備齊搶救設施。術中給予心電監護,密切監測生命體征,動作輕柔,采用支氣管腔內超聲觀察病灶血供情況,并綜合影像學檢查進一步評估穿刺出血發生風險;另外,在選取穿刺目標時,盡量避免穿刺血供豐富的病灶。針對出血風險較大但需行鏡下治療或鏡下穿刺者,可提前建立人工氣道如氣管插管、硬質支氣管鏡等,以降低出血、窒息等發生風險,考慮細針活檢取到的標本量較少,腫瘤組織的精準取材存在一定難度,故對醫師的內鏡技術要求較高。此外,EBUS-TBNA風險較大,病情不穩定患者應謹慎使用。
PPAS的腫瘤細胞轉移早、患者預后極差,早期癥狀隱匿,當出現明顯癥狀后生存時間僅為12~18個月[29]。早期診斷、腫瘤完整切除以及合理的輔助治療是延長患者生存期的關鍵。外科手術是PPAS首選的治療手段,可依據腫瘤位置、轉移情況及其與周圍組織的關系選擇不同術式,如肺或肺葉切除術、肺動脈內膜剝脫術、心肺聯合移植[30],而姑息性腫瘤減容手術有利于改善患者血流動力學,提高生存質量[31]。目前針對PPAS的放化療療效尚不明確,尚無文獻證明單純放化療能夠起到有效治療。有研究表明,術前輔助放化療可能縮小腫瘤,使腫瘤更易切除并降低手術相關并發癥,同時可延長術后中位生存期至20個月[32]。此外,多靶點酪氨酸激酶抑制劑帕唑帕尼目前已被批準用于軟組織腫瘤的二線治療[33],MDM2抑制劑MI-219及Nutlin-3的抗癌效果正在評估[34],靶向藥物在PPAS中的治療效果還有待進一步研究。
綜上所述,PPAS是一種罕見的血管源性惡性腫瘤,無特異性臨床表現及影像學表現,極易誤診為PTE,且確診難度大、預后差,且完整的手術切除和有效的輔助治療是延長患者生存時間的有效手段。因此,逐步提高對PPAS的認識,盡快明確診斷并給予干預是當前臨床醫師亟需達到的目標。
作者貢獻:康世威、袁雅冬進行文章的構思與設計;康世威進行文章的可行性分析,撰寫論文;何平、崔江華進行文獻/資料收集,進行英文的修訂;宮小薇、何平進行文獻/資料整理;宮小薇、袁雅冬進行論文的修訂;袁雅冬負責文章的質量控制及審校,并對文章整體負責、監督管理。
本文無利益沖突。

