靜電場輔助冷凍對面筋蛋白品質及分子結構的影響
張艷艷 王冰蕊 丁江濤 劉興麗 王宏偉 張 華
(鄭州輕工業(yè)大學食品與生物工程學院;食品生產與安全河南省協(xié)同創(chuàng)新中心;河南省冷鏈食品質量安全控制重點實驗室,鄭州 450002)
冷凍面團技術不僅可以有效地提高冷凍面制品的標準化,還能滿足人們對食品新鮮度的高要求[1]。然而常規(guī)的冷凍方式在冷凍過程中會產生較大冰晶,破壞面筋蛋白的網絡結構,導致面團持氣性下降,從而引起面制品的品質劣變,如體積變小、黏彈性降低、蒸煮后口感差、褐變、微生物超標等問題[2,3]。因此,探究改善冷凍面制品品質的方法,具有極其重要的意義。靜電場是一種新型的非熱技術,具有設備成本低、操作簡單等優(yōu)勢。其作用機制是在低溫環(huán)境下,通過電場擾動形成均勻的細小冰晶,從而減少冰晶對細胞結構的破壞[4]。在無靜電場作用下,由于水分子的偶極矩方向是任意的,冰晶在不同方向上生長的概率相同。施加靜電場后,沿靜電場方向冰核形成的概率最大,且冰晶生長主要沿電場方向進行(圖1),其他方向分布的水分子需要克服較大的位阻實現(xiàn)液-固的轉變,因此起到抑制冰晶生長的作用,降低冰晶的生長速率[5]。
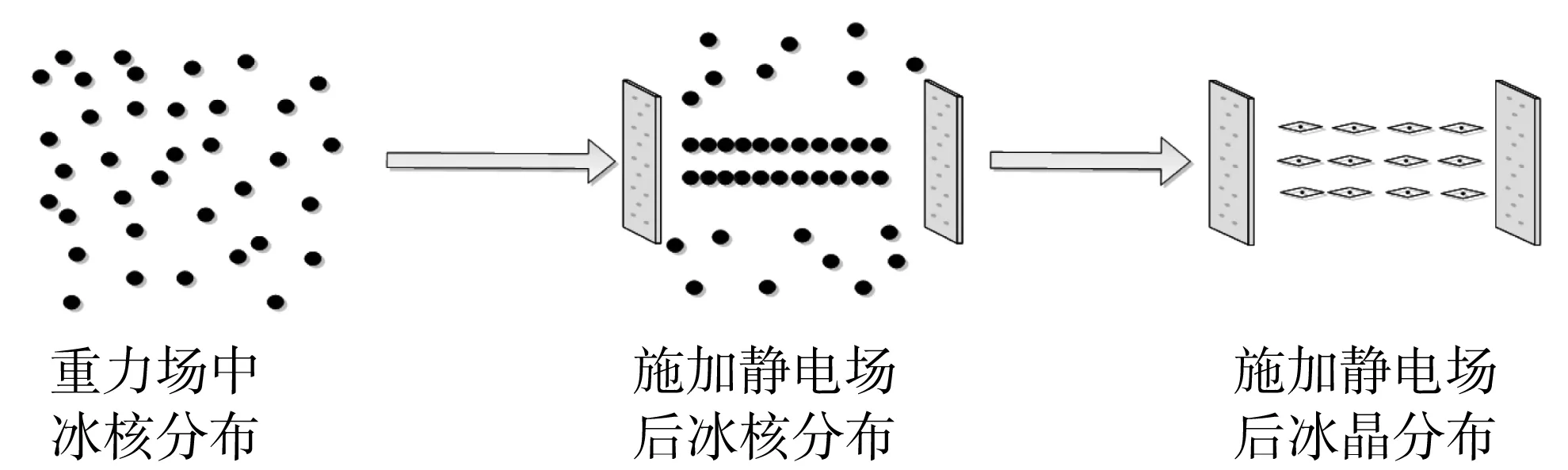
圖1 靜電場的作用機制圖
高文宏[6]研究發(fā)現(xiàn)靜電場對葡萄糖和蔗糖溶液中冰晶的生長都有不同程度的抑制作用,使得相變時間有所延長,在電場輔助冷凍過程中對食品產生積極影響,有利于維持食品較高的品質特征。尚柯等[7]研究發(fā)現(xiàn),靜電場輔助凍結牛肉能顯著縮短肉樣通過最大冰晶生成帶所用的時間,冰晶的體積小且均勻。Xanthakis等[8]研究靜電場輔助冷凍對豬肉的影響,結果發(fā)現(xiàn)靜電場輔助冷凍下形成冰晶的尺寸顯著減小,從而降低了對肉樣微觀結構的損害。
小麥面筋蛋白在面團強度、延展性和氣體滯留性方面起著決定性作用,其性能與面團的最終食用品質密切相關,因此,冷凍過程中面筋蛋白網絡結構的破壞,是影響面團品質劣變的主要原因之一[9]。本實驗將低頻交變電場施加到濕面筋蛋白體系的冷凍過程,研究其對面筋蛋白流變特性、水分分布和熱力學特性的影響;在分子水平上探究靜電場對面筋蛋白品質的改善作用,并采用激光顯微共焦拉曼光譜儀對其分子結構變化進行原位分析。
1 材料與方法
1.1 材料與試劑
小麥粉(蛋白質11.10%,含水量11.34%);三羥甲基氨基甲烷(Tris)、甘氨酸、5,5′-二硫代雙-2-硝基苯酸(DTNB)、尿素、牛血清蛋白、Folin-酚試劑等:分析純。
1.2 儀器與設備
JJJM54S 面筋洗滌儀,Discovery旋轉流動儀,DSC-Q20差式掃描量熱儀,HWS-080恒溫恒濕醒發(fā)箱,NMI-20低場核磁共振成像分析儀,LGL-50FD冷凍干燥機,TU-1810 PC紫外可見分光光度計,inVia激光顯微共焦拉曼光譜儀。
1.3 方法
1.3.1 電場輔助冷凍面筋蛋白
參考趙雷[10]面筋蛋白的提取方法并略有修改。準確稱取10 g小麥粉,緩慢倒入面筋洗滌杯中,加入4.5 mL質量濃度為2%的NaCl溶液,設置和面時間40 s,先用2%NaCl溶液洗滌3 min,再用蒸餾水洗滌2 min。洗滌完成后取出面筋蛋白,每個面筋蛋白樣品取3.5 g放入自封袋中備用。
將制備好的面筋蛋白置于溫度為-18 ℃、型號相同且放在同一環(huán)境下的施加電場和未施加電場的冰箱中冷凍,電場電壓分別為300、600、900 V,使用多路溫度測定儀實時監(jiān)測樣品中心溫度,當樣品中心溫度達到-18 ℃并穩(wěn)定60 min時,取出樣品。取部分樣品置于30 ℃的恒溫恒濕箱解凍30 min后用于直接測定水分分布和流變特性,剩余樣品冷凍干燥后研磨,過100目篩,得到小麥干面筋蛋白粉。
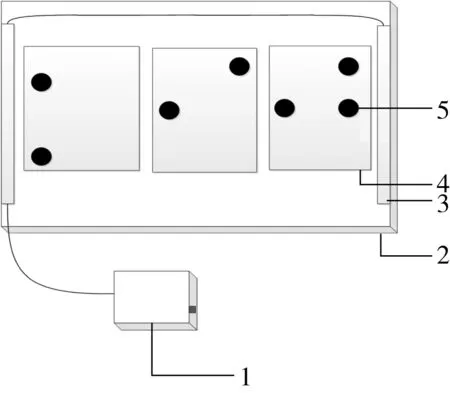
注:1.靜電場總電源,2.電冰箱,3.電場板,4.置物架,5.面筋蛋白。圖2 靜電場輔助冷凍面筋蛋白裝置圖
1.3.2 面筋蛋白流變學特性的測定
根據王沛[11]的方法并稍作改動。將不同強度下電場輔助冷凍的面筋蛋白解凍后,放置在旋轉流變儀的底板上,進行面筋蛋白流變學特性的測定。
1.3.3 面筋蛋白熱特性的測定
根據Huang等[12]的方法并稍作修改。準確稱取2~3 mg凍干面筋蛋白樣品,密封好加入DSC小鋁鍋中。以5 ℃/min的速度從25 ℃升到100 ℃。變性峰值溫度(Tp)和焓值(ΔH)采用TA系統(tǒng)中的Muse軟件分析計算。
1.3.4 面筋蛋白化學作用力的測定
參考Wang等[13]、Li等[14]、冷利萍[15]的方法,并稍作改動。取0.2 g凍干的面筋蛋白粉末分別與10 mL的0.05 mol/L NaCl(SA)、0.6 mol/L NaCl(SB)、 0.6 mol/L NaCl+1.5 mol/L尿素(SC)、0.6 mol/L NaCl+8 mol/L尿素(SD)以及0.6 mol/L NaCl+8mol/L尿素+1.5 mol/L尿素(SE)溶液混合,并在1 600 r/min離心均質15 s后,在4 ℃的條件下靜置1 h,于8 000 r/min離心20 min,取上清液測定其吸光度。用Folin-酚法測定上清液中蛋白質含量。離子鍵、氫鍵、疏水相互作用、二硫鍵的貢獻分別以溶解于SB溶液與SA溶液、SC溶液與SB溶液、SD溶液與SC溶液、SE溶液與SD溶液中蛋白質含量之差表示。
1.3.5 面筋蛋白分子結構的分析
采用激光顯微共焦拉曼光譜儀對面筋蛋白的二級結構、二硫鍵構型等分子結構進行原位分析。將冷凍干燥后的面筋蛋白,切成適當大小的方塊后,置于載玻片上,用激光顯微共焦拉曼光譜儀進行成像。成像參數為:激發(fā)波長785 nm,掃描面積1 000 μm ×1 000 μm,步長4 μm。對采集到的拉曼光譜的蛋白質二級結構(1 600~1 700 cm-1)和二硫鍵構型(500~550 cm-1)譜帶區(qū)間進行分析成像。
1.3.6 面筋蛋白的掃描電子顯微鏡觀察
將冷凍干燥后的面筋蛋白,切成適當大小的方塊后,噴金后貼于置物臺上,用掃描電子顯微鏡觀察樣品的微觀結構。
1.4 數據統(tǒng)計分析
采用Origin 8.5進行數據整理和作圖,SPSS 17.0軟件進行顯著性檢驗(P<0.05)。實驗重復3次取平均值,數據用平均值±標準偏差表示。
2 結果與分析
2.1 靜電場輔助冷凍對面筋蛋白流變特性的影響
由圖3可知,當電壓強度為300~600 V時,彈性模量和黏性模量呈增加趨勢,而當電壓強度為600~900 V時,G′、G″又開始降低。這可能是因為低強度電壓輔助冷凍處理后,可減少由于冰晶損傷所引起的非共價鍵的斷裂,且能減少大分子蛋白質聚合物的結構損傷,而高強度的電壓會損害面筋蛋白的網絡結構。損耗角正切值tanδ=G′′/G′,彈性模量均大于黏性模量(tanδ 值小于1),表明面筋蛋白復合體系介于黏性液體與彈性固體之間,具有類固體特性。在不同的電場強度下,面筋蛋白的tanδ 呈先增加后降低的趨勢,當靜電場的強度為600 V時,tanδ 值達到最大,這說明施加600 V的靜電場對面筋蛋白彈性的貢獻大于黏性,這有利于谷蛋白分子之間形成交聯(lián)結構,能更好地賦予面團彈性[16]。

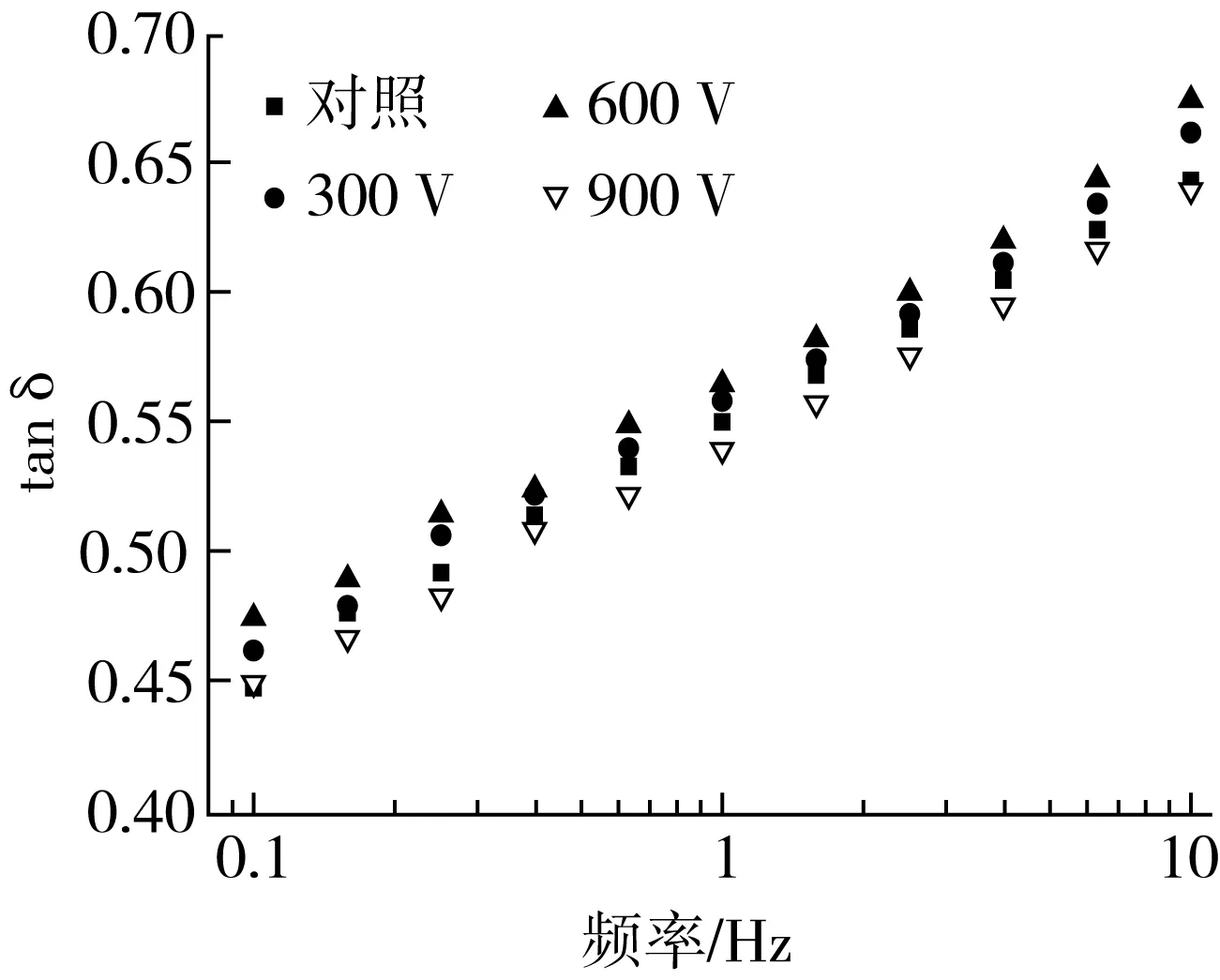
圖3 靜電場輔助冷凍對面筋蛋白流變特性的影響
2.2 靜電場輔助冷凍對面筋蛋白熱特性的影響
面筋蛋白的熱力學性質是反映面筋強度的重要特征,熱變性溫度(Tp)和變性焓(ΔH)是評估面筋蛋白熱穩(wěn)定性的主要參數[17]。由表1可知,與對照相比,不同強度下電場輔助冷凍的面筋蛋白樣品的Tp和ΔH均增加。Tp可用于評價物質的分子流動性和水化程度,當某種物質解聚時,其熱變性的溫度將降低,這說明施加靜電場后,面筋蛋白的低熱穩(wěn)定性提高,且減緩了冷凍對面筋蛋白網絡的空間結構的破壞[18]。ΔH反映面筋蛋白有序化結構的高低,由表1可以看出,隨著電場電壓的升高,面筋蛋白的ΔH呈先增加后降低的趨勢,且ΔH分別增加0.088、0.252、0.115 J/g。有研究表明,冷凍后面筋蛋白的ΔH降低,則面筋蛋白的有序結構減少,而施加300 V的靜電場后,面筋蛋白的有序性相對較高[19]。這可能是靜電場會抑制水分子的擴散運動,從而抑制冰晶的生長,而當電壓過高時,又會對面筋蛋白的網絡結構造成一定程度的破壞。

表1 靜電場輔助冷凍對面筋蛋白熱特性的影響
2.3 靜電場輔助冷凍對面筋蛋白化學作用力的影響
維持蛋白質三級網絡的化學作用力有離子鍵、氫鍵、疏水相互作用等,而二硫鍵是穩(wěn)定面筋蛋白網絡結構的重要化學鍵,麥谷蛋白通過鏈內和鏈間二硫鍵形成三維網絡結構的蛋白骨架,而醇溶蛋白通過氫鍵和疏水性共價鍵鑲嵌在麥谷蛋白網絡中[20]。如圖4所示,與傳統(tǒng)冷凍方式相比,施加靜電場后氫鍵的含量呈先降低后增加的趨勢,離子鍵、疏水相互作用和二硫鍵的含量則相反。氫鍵含量的減少可能是因為在冷凍過程中,靜電場會擾動水分子間氫鍵的形成,使冷凍過程中形成的冰晶較小且分布均勻,進而減少冷凍過程中冰晶對面筋網絡結構的破壞。疏水相互作用的增加可能是因為在靜電場的作用下,面筋蛋白的疏水性基團發(fā)生暴露,促使疏水相互作用增強,而電場強度過高時,由于蛋白質空間結構的改變,更多的疏水性氨基酸暴露,且生成了更復雜的結構,導致疏水相互作用減弱[21]。300 V的靜電場處理后,使巰基不斷地暴露和逐漸氧化,因此二硫鍵含量增加,而當靜電場電壓增大時,又會引起蛋白中二硫鍵的斷裂,從而引起二硫鍵含量的下降。靜電場作用下離子鍵的含量也顯著增加,這表明施加靜電場對冷凍過程中離子鍵的含量和疏水相互作用具有一定保護作用。
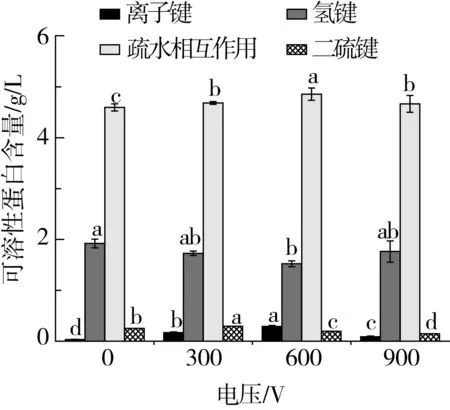
圖4 靜電場輔助冷凍對面筋蛋白化學作用力的影響
2.4 靜電場輔助冷對面筋蛋白分子結構的影響
研究面筋蛋白的2個主要區(qū)域,分別是1 600~1 700 cm-1(酰胺I帶)和500~550 cm-1(二硫鍵)。酰胺I帶(1 600~1 700 cm-1)是表征蛋白質的二級結構變化的一種有效方法。對二級結構的歸屬為:α-螺旋(1 645~1 660 cm-1),β-轉角(1 640~1 645 cm-1、1 680~1 690 cm-1),無規(guī)則卷曲(1 660~1 670 cm-1),β-折疊(1 670~1 680 cm-1)[22]。面筋蛋白中二級結構的變化如圖5所示,在300、600 V的靜電場電壓處理后,面筋蛋白各二級結構單元的分布更加均勻,當靜電場電壓為300 V時,α-螺旋的含量增加,這說明冷凍過程中面筋蛋白網絡結構的穩(wěn)定性增強,而當靜電場電壓增加到600 V以后,面筋蛋白中β-轉角和無規(guī)卷曲的含量增加,且電壓為900 V時各二級結構單元又產生聚集,這是因為高靜電場電壓導致面筋蛋白的結構無序化。

注:黃色、藍色為β-轉角,紅色為α-螺旋,綠色為無規(guī)則卷曲,水綠色為β-折疊。圖5 靜電場輔助冷凍面筋蛋白二級結構的共聚焦顯微拉曼圖
在拉曼光譜中,500~550 cm-1是S-S的特征振動譜帶,510 cm-1附近的譜峰歸屬于gauche-gauche-gauche(g-g-g)構型,536 cm-1附近的譜峰歸屬于trans-gauche-trans(t-g-t)構型,其中g-g-g構型是面筋蛋白中最主要的、能量最穩(wěn)定的構型[23]。如圖6所示,施加靜電場后面筋蛋白中g-g-g構型含量呈現(xiàn)先增加后減少的趨勢。當靜電場電壓為600 V時,面筋蛋白中的g-g-g構型的含量最多,這說明一定強度的靜電場電壓有利于面筋蛋白網絡狀結構的穩(wěn)定。

注:紅色為g-g-g構型,綠色為t-g-t構型。圖6 靜電場輔助冷凍面筋蛋白的二硫鍵構型的共聚焦顯微拉曼圖
2.5 靜電場輔助冷凍對面筋蛋白微觀結構的影響
圖7為面筋蛋白網絡結構的變化。對照組中面筋蛋白的網絡結構疏松,孔洞較大且分布不均勻,而靜電場輔助冷凍處理后的面筋蛋白的網絡結構較對照組有所改善,孔徑更小且分布均勻。這是因為在靜電場的作用下,相變初期容易形成冰核,且在冰晶的生長階段抑制水分子進行液—固轉變,從而降低冰晶的生長速度,使得冷凍過程中冰晶的大小和分布更加均勻,減少了冰晶體積增大對面筋蛋白網絡結構的破壞[24]。

圖7 靜電場輔助冷凍面筋蛋白微觀結構的影響(200×)
3 結論
研究不同靜電場電壓輔助冷凍對面筋蛋白品質及分子結構的影響,結果表明低電壓靜電場輔助冷凍有利于提高面筋蛋白的黏彈性和熱特性。化學作用力結果表明,當300 V靜電場電壓輔助冷凍面筋蛋白的疏水相互作用和二硫鍵含量增加,且激光共聚焦拉曼圖反映300、600 V的靜電場促進面筋蛋白的二級結構單元分布更加均勻且二硫鍵構型中g-g-g構型的含量增加,面筋蛋白微觀結構的觀察結果也進一步證明了300、600 V的靜電場電壓對面筋蛋白的網絡結構、黏彈性和熱特性的有效改善作用。而靜電場的電壓為900 V時,過大的電壓強度會破壞分子中的二硫鍵,造成面筋蛋白網絡結構的塌陷。因此,低電壓的靜電場輔助冷凍處理可以通過減少冷凍過程中冰晶的尺寸且使其分布更加均勻,有效地減少冷凍對面筋蛋白網絡的破壞作用。

