磁性導絲輔助腹主動脈瘤腔內修復術中通路建立的初步研究
厲祥濤,張 歡,張明逸,牛 帥,張福先
動脈瘤血管內修復術(endovascular aneurysm repair,EVAR)是腎下腹主動脈瘤(abdominal aortic aneurysm,AAA)一線治療方法[1-2]。目前EVAR術中較常見的支架特性各有不同,但大多是由具較長同側肢體和較短對側肢體主體組成分叉結構,一般先經同側股動脈入路放置好主體和長腿,再經對側股動脈入路送入導絲逆行通過短腿開口,最后沿導絲通路植入髂動脈分支。這類模塊化支架手術中可能遇到的問題是在主髂動脈扭曲、瘤體過大等情況下主體打開后對側短腿開口選入困難[3-4]。此時術者大多選擇建立肱動脈入路,自上而下地將導絲通過短腿開口,或從同側翻山通過短腿開口,最后從對側進入圈套器將導絲引出體外。但這往往延長手術時間、增加射線暴露,需要更多導絲導管,增加手術費用和并發癥風險。為了縮短植于髂動脈分支的時間,降低建立導絲通路難度,本研究設計出一款磁性導絲,并在動物體內驗證操作性能和安全性。
1 材料與方法
1.1 實驗材料
本款磁性導絲主要由導絲主體、磁頭和粘接材料組成,依靠頭端釹鐵硼N50永磁體作吸引,通過一入路引出導絲快速建立安全的工作通道。該導絲為0.038英寸超硬導絲,芯絲由奧氏體不銹鋼SUS304、繞絲由不銹鋼SUS316、不透射線繞絲由鉑鎳合金制成;導絲外部涂層為聚四氟乙烯,磁頭由一直徑1.4 mm、長度4.2 mm圓柱形釹鐵硼N50材料構成,適配6 F及以上導管。磁頭極性決定導絲極性,每套器械包括一N極和一S極導絲。Loctite M-31CL醫用環氧樹脂AB膠將導絲與磁頭緊密連接,可耐受>1 kg拉力。導絲平均對吻距離為0.65 cm,兩磁頭距離<0.65 cm時可自行相互對接,分離兩導絲所需拉力平均為0.7 N;對吻后導絲可順利通過血管鞘止血閥,被拉出體外。
由于實驗中磁性對吻導絲配合6 F導管會有部分漏血,本研究組裝了一實用的對吻導絲套裝,包括1根6 F Guiding導管、1個Y型止血閥、1個輸液三通管和1根對吻導絲(圖1)。該套裝在輔助導絲操作的同時,可減少導絲周圍漏血。
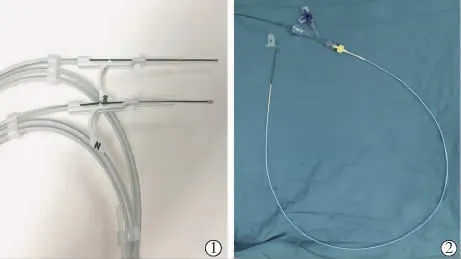
圖1 磁性導絲及其套裝實物圖
1.2 實驗方法
全身麻醉下行血管腔內操作,建立股動脈入路和左肱動脈入路,造影明確動脈情況;6 F Guiding導管協助下分別完成磁性導絲對接、拉力測試,并從其中一入路拉出體外建立兩入路間導絲通路,造影確定有無操作相關并發癥。記錄操作數據并測定自放置好Guiding導管至對接后導絲拉出體外的時間,完成手術后處死動物并解剖動脈,取腹主動脈末端和雙側髂總動脈進行病理檢測,評估有無動脈損傷。
1.3 動物準備和麻醉
磁性對吻導絲的安全性和操作性測試在羊模型中進行。實驗流程由阜外醫院動物倫理委員會通過(編號0096-2-18-GZ-X)。6只體質量約60 kg綿羊,經甲苯噻嗪(2.2 mg/kg)聯合舒泰(6 mg/kg)誘導全身麻醉后,經口給予氣管內插管。麻醉維持通過氯胺酮(4 g/1 000 mL)、芬太尼(0.5 mg/1 000 mL),以8 mL·kg-1·h-1速率持續泵入。手術過程中檢測血壓、心率,早期發現出血并發癥。給予全身肝素化,檢測活化凝血時間(ACT)為250~300 s。
1.4 實驗步驟
①手術在動物專用介入實驗室進行,將動物完全麻醉、氣管插管后固定于手術臺,給予抗生素預防感染,地塞米松抗過敏,普通肝素肝素化。②于股動脈和左肱動脈穿刺區域切開皮膚暴露動脈,直視下采用改良Seldinger技術穿刺動脈,植入7 F血管短鞘,肝素化0.9%氯化鈉溶液沖洗鞘管。③超滑導絲配合豬尾導管進入主動脈弓,注射碘海醇作主動脈造影,明確鎖骨下動脈、主動脈和髂動脈是否通暢;更換導絲套裝,自兩入路分別送入6 F Guiding導管,更換磁性導絲,兩導絲分別交匯于髂總動脈、腹主動脈時進行對接,拉力計測量不同部位對接拉力、分離拉力;從肱動脈或股動脈入路拉出對接后的導絲,迅速建立導絲通路;導管撤出后,再將對接后的導絲從短鞘中拉出體外,觀察兩導絲能否通過止血閥;豬尾導管再次進入主動脈弓部作弓部、主髂動脈造影,明確有無操作并發癥。④同時觀察對吻導絲顯影性能和與導管適配性。手術完成后注射氯化鉀處死動物,取出腹主動脈和雙髂動脈各10 cm并置于4%甲醛溶液中保存。
1.5 對吻距離和拉力測量
當兩個磁極位置小于一定距離,靠自身磁性可相互吸引,這個距離稱作對吻距離。通過動態DSA影像測量對吻距離。導絲對吻后一側導絲連接數字拉力計,測量分離拉力。兩導絲對吻并進入一側導管后,撤出另一側導管,觀察導絲吸引力能否承受血管鞘止血閥阻力,緩慢地從血管鞘中拉出體外。
1.6 取材觀察
取材后切開動脈,直視下觀察有無內膜破損、血栓形成;蘇木精-伊紅(HE)染色切片10倍顯微鏡下,重點觀察有無血管內膜水腫、內膜缺損、夾層等情況。
2 結果
磁性導絲套裝性能實驗顯示,其協助磁性導絲成功地完成了導絲通路建立,導絲可很好地適配6 F Guiding導管,操作性良好,整個手術過程中未發現漏血現象。磁性導絲操作性能實驗顯示,導絲在血管內顯影良好,磁頭與導絲結合牢固,無分離現象;5只羊腹主動脈通暢,導絲進入后順利對接,1只羊因主動脈迂曲5次嘗試后最終成功對接,順利從一側入路引出導絲;平均操作時間15 s(圖2),導絲平均對吻距離為0.64 cm,導絲對吻后分離拉力平均為0.7 N;撤出一側Guiding導管,拉出對吻后的導絲過程中導絲吸引力可承受血管鞘止血閥的阻力。磁性導絲安全性評估顯示,術前造影明確動脈通暢,無明顯異常,術后復查造影未發現血栓形成、夾層、動脈穿孔、充盈缺損和對比劑外滲等并發癥,腹主動脈和髂動脈標本直視觀察正常;組織病理學檢查無動脈內膜損傷或小夾層形成(圖3)。
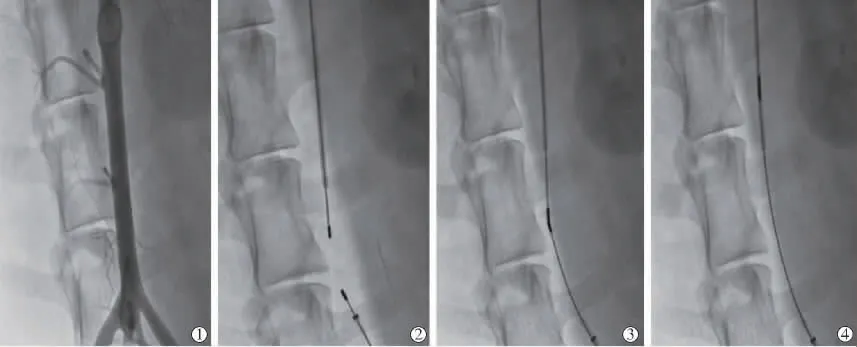
圖2 磁性導絲輔助通路建立的操作過程
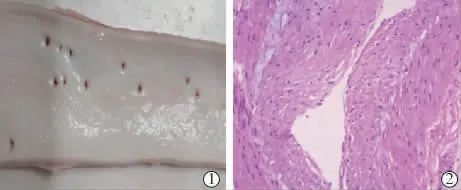
圖3 主髂動脈術后取材標本
3 討論
EVAR手術中應用的大多數支架移植物呈模塊化,在植入這種支架系統至髂動脈分支時很重要的一步是沿著對側選入短腿的導絲釋放。但如果存在患者解剖復雜、瘤體過大、扭曲或支架選擇不理想等情況,傳統逆行方法往往很難奏效,這很大程度增加了手術時間、手術風險和射線暴露。尤其是在破裂AAA治療中,縮短手術時間意味著增加挽救生命的機會。因此,臨床上嘗試各種方法,旨在簡化復雜AAA髂動脈分支放置難度。
大多數情況下,逆行導絲選入短腿失敗后術者會從同側股動脈送入Simmons導管和0.035導絲,將導絲翻山至對側,經過短腿進入腹主動脈或髂總動脈,然后用圈套器將導絲抓出體外,建立導絲通路。Titus等[5]報道101例AAA患者前瞻性對照研究,發現翻山方法與傳統逆行方法在成功率方面差異無統計學意義;逆行操作>5 min,傳統逆行方法成功率明顯降低,這時翻山技術更為有效;動脈瘤壁壓迫短腿開口打開不完全時,翻山技術可能不會成功。有學者提出可嘗試微導管、微導絲行翻山操作。Maleux等[6]在系列病例研究中發現,短腿開口未完全打開致使傳統方法失敗后,改用微導絲、導管技術成功建立了導絲通路,最終釋放至髂動脈分支;認為操作成功的原因在于微導管系統管徑小、操作性能良好,同時還可采用微導管介導Ⅱ型內漏栓塞和髂內動脈栓塞。另一種方法是建立肱動脈入路,自上而下將導絲穿過短腿開口,同樣再用圈套器抓出體外。有學者擔心這會增加肱動脈入路相關并發癥,且需要通過鎖骨下動脈、主動脈弓,可增加腦梗死、弓部損傷等并發癥。其實,有經驗的醫師超聲導引下穿刺及選用4 F導管并不會明顯增加手術風險。Dang等[7]回顧性分析100例接受EVAR術Zenith支架植入患者,結果發現左側送入支架主體會明顯縮短對側髂動脈分支置管所需時間,受訪患者中84%左髂總動脈開口在右髂總開口后方,16%兩髂總動脈開口位于同一水平;尤其是右髂總開口靠前患者,從左側釋放支架主體的同時稍微順時針旋轉,讓短腿靠前正對右髂總動脈開口,有利于導絲選入短腿。此外,支架移植物改進可能會簡化髂動脈分支釋放過程。例如C3-Excluder支架允許部分主體回收和重新釋放,調整位置,以增加導絲選入短腿的可能性[8]。
本研究將釹鐵硼永磁體粘接到超硬導絲上,制作出全新磁性導絲;導絲可順利通過6 F導管,且導絲頭端相互靠近<0.65 cm時,兩導絲可自動吸引并牢固結合;對接后的導絲拉出體外過程中,可克服血管鞘止血閥阻力保持不分開;實驗中發現6 F導管對于導絲主體而言內徑過大,會導致導管內漏血,因此連接上一止血閥和3通組成套裝;導絲在動物實驗中顯顯出良好顯影性能,并可輕松完成對接并進入導管,動脈造影和術后組織病理檢查也顯示導絲未對管壁造成損傷。本實驗結果表明磁性導絲有效性和安全性評估良好,可快速建立導絲通路,有助于輔助EVAR術后髂動脈分支置管。本研究建議,如果逆行選入短腿操作>5 min,或術前影像提示逆行困難,可選擇采用磁性導絲輔助建立導絲通路,以縮短手術時間。本實驗中導絲通路建立的平均時間為15 s,而臨床中圈套器輔助導絲通路建立則需較長時間。Titus等[5]對比分析顯示,圈套器輔助導絲通路建立需時為2.7 min,但僅1/4患者操作時間<2 min,2%患者<15 min,另有2%患者最終未成功建立通路。因此,新型磁性導絲可明顯縮短導絲通路建立的時間,同時避免使用圈套器,可極大地降低醫療費用。
本研究有一定的局限性:①選用正常羊的動脈,未制作AAA模型,與臨床實際病變有明顯差異,可能導致結果變化;②由于導絲僵硬,兩根導絲在較粗的扭曲動脈內對接比較困難。下一步將軟化導絲,使導絲頭端在動脈血流沖擊下有一定的搖擺性,增加對接機會。
綜上所述,新型磁性導絲具有良好的操作性和安全性,可在EVAR手術中快速建立導絲通路,有利于解決髂動脈分支置管中導絲選入支架短腿困難的問題。

