PDCA循環(huán)在我院藥品不良反應(yīng)監(jiān)測中的效果研究
程振田,周蕓,袁祥萍,單麗妮
(濰坊市益都中心醫(yī)院,山東 濰坊 262500)
用藥安全問題是目前全球共同關(guān)注的焦點(diǎn),1972年世界衛(wèi)生組織明確了藥品不良反應(yīng)(adverse drug reaction,ADR)的定義,即正常劑量的藥物用于預(yù)防、診斷、治療疾病或調(diào)節(jié)生理功能時(shí)出現(xiàn)的有害的和與用藥目的無關(guān)的反應(yīng)[1-2]。隨著社會醫(yī)療體系的不斷完善,患者接受的藥物治療日益復(fù)雜,同時(shí),藥物治療所導(dǎo)致的不良反應(yīng)事件也在不斷增多,嚴(yán)重者甚至可直接威脅患者的生命安全[3]。保障人體用藥安全,維護(hù)人民身體健康和合法用藥的權(quán)益,是《中華人民共和國藥品管理法》的立法宗旨,《藥品管理法》(2019年修訂版)第八十一條規(guī)定:醫(yī)療機(jī)構(gòu)應(yīng)當(dāng)經(jīng)常考察本單位使用的藥品質(zhì)量、療效和不良反應(yīng),發(fā)現(xiàn)疑似不良反應(yīng)的,應(yīng)及時(shí)向藥品監(jiān)督管理部門和衛(wèi)生健康主管部門報(bào)告。開展ADR監(jiān)測工作是醫(yī)療機(jī)構(gòu)的責(zé)任和義務(wù),也是預(yù)防ADR發(fā)生、促進(jìn)臨床合理用藥的重要手段[4]。
PDCA循環(huán)又稱戴明環(huán),是質(zhì)量保證體系運(yùn)轉(zhuǎn)的基本方式,亦是質(zhì)量管理應(yīng)遵循的科學(xué)程序,主要包括計(jì)劃(plan,P)、執(zhí)行(do,D)、檢查(check,C)、處理(action,A)4個(gè)階段。通過不斷發(fā)現(xiàn)實(shí)際應(yīng)用中出現(xiàn)的問題,找到引發(fā)問題的原因并總結(jié)經(jīng)驗(yàn),采取相關(guān)措施進(jìn)行處理,通過不停地修改使工作步驟、思想方法逐漸實(shí)現(xiàn)科學(xué)化、系統(tǒng)化、條理化,達(dá)到提高管理質(zhì)量的目的[5]。
我院自2012年開展ADR監(jiān)測工作以來,由于部分科室醫(yī)務(wù)人員報(bào)告意識薄弱,填報(bào)流程不熟悉等問題,使得醫(yī)院近幾年出現(xiàn)ADR上報(bào)數(shù)量少,新的及嚴(yán)重的報(bào)告數(shù)量少、參與上報(bào)科室少、病程記錄率低等現(xiàn)象。本研究自2019年1月起,將PDCA循環(huán)應(yīng)用于ADR監(jiān)測實(shí)踐中,經(jīng)過2個(gè)循環(huán)后明顯提高了我院ADR監(jiān)測報(bào)告的上報(bào)數(shù)量及質(zhì)量。
1 資料與方法
1.1 資料來源 收集我院國家藥品不良反應(yīng)監(jiān)測系統(tǒng)中運(yùn)用PDCA循環(huán)干預(yù)前(2017—2018年)和2個(gè)循環(huán)干預(yù)后(2019—2021年)上報(bào)的有效ADR報(bào)告(均為市藥品不良反應(yīng)監(jiān)測中心接收的報(bào)告),進(jìn)行研究分析。
1.2 研究指標(biāo) ADR上報(bào)總數(shù)量、新的及嚴(yán)重的ADR上報(bào)數(shù)量(下稱新/嚴(yán)數(shù)量)、上報(bào)科室數(shù)、病程記錄率。
1.3 PDCA循環(huán)實(shí)施過程 采用PDCA循環(huán)對我院ADR上報(bào)工作進(jìn)行干預(yù),通過對ADR上報(bào)數(shù)量、新/嚴(yán)數(shù)量、上報(bào)科室數(shù)及病程記錄率等數(shù)據(jù)的統(tǒng)計(jì),分析PDCA循環(huán)干預(yù)前后我院ADR上報(bào)情況的變化[6-7]。
1.4 2019年
1.4.1 計(jì)劃(P) 通過分析我院2017—2018年的ADR上報(bào)情況發(fā)現(xiàn),存在的主要問題為上報(bào)總數(shù)少、新/嚴(yán)數(shù)量少、上報(bào)科室少、病程記錄率低,藥品不良反應(yīng)監(jiān)測小組人員利用頭腦風(fēng)暴法,對上述問題產(chǎn)生的原因進(jìn)行了分析,結(jié)果以魚骨圖(見圖1)標(biāo)示:醫(yī)務(wù)人員不了解ADR上報(bào)為免責(zé)行為,擔(dān)心引發(fā)醫(yī)療糾紛;培訓(xùn)不到位,醫(yī)務(wù)人員不能準(zhǔn)確判斷相關(guān)事件是否為ADR,無上報(bào)意識,不熟悉上報(bào)流程,未及時(shí)將其記錄于病歷;ADR制度不完善,未明確具體要求,未做到專人負(fù)責(zé);上報(bào)流程復(fù)雜,效率低;無有效獎懲方案。

圖1 2019年我院ADR上報(bào)數(shù)量及質(zhì)量不達(dá)標(biāo)原因魚骨圖
根據(jù)存在的問題,藥品不良反應(yīng)監(jiān)測小組制定相關(guān)對策:①修訂ADR上報(bào)制度,明確上報(bào)要求;②進(jìn)行相關(guān)知識培訓(xùn),提高醫(yī)務(wù)人員對ADR的認(rèn)識;③建立有效獎懲方案;④及時(shí)向臨床反饋上報(bào)情況,對存在問題的報(bào)表進(jìn)行告知;⑤完善ADR上報(bào)流程及藥物說明書查詢系統(tǒng)。
1.4.2 執(zhí)行(D) 針對我院ADR監(jiān)測工作現(xiàn)狀制定相關(guān)政策,采取以下具體改進(jìn)措施:
①修訂并完善ADR上報(bào)制度,明確上報(bào)要求:制定科室上報(bào)目標(biāo),各臨床科室每月1份;在各臨床科室設(shè)置管理員,負(fù)責(zé)科室藥品不良反應(yīng)上報(bào)、匯總及分析等相關(guān)工作;明確填報(bào)原則及報(bào)表填報(bào)要求,可疑即報(bào),發(fā)生的ADR記錄于病程中,無病程記錄者不予上報(bào)。
②進(jìn)行ADR相關(guān)培訓(xùn):進(jìn)行2次ADR知識培訓(xùn),對相關(guān)定義、可能性關(guān)系判定、上報(bào)要求、上報(bào)流程等內(nèi)容進(jìn)行培訓(xùn),提高醫(yī)務(wù)人員認(rèn)識。
③建立有效獎懲方案:每季度對臨床科室上報(bào)情況進(jìn)行匯總,根據(jù)完成情況對科室進(jìn)行獎懲,完成目標(biāo)(3份)者每份獎勵30元,未完成目標(biāo)者,每缺少一份扣100元。
④及時(shí)反饋上報(bào)情況,將總結(jié)情況在質(zhì)量報(bào)告中公布:每季度上報(bào)工作結(jié)束后,對各科室上報(bào)情況進(jìn)行分析,包括是否為合格報(bào)表及報(bào)表征存在問題,通過辦公系統(tǒng)及時(shí)通報(bào)各臨床科室;同時(shí)對上報(bào)內(nèi)容進(jìn)行分析,通過質(zhì)量安全簡報(bào)反饋于各臨床科室。
⑤完善ADR上報(bào)流程及藥物說明書查詢系統(tǒng):我院所有的不良事件由質(zhì)量控制科統(tǒng)一管理,在ADR上報(bào)及退回修改時(shí)均需通過質(zhì)量控制科轉(zhuǎn)發(fā)。2019年簡化ADR上報(bào)流程,臨床科室直接上報(bào)于藥學(xué)部,減少質(zhì)量管理科轉(zhuǎn)發(fā),提高上報(bào)效率;引進(jìn)合理用藥系統(tǒng),可查詢我院配備藥品信息。
1.4.3 檢查(C) 該階段主要對相關(guān)改進(jìn)措施實(shí)施后我院的ADR上報(bào)情況進(jìn)行分析,以便及時(shí)發(fā)現(xiàn)相關(guān)措施執(zhí)行中的問題,主要方法為:每季度對藥品不良反應(yīng)上報(bào)情況,通過辦公系統(tǒng)進(jìn)行公示,并在質(zhì)量簡報(bào)中進(jìn)行分析,將完成情況及存在問題反饋于各臨床科室;對各科室每季度ADR上報(bào)情況進(jìn)行單獨(dú)考核,并及時(shí)落實(shí)獎懲。
1.4.4 處理(A) 每季度對上報(bào)ADR報(bào)表者進(jìn)行獎勵,鼓勵醫(yī)務(wù)人員上報(bào);針對檢查階段發(fā)現(xiàn)的問題,進(jìn)一步制定并修改相關(guān)措施,進(jìn)入下一個(gè)PDCA循環(huán)。
1.5 2020年
1.5.1 計(jì)劃(P) 通過分析我院2019年的ADR上報(bào)情況發(fā)現(xiàn),與2018年上報(bào)情況相比,上報(bào)總數(shù)、新/嚴(yán)數(shù)量、上報(bào)科室、病程記錄率均有所上升,PDCA循環(huán)有效。但上述幾項(xiàng)指標(biāo)仍未達(dá)到預(yù)期目標(biāo)值,進(jìn)入下一個(gè)PDCA循環(huán)。
藥品不良反應(yīng)監(jiān)測小組再次對問題原因進(jìn)行了分析,結(jié)果以魚骨圖(見圖2)標(biāo)示:獎懲缺乏力度,科室不重視;培訓(xùn)僅針對科室管理員,普通醫(yī)務(wù)人員不了解ADR相關(guān)知識,無上報(bào)意識;臨床科室僅管理員上報(bào),不能及時(shí)發(fā)現(xiàn)所有ADR;上報(bào)ADR報(bào)表時(shí)需使用多個(gè)程序,過程煩瑣;對于新/嚴(yán)ADR未給予特別獎懲。

圖2 2020年我院ADR上報(bào)數(shù)量及質(zhì)量不達(dá)標(biāo)原因魚骨圖
藥品不良反應(yīng)監(jiān)測小組制定相關(guān)對策:①將ADR上報(bào)納入綜合目標(biāo)考核,建立有效績效考核方案;②更新及完善ADR上報(bào)系統(tǒng);③修訂ADR上報(bào)制度,賦予新/嚴(yán)報(bào)表更多分值,鼓勵上報(bào)新/嚴(yán)ADR;④進(jìn)行新/嚴(yán)ADR相關(guān)知識培訓(xùn),提高醫(yī)務(wù)人員的認(rèn)識;⑤對于上報(bào)數(shù)量多、報(bào)表質(zhì)量好的個(gè)人,優(yōu)先推薦評選市ADR上報(bào)先進(jìn)個(gè)人。
1.5.2 執(zhí)行(D) 針對我院ADR監(jiān)測工作現(xiàn)狀制定相關(guān)政策,采取以下具體改進(jìn)措施:
①納入綜合目標(biāo)考核,建立有效績效考核方案:將ADR上報(bào)情況納入科室綜合目標(biāo)考核,并進(jìn)行單獨(dú)考核,滿分3分。如未完成上報(bào)數(shù)量,扣罰科室相應(yīng)績效工資。
②引進(jìn)中國醫(yī)院藥物警戒系統(tǒng),完善流程:2020年我院引入并安裝中國醫(yī)院藥物警戒系統(tǒng)(CHPS),對報(bào)表填寫項(xiàng)目進(jìn)行定義和規(guī)范;將CHPS系統(tǒng)與我院各系統(tǒng)進(jìn)行對接,可直接調(diào)用各系統(tǒng)數(shù)據(jù),減少上報(bào)人員工作復(fù)雜;修改上報(bào)流程,增加退回報(bào)表功能,使上報(bào)流程進(jìn)一步完善。
③修訂并完善ADR上報(bào)制度,賦予新/嚴(yán)報(bào)表更多分值:一般的報(bào)表0.5分/份,新/嚴(yán)報(bào)表1分/份。
④進(jìn)行ADR相關(guān)培訓(xùn):安排2次ADR知識培訓(xùn),對新/嚴(yán)報(bào)表相關(guān)定義、制度改變、CHPS系統(tǒng)使用方法、上報(bào)流程改變等內(nèi)容進(jìn)行培訓(xùn),提高醫(yī)務(wù)人員認(rèn)識及積極性。
⑤對于上報(bào)數(shù)量多、報(bào)表質(zhì)量好的個(gè)人,優(yōu)先推薦評選市ADR上報(bào)先進(jìn)個(gè)人。
1.5.3 檢查(C) 該階段主要對相關(guān)改進(jìn)措施實(shí)施后我院的ADR上報(bào)情況進(jìn)行分析,以便及時(shí)發(fā)現(xiàn)相關(guān)措施執(zhí)行中的問題,主要方法為:每季度對藥品不良反應(yīng)上報(bào)情況,通過辦公系統(tǒng)進(jìn)行公示,并在質(zhì)量簡報(bào)中進(jìn)行分析,將完成情況、存在問題及CHPS系統(tǒng)使用情況反饋于各臨床科室;對各科室每季度ADR上報(bào)情況進(jìn)行單獨(dú)考核,并與科室績效掛鉤。
1.5.4 處理(A) 2020年重新修訂《藥品不良反應(yīng)/事件監(jiān)測及報(bào)告制度》,完善上報(bào)流程,對于上報(bào)數(shù)量為零的科室進(jìn)行重點(diǎn)宣教;針對檢查階段發(fā)現(xiàn)的問題,進(jìn)一步制定并修改相關(guān)措施:每季度對科室進(jìn)行單項(xiàng)績效考核,提高科室重視度,鼓勵醫(yī)務(wù)人員上報(bào),并于必要時(shí)針對相關(guān)問題進(jìn)行下一個(gè)PDCA循環(huán)。
2 結(jié)果
2.1 藥品不良反應(yīng)上報(bào)情況 結(jié)果見表1。本市市場監(jiān)督管理局為我院制定指標(biāo)為:ADR上報(bào)總數(shù)量為500份/年、新/嚴(yán)數(shù)量分別為100份和75份。我院為三級甲等醫(yī)院,開放床位1 200張。2020年我院年住院患者6萬人次,門診患者藥物處方50萬人次,有能力完成制定指標(biāo)。
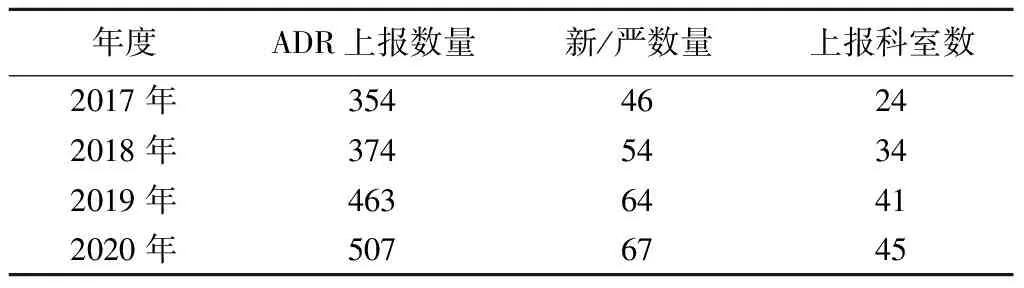
表1 2017—2020年ADR上報(bào)情況
①上報(bào)數(shù)量達(dá)到市場監(jiān)督管理局制定指標(biāo)。2017—2018年,即PDCA循環(huán)干預(yù)前,我院分別為354份和374份,未達(dá)到市場監(jiān)督管理局制定指標(biāo)。運(yùn)用PDCA循環(huán)進(jìn)行干預(yù)后,2019年上報(bào)數(shù)量有所提高,達(dá)到了463份;經(jīng)過第二個(gè)PDCA循環(huán)后,2020年上報(bào)數(shù)量為507份,達(dá)到本市市場監(jiān)督管理局制定的指標(biāo)。
②新/嚴(yán)數(shù)量未達(dá)到市場監(jiān)督管理局制定指標(biāo),繼續(xù)進(jìn)入下一個(gè)PDCA循環(huán)進(jìn)行干預(yù)。2017—2018年,即PDCA循環(huán)干預(yù)前,新/嚴(yán)數(shù)量分別為46份和54份,未達(dá)到市場監(jiān)督管理局制定指標(biāo)。經(jīng)過2個(gè)PDCA循環(huán)干預(yù)后,2019年及2020年新/嚴(yán)數(shù)量提高到64份及67份,但仍未達(dá)到本市市場監(jiān)督管理局制定的指標(biāo)。2021年將進(jìn)入下一個(gè)PDCA循環(huán),持續(xù)改進(jìn)。
③上報(bào)科室數(shù)量有所提高。我院共50個(gè)臨床科室,2017—2018年,即PDCA循環(huán)干預(yù)前,我院分別有24個(gè)和34個(gè)臨床科室參與ADR上報(bào)。經(jīng)過兩次PDCA循環(huán)后,2020年有45個(gè)科室參與上報(bào),僅有5個(gè)科室未參與上報(bào)。2021年將針對未參與上報(bào)科室重點(diǎn)開展培訓(xùn)。
2.2 藥品不良反應(yīng)病程記錄率 結(jié)果見表2。病程記錄率達(dá)到三級醫(yī)院評審標(biāo)準(zhǔn)要求。2017—2018年,即PDCA循環(huán)干預(yù)前,我院ADR病程記錄率分別為75.42%和79.95%,不符合三級醫(yī)院評審標(biāo)準(zhǔn)要求。運(yùn)用PDCA循環(huán)進(jìn)行干預(yù)后,2019年病程記錄率提高到92.44%;經(jīng)過第二個(gè)PDCA循環(huán)后,2020年病程記錄率已達(dá)100%,符合三級醫(yī)院評審標(biāo)準(zhǔn)要求。

表2 2017—2020年ADR病程記錄率情況
2.3 不足
2.3.1 ADR報(bào)告率低 結(jié)果見表3。WHO的統(tǒng)計(jì)數(shù)據(jù)表明:全球每年住院患者中 ADR 的發(fā)生率為 10%~20%,其中,因嚴(yán)重 ADR 導(dǎo)致的病死率約為5%[8]。我院2020年上報(bào)率為0.09%,仍有較大提高空間。
2.3.2 門診患者上報(bào)比例低 結(jié)果見表4。2020年我院門診處方人次遠(yuǎn)高于住院人次,而我院ADR報(bào)表中,12例為門診患者上報(bào),495例為住院患者上報(bào),門診患者占比僅為2.37%,2021年需關(guān)注門診患者ADR情況。
3 討論
PDCA循環(huán)是一種可全面改善管理質(zhì)量的科學(xué)程序及通用模型[9],我院的 ADR 上報(bào)和監(jiān)測工作自引入 PDCA循環(huán)管理模式后,在醫(yī)院高度重視及多學(xué)科、多部門、多專業(yè)的相互協(xié)作下,通過完善制度、加強(qiáng)監(jiān)督培訓(xùn)、建設(shè)信息系統(tǒng)等措施,提高了全院醫(yī)務(wù)人員對 ADR上報(bào)的重視程度,ADR上報(bào)數(shù)量及質(zhì)量均顯著改善。對ADR上報(bào)工作中存在的不足,可進(jìn)入下一個(gè)PDCA循環(huán),持續(xù)改進(jìn)。
醫(yī)院上報(bào)ADR可幫助國家藥品監(jiān)督管理局統(tǒng)計(jì)數(shù)據(jù),及時(shí)識別臨床風(fēng)險(xiǎn)信號,預(yù)防嚴(yán)重藥品不良反應(yīng)的發(fā)生,對于促進(jìn)臨床用藥的合理性和安全性具有重大意義,為了提高醫(yī)院ADR監(jiān)測的力度和質(zhì)量,應(yīng)積極運(yùn)用新型管理模式對監(jiān)測工作進(jìn)行干預(yù)[10],并通過干預(yù)措施的實(shí)施,可提升全體醫(yī)務(wù)人員對于藥品不良反應(yīng)的發(fā)現(xiàn)、報(bào)告、評價(jià)及預(yù)警能力,為評價(jià)、整頓和淘汰高風(fēng)險(xiǎn)藥品提供臨床依據(jù),為探索構(gòu)建醫(yī)院藥品不良反應(yīng)監(jiān)測預(yù)警體系提供安全用藥保障,從而達(dá)到保障臨床用藥的合理性與安全性。

