體外三維肝細胞模型在藥物肝毒性評價中的應用
何原子,張雷,吳春勇*,張峻穎
(1.中國藥科大學藥物質量與安全預警教育部重點實驗室,江蘇 南京 210009;2.中國藥科大學藥物分析教研室,江蘇 南京 211198;3.山東省食品藥品檢驗研究院,山東 濟南 250101;4.中國藥科大學中藥制劑教研室,江蘇 南京 211198)
肝臟是負責異源生物代謝的主要器官,也是藥物及其代謝物發生不良反應的重要靶器官。據統計,在進入Ⅲ期臨床試驗階段的新藥中,20%以上的候選藥物出現肝毒性[1-2],每個新化學實體的經濟損失高達26億美元[3]。因此,開發可以真實預測藥物誘導肝毒性(drug-induced hepatotoxicity)的肝臟模型,并用于臨床前肝毒性藥物篩選,對于新藥研發至關重要。盡管動物模型可以在一定程度上反映藥物在復雜機體內的處置情況,但實驗成本高、周期長以及種屬差異等缺點限制了此類模型在肝毒性預測方面的大規模應用。
人原代肝細胞(primary human hepatocytes,PHH)的平面培養模型是目前評估藥物代謝和毒性的金標準模型[4],但在2D培養過程中,原代肝細胞迅速去分化并喪失肝臟特異性功能[5],無法有效監測長期或重復給藥時的肝毒性反應[6]。
為了解決上述難題,3D細胞培養技術被用于體外肝細胞模型的構建。與傳統的2D細胞模型相比,3D肝細胞模型可以在體外模擬細胞-細胞、細胞-細胞外基質(extracellular cell matrix,ECM)的相互作用,進而重現肝組織的特異性功能,為體外預測藥物毒性提供了更高的生理相關性[7]。一個理想的體外3D肝細胞模型應當滿足以下要求[8-11]:①在Ⅰ、Ⅱ型代謝酶、轉運體以及肝臟特異性蛋白上與體內肝細胞具有一致的表型;②可在較長的時間內穩定維持肝細胞活力以及肝臟特異性功能;③對藥物的毒性反應靈敏,且具有分辨急性或長期肝毒性藥物的能力;④可重現體內形態學特征與生理參數,如膽管的生成、與非實質細胞的共培養以及含氧水平等;⑤適用于高通量毒性藥物篩選。與3D肝細胞模型相關的評價指標見表1。
研究人員已經開發出許多建立3D肝細胞模型的方法,本綜述將重點討論三明治模型、球樣體模型、3D打印模型以及微流控模型在肝毒性評價的應用以及各自的特點(見圖1),以期為3D體外肝毒性模型的下一步發展提供參考。
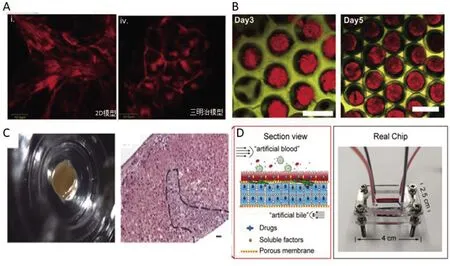
A.灌注培養三明治模型的F-actin染色圖[38](Scale bar=20 μm);B.倒膠體晶體支架中HepG2球樣體的熒光染色圖[56](Scale bar=200 μm);C.3D生物打印構建的微型肝組織示意圖以及HE染色圖[69](Scale bar=25 μm);D.微流控芯片制造人造肝組織的示意圖以及實物圖[73]
1 三明治模型
由于2D培養無法復制細胞與細胞外基質構成的天然微環境,PHH 在24 h內迅速去分化并失去部分肝功能[22]。為了模擬肝細胞在生理條件下的生長情況,Dunn等[23]將大鼠的肝細胞置于兩層膠原蛋白凝膠之間培養,形成“三明治”結構,該模型可在42 d內維持大鼠肝細胞的正常形態與白蛋白分泌功能。三明治模型的夾心結構增強了肝細胞之間的相互作用,可為膽小管的形成提供必要的細胞極性[24],通過對膽汁酸排泄以及藥物肝膽處置過程的監測實現體外肝毒性評價[25-26]。譬如在三明治培養的PHH中,2型糖尿病治療藥物曲格列酮[27]和抗抑郁藥奈法唑酮[28]都會抑制膽汁酸轉運體(BSEP),從而引起膽汁淤積。Lee等[29]等利用大鼠原代肝細胞的三明治模型,探討了地塞米松緩解抗腫瘤藥物曲貝替定誘導肝毒性的作用機制,發現地塞米松的干預下,多藥耐藥相關蛋白2(MRP2)介導的膽汁排泄以及CYP3A1/2介導的代謝增加,從而使曲貝替定的肝臟毒性降低了2~3倍。為改善三明治模型中氧氣以及營養物質的輸送,Zhang等[30]將灌注培養系統引入三明治模型,此模型在維持細胞形態、尿素生成以及代謝酶活性的同時,表現出比靜態培養的三明治模型更高的藥物敏感性(圖1-A)。然而,與體內肝細胞相比,三明治模型仍然存在自身的局限性,如三明治模型中肝細胞的表型以及膽小管的生成對于ECM的依賴程度較高,ECM性質的變化可能會影響模型預測的準確性[31],長期實驗過程中膽小管的泄漏和損壞也限制了三明治模型的發展[32]。
2 球樣體模型
與三明治培養相比,球樣體模型表現出更為緊密的細胞間相互作用[33]。肝細胞在低黏附培養板、懸滴培養或旋轉生物反應器中培養時,均可通過自組裝形成球樣體[34-36]。這類無須細胞黏附底物、通過懸浮細胞自發聚集成球的模型也被稱為無支架模型,其中簡單易行的低黏附培養板最為常用。低黏附培養形成的原代肝細胞和HepaRG球樣體模型在細胞活力、代謝酶功能(CYP1A2、CYP2C8、CYP3A4)和尿素分泌方面的表現較三明治模型更優[37],在肝毒性藥物如抗精神病藥氯丙嗪、非甾體抗炎藥對乙酰氨基酚、降壓藥波生坦以及帕金森治療藥物托卡朋等的重復暴露實驗中,表現出了更高的敏感性和預測能力[38-40]。PHH球樣體更是在蛋白質組[12]、轉錄組[41]方面表現出與體內肝臟的高度相似性,并且可以在三周內穩定保持與體內一致的代謝組特征[42]。
與無支架模型相比,有支架模型的優勢在于為形成球樣體的細胞提供了有利于增殖和遷移的環境[43]。在以半乳糖基修飾的纖維素、鈣-海藻酸鹽等材料為代表的細胞支架中,肝細胞球樣體在白蛋白和尿素合成、藥物敏感性、以及Ⅰ、Ⅱ型代謝酶的表達上具有優勢[44-46]。然而,球樣體模型的主要缺點在于難以形成均一的尺寸,這種差異可能導致球體內部的細胞間相互作用不同,從而引起細胞活力水平的變化。譬如,較小的球樣體無法提供與體內相似的生理特性,而直徑太大的球樣體中心容易出現缺氧壞死[47]。
為了更好地控制球樣體的直徑,倒膠體晶體支架(inverted colloid crystal,ICC)應運而生,如圖1-B所示,HepG2細胞在ICC支架中形成大小均一的球樣體[48]。這是一種高度均勻的體系,其中的孔狀結構可以促進細胞之間的相互連接,材料具有良好的傳質性,可以保持營養成分的均勻滲透[48-50]。Ng等[51]將原代人胎兒肝細胞培養于鋪被膠原蛋白Ⅰ的ICC支架中,該模型在體外可維持長達5個月的肝臟特異性功能,代謝酶CYP3A4、2D6以及2C19的活性在培養7周內維持上升趨勢,可在體外預測氟尿苷的肝毒性作用機制。但人胎兒肝細胞具有來源稀缺以及倫理爭議等缺點,無法廣泛用于體外肝毒性模型的建立[52]。于是Ng團隊改用由誘導型多功能干細胞(iPSC)衍生得到的肝祖細胞(IH),在Matrigel修飾的ICC支架中構建了肝臟類器官,模型表現出與體內相似的形態學以及轉錄組學特征,在蛋白質分泌,藥物代謝方面等方面的表現更接近成年人的肝組織[53],但ICC支架培養需要額外的ECM涂層(膠原蛋白Ⅰ以及Matrigel),步驟煩瑣,涂層的厚度也會影響模型的可重復性。
3 3D生物打印模型
3D生物打印是將含細胞的生物墨水以自動化的方式逐層打印成型,通過改變生物墨水的組成以及目標結構的不同而實現對體外器官模型的靈活構建[54]。常用于構建肝細胞模型的生物墨水有甲基丙烯化明膠(GelMA)[55]、膠原蛋白[56]、纖維蛋白[57]和海藻酸鈉[58]等。3D生物打印技術在肝細胞模型的構建上仍處于起步階段,與其他模型相比,3D生物打印構建的肝臟模型適用于多細胞培養,具有與體內組織水平相當的細胞密度,并可在較長的培養周期內實現肝臟特異性功能的持續表達[59]。Faulkner等[60]將人類誘導多能干細胞(hiPSC)和人類胚胎干細胞(hESC)打印到藻酸鹽水凝膠中,誘導形成肝樣細胞(HLC),模型中細胞核因子4α(HNF4α)和白蛋白可穩定表達超過21 d。Nguyen等[61]進一步構建了包括肝實質細胞PHH、非實質細胞肝星狀細胞和內皮細胞HUVEC在內的3D肝臟微組織(圖1-C),具有與體內肝臟相似的特性(如脂質與糖原的儲存以及實質與非實質細胞之間的分區),可在4周內維持肝細胞活力、白蛋白和CYP3A4的表達。基于組織工程學上的優勢,3D生物打印構建的肝細胞模型在藥物肝毒性評價上也具有良好的前景。Richard等通過優化膠原蛋白I-透明質酸這一混合生物墨水的比例,進行了原代肝細胞和肝星狀細胞共培養的3D肝組織構建,并將對乙酰氨基酚(APAP)作為驗證模型毒性預測能力的指標,結果表明該組織表現出了與體內相似的藥物反應[62]。Massa等[63]使用犧牲材料搭建微血管通道,將HUVEC引入封裝于GelMA中的HepG2/C3A球樣體中,構建了血管化的肝臟模型,APAP誘導毒性實驗結果表明,血管的存在使得APAP對肝球樣體的毒性作用得到了緩解。
4 微流控模型
利用微流控技術制造的動態肝臟體外系統,也被稱為“芯片上的肝臟”[64-65],已被用于藥物篩選、毒性測試、新陳代謝預測、肝病模型建立以及多器官相互作用研究等領域[64]。微流控技術也適用于多細胞共培養模式。Deng等[65]將HepG2、人肝星形細胞LX-2、人臍靜脈細胞融合細胞EA.hy926和人組織細胞淋巴瘤細胞U937按生理狀態排列,構建了人造肝芯片,并分別在其上層和下層構建了供血液以及膽汁通過的人造管道(圖1-D),與單層靜態培養模型相比,此模型大幅提高了肝細胞的合成和分泌功能,包括CYP1A1、CYP1A2和UGT酶的活性,以及對藥物代謝毒性的敏感性。Kalchman等[66]制造了由HepG2和HUVEC細胞共培養組成的肝小葉陣列,通過操作介質電泳,使得微流體室中隨機分布的細胞重新排布成類似于肝小葉的狀態,并由此將HepG2細胞中CYP450酶的活性提高80%。除了多細胞共培養外,與其他模型的聯用可以進一步優化體外肝臟微流控模型。Bhise等[67]采用3D點陣列打印肝球樣體模型,培養時引入微流控芯片的動態灌注功能,不僅可維持白蛋白、ZO-1、MRP2等肝功能指標的長期表達,并可發現APAP引起的長期毒性反應。微流控系統結合多細胞共培養以及多模型聯用技術,能夠獲得比靜態系統更好的預測值和更高的代謝活性,并有望實現個性化藥物篩選[68]。
5 總結與展望
相對于傳統的2D肝細胞模型,3D模型在細胞間相互作用、肝臟表型的可持續性和體外肝功能重現等方面更有優勢,可以為藥物研究和疾病治療提供更加可靠的平臺。但由于器官結構和功能的復雜性,目前的3D肝模型仍與體內器官存在較大的差距,細胞共培養以及多模型聯用將成為之后體外肝臟模型的主流[9]。通過將多學科融合的大數據以及人工智能等前沿信息技術用于新型材料的發現以及培養技術的優化,未來的3D肝細胞模型定會在毒效評價、新藥發現等方面展現出更大的潛力。

