泰來草WOX轉錄因子的篩選與結構分析
沈 捷,陳石泉,吳鐘解,蔡澤富*
(1.海南熱帶海洋學院 熱帶海洋生物資源利用與保護教育部重點實驗室,海南 三亞 572022;2.海南省海洋與漁業科學院,海南 海口 571126)
同源異型盒(Homeobox,HB)是一類高度保守的轉錄因子[1],因含有同源異型結構域(Homeodomain,HD)而得名,在真核生物個體發育及細胞分化中發揮關鍵調控作用。典型的同源異型結構域是由約60個氨基酸組成,能夠與特異性的DNA序列結合,它的標志就是含有螺旋-環-螺旋-轉角-螺旋(Helix-loop-helix-turn-helix)的結構和12個保守的氨基酸(RQLYIVWFNRRK)[2-4]。
WOX(WUSCHEL-related Homeobox)轉錄因子家族是HB超家族中的一員,是植物特有的一類轉錄因子。與典型的同源異型結構域相比,WOX轉錄因子家族的同源異型結構域多出了5個氨基酸[WUSCHEL(WUS)多出6個氨基酸][4],對模式植物擬南芥(Arabidopsisthaliana)中WOX轉錄因子家族進行系統進化樹分析,可分為3個進化分支:遠古進化支包括WOX10、WOX13、WOX14;WUS進化支包含WUS和WOX1-7;而WOX8、WOX9、WOX11和WOX12則是處于兩者之間的中間進化支[5]。結構上,WUS進化分支的WOX蛋白除了含有典型的HD結構域外,其下游還包括WUS-box結構域,該結構域與調控干細胞穩定性和花器官發育等過程密切相關[6]。一些家族成員在HD和WUS-box之間還存在連續的酸性氨基酸序列,這段酸性氨基酸序列可能與轉錄激活相關。一些家族成員如WUS蛋白的羧基端有一個乙烯響應因子(Ethylene Response Factor,ERF)相關的結構域,這個結構域與轉錄抑制相關。
WOX家族成員眾多,在擬南芥中,WOX家族的15個成員分別具有調控干細胞多能性、側生器官的發育、花器官的形成和胚發育等生物學功能[5-15]。WOX轉錄因子廣泛存在于各種植物之中,水稻全基因組中共有13個WOX轉錄因子[16];玉米全基因組中共預測有21個WOX轉錄因子[16-17];在棉花、楊樹、高粱和茄子等植物中也有關于WOX基因的報道[16,18-20]。陸地生物中,WOX基因的鑒定與功能研究非常多,但是相對于海洋植物而言,目前對WOX基因的研究還比較少,僅在單細胞綠藻中發現WOX基因家族[21],其他海洋植物并未有報道。
海草床的生態功能與服務價值重大,作為海岸帶天然生態屏障,在紅樹林與珊瑚礁生態系統之間起著承上啟下的紐帶作用,能促進海洋主要元素循環,凈化水質并穩固海床,可提供全球每年1.9萬億美元的經濟價值[21-25]。自1980以來,全球范圍內海草床面積正以110 km2/a的速度減少[22,26-27],中國海草床退化也較嚴重[21,28]。泰來草(Thalassiahemprichii)是熱帶海草主要優勢種,屬于水鱉科泰來草屬(Thalassia),主要分布在東南亞、臺灣南部和海南的文昌、瓊海、陵水、三亞、三沙等[29],被列入新加坡瀕危植物紅色名錄“極度瀕危”。海草資源的保護與恢復離不開種苗的補充,因此,研究泰來草重要生理功能的分子調控機制對海草生態學、生物地理和遺傳多樣性具有重要意義。本研究通過篩選泰來草WOX基因,通過分析其基因結構與進化關系,探索WOX基因在泰來草中潛在的生理功能和根莖發育的分子調控機制,為深入利用分子生物學手段進行種苗繁育調控提供理論基礎。
1 材料與方法
1.1 數據來源
用于泰來草WOX基因篩選的數據來源于本實驗室對泰來草轉錄組的測序結果,樣品采集自海南陵水新村港與黎安港海草特別保護區,為結構完整、生長健壯的泰來草葉片。利用BGISEQ-500測序平臺,共獲得了6.47 GB的數據,通過denove組裝,并利用KEGG、Gene Oncology(GO)、NR、NT、SwissProt、Protein families(Pfam)、EuKaryotic Orthologous Groups(KOG)7個數據庫對測序結果進行注釋,獲得了32 097個Unigenes(該成果論文另行發表,GeneBank登錄號:SRR10438616)。
1.2 生物信息學分析
利用ORF finder預測泰來草WOX基因CDS(Coding DNA Sequence);利用在線軟件SMART(http://smart.embl-heidelberg.de/)對蛋白質結構進行分析;利用EXPASY(https://web.expasy.org/protparam/)對蛋白的分子量、等電點等進行預測;利用泰來草的WOX基因序列在數據庫(https://blast.ncbi.nlm.nih.gov/)中進行檢索和同源性對比;利用Clustal W軟件(http://www.ebi.ac.uk/Tools/msa/clustalw2/)進行蛋白序列的多重聯配分析;利用MEGA X軟件(http://www.megasoftware.net/)的最大似然法(Maximum Likelihood, ML)構建系統發育樹[Bootstrap:1 000, Substitution Model: Jones-Taylor-Thormton(JTT)Modle, Tree Inferebce Options: Nearest-Neighbor-Interchange(NNI)]。
2 結果與討論
2.1 泰來草WOX基因的獲得與結構分析
根據本實驗室對泰來草轉錄組的測序結果,僅發現一個WUSCHEL同源基因,該基因長834 bp,通過ORF Finder預測獲得了一個597 bp的全長CDS序列,編碼198個氨基酸,分子量為21 967.43,pI值為5.34,信號肽分析表明,N端包含29個氨基酸的信號肽[MHPAVFLSLPDLRCSLLLLVTWVFTPVTT,http://www.cbs.dtu.dk/services/SignalP/,圖1(a)]。
利用SMART軟件分析蛋白結構域,結果顯示包含典型的Homeobox結構域(29—97),對其全長CDS序列進行結構預測,結果表明這個典型的結構域是參與發育過程中關鍵轉錄調控的DNA結合因子[圖1(b)]。

圖1 泰來草WOX轉錄因子結構分析
利用SWISS-MODEL(https://swissmodel.expasy.org/)同源建模的方法對其進行三級結構的預測。結果顯示,本地建模質量評估(Local Quality Estimate)值為0.3~0.8[圖2(a)],全局模型質量評估(GMQE)值為0.19,定性模型質量分析(QMEAN)值為-1.00[(圖2(b)],HOX domain建模同源性為30.77%,結果比較可靠。從結果可以看出,該蛋白具有Helix-loop-helix-turn-helix結構[圖2(c)],這與其他植物中WOX基因的三維建模結果一致。
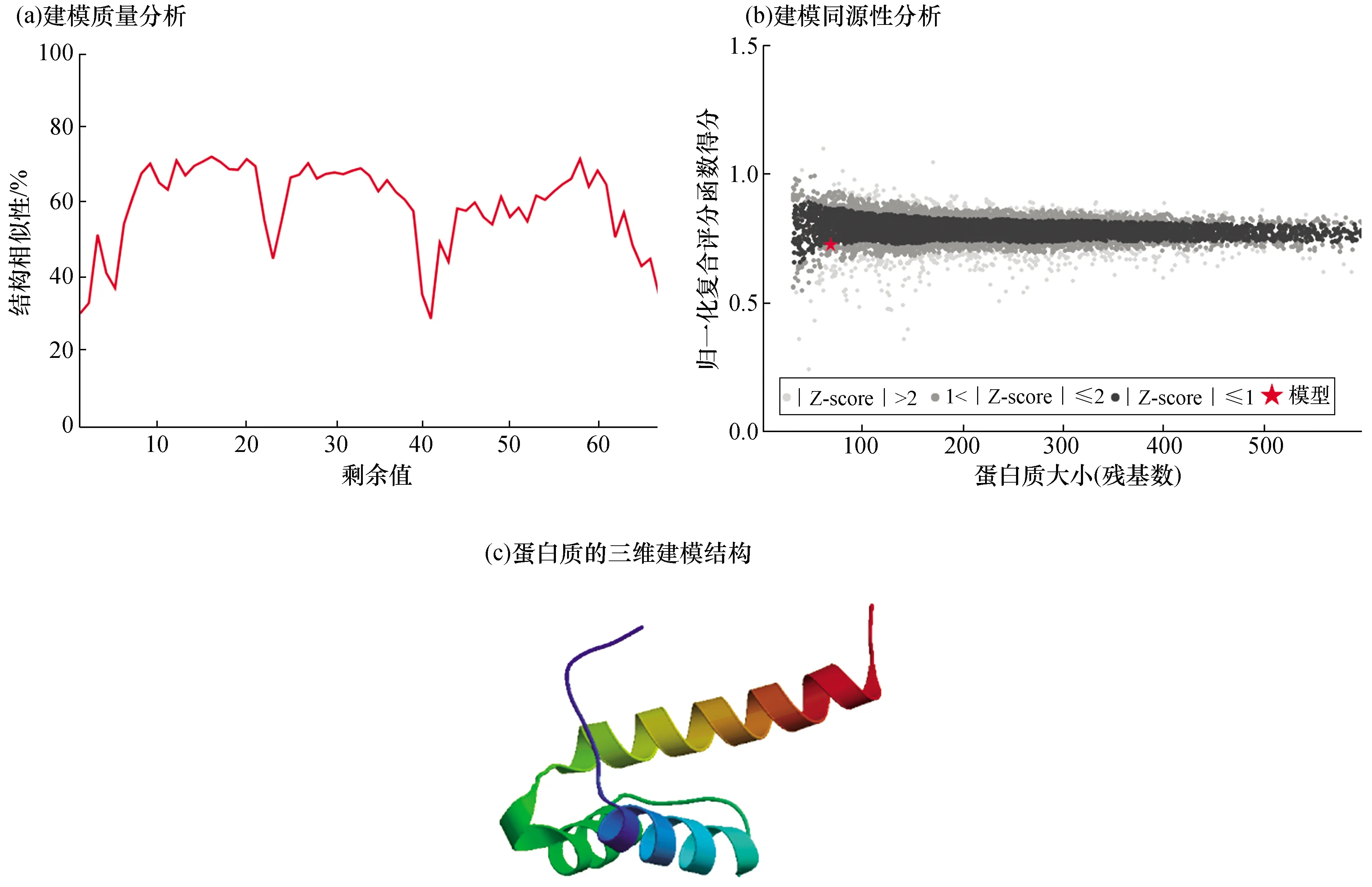
圖2 泰來草WOX轉錄因子蛋白質結構建模分析
2.2 同源比對及進化樹分析
將泰來草的WOX基因序列與NCBI的數據庫中已公布的其他物種的WOX基因進行blast比對,獲得了99條相似序列,其中一致性最高為67.39%,最低為38.50%,其相似結果主要集中在豆科植物中,僅發現一種水生植物——蓮(Nelumbonucifera)的WOX基因,此外還有葫蘆科、錦葵科、棕櫚科以及蝶形花科和一些藤本植物。從中篩選了序列一致性最高的8條序列進行蛋白的多重聯配分析(圖3)。結果顯示,在這8種植物中,均具有明顯的Homeobox結構域,但是泰來草與這些植物相比,N-端明顯的缺失了一段,這可能與陸地植物和海洋植物的進化關系有關。

圖3 泰來草WOX轉錄因子與其他8種植物的WOX8轉錄因子的多重聯配分析
對NCBI數據庫中所能獲得的植物WOX蛋白序列進行篩選,選擇了93條處于中間進化支的典型序列(表1),與泰來草的WOX蛋白序列進行對比分析,并利用MEGA X中的最大似然法(ML)構建了系統發育樹(圖4)。從結果可以看出,雖然WOX8和WOX13在序列上具有很大的相似性,但泰來草的WOX轉錄因子與其他物種的WOX8聚集在一起,故將本研究中獲得的泰來草WOX基因注釋為ThalassiatestudinumWUSCHEL-relatedHomeobox8(ThWOX8)。有意思的是,泰來草與陸地棉和海島棉的WOX蛋白聚集在一個分支之上,并且與其他的豆科等物種具有顯著的分離。
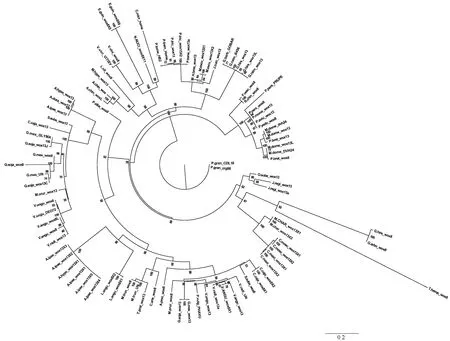
圖4 泰來草WOX基因蛋白與其他93種植物WOX基因蛋白的進化樹分析

表1 用于進化樹分析的93條蛋白序列信息
2.3 討論
WOX轉錄因子幾乎存在于植物的每一個器官之中,在各器官分裂旺盛的細胞群中顯著表達,參與調控植物干細胞的穩定、器官形成、胚的形成關鍵發育等過程。為了長期維持植物細胞自我更新和分化之間的平衡,需要將動態信號轉換為空間和時間上精確且穩定的基因表達狀態,WOX轉錄因子通過變應性控制生長素信號傳導和響應途徑,調節靶基因座的組蛋白乙酰化而起作用,觸發植物生長素的局部分化,同時維持干細胞在整個生命周期中的生存,以保持植物全周期狀態下的生長和發育[30]。
本研究根據前期轉錄組測序的結果,通過對7個數據庫的篩選僅獲得了1個WOX基因,這可能是用于轉錄組測序的樣品根莖葉結構不完整造成的。序列比對和進化樹構建結果存在差異,這可能是由于不同算法造成的。結合前期轉錄組測序的結果綜合考慮,我們認為泰來草與豆科和蓮科的親緣關系較為接近。這是海洋植物泰來草中發現的第一個WOX轉錄因子,由于缺乏其它海洋高等植物的WOX8的同源基因,我們尚不清楚其他海洋植物是否具有同樣的類似基因。
從單細胞綠藻到綠色開花植物,親緣關系相差巨大,但都含有WOX基因,說明這是一類較為古老的基因。基因家族數量的擴增往往在進化發育過程中起著重要的作用,包括新結構起源、形態的多樣化以及復制后新功能的產生和亞功能的分化[31-33]。系統進化研究的結果也表明,在單細胞綠藻和陸地植物發生分化之前,他們的共同祖先就已經含有至少一個遠古支起源的WOX基因,隨后各物種的遠古支WOX基因獨立進化,進而擴增分化出中間支和WUS支[34]。我們在泰來草中發現的ThWOX8是屬于中間支的一個重要基因。在擬南芥中,AtWOX8在胚胎基部區域表達,與WUS支的WOX2基因協同作用,參與調控擬南芥受精卵發育成胚的過程,促進胚根發育形成根分生組織[7,14,35]。此外在胚發育過程中,STPL/WOX8通過調控CUPSHAPEDCOTYLEDON(CUC)基因的表達促進子葉葉緣的發育[36]。水稻DWT1是擬南芥AtWOX8/9的同源基因,具有影響水稻節間細胞分生和伸長的作用,同時調控水稻主桿和分蘗生長的一致性[37]。在裸子植物挪威云杉(Piceaabies)中,PaWOX2和PaWOX8/9在受精卵和體胚發育早期高度表達[38],表明這一機制在被子植物和裸子植物中具有保守性[39]。這些研究結果表明,WOX8參與了體細胞胚特別是基部(根端)的發育,為我們進一步分析ThWOX8基因在泰來草根發育過程中發揮的作用及其調控機制奠定基礎。
海草作為一種重要的潮間帶植物,是重要的海洋初級生產者,能夠為一些海洋生物提供豐富的食物和棲息場所,同時對維持近海生態平衡具有至關重要的作用。近年來海草種群的衰退現象嚴重,對海草床的生態修復成為研究熱點。但生境恢復法、種子法、移植法等海草床修復方法都不夠理想[40-42],缺乏組織培養等有效手段進行大量的人工繁育。目前,我們正在進行ThWOX8基因過表達載體構建和轉化擬南芥的實驗,旨在深入分析ThWOX8基因在泰來草發育過程中所發揮的作用。了解泰來草的分子生物學特性、基因表達信息,進一步挖掘與根莖葉生長相關的關鍵基因,尤其是與體細胞胚胎發生、定殖相關的基因及其分子機理,可以為泰來草分子育種與擴繁提供有益的思路。
3 結論
本研究利用泰來草轉錄組數據,篩選到一個WOX基因(命名為ThWOX8),該基因全長597 bp,編碼198個氨基酸,其中具有典型的Homeobox結構域。同源比較分析和系統進化樹分析結果表明:泰來草ThWOX8與豆科植物和蓮的親緣關系較為接近。關于ThWOX8在調控泰來草胚胎發育過程中的具體生理功能及機理尚需進一步研究。

