DNTF與凡士林混合體系相互作用研究①
牛詩堯,曲文剛,高紅旭,趙鳳起
(西安近代化學研究所 燃燒與爆炸技術重點實驗室,西安 710065)
0 引言
3,4-二硝基呋咱基氧化呋咱(DNTF)是一種新型高能量密度材料,具有爆速高、密度大等優點,可作為混合炸藥和推進劑的主要成分,具有廣闊的應用前景[1-4]。同時,由于DNTF對硝化甘油(NG)有增塑作用,因此對于推進劑來說它既是一種高能組分,又是一種增塑劑[5]。為評估DNTF在推進劑中使用安全性,需要DNTF與推進劑中組分形成混合體系后,還能保持各自的物理性質以及化學性質不發生大的改變。當混合組分之間具有較強的物理及化學相互作用時,混合組分會出現晶析、遷移、放熱和質量損失等多種現象,因此會造成推進劑的使用和存儲出現一定風險。推進劑中組分相互作用的主要研究方法是通過使用真空安定性研究混合體系的化學安定性,以此表征其相互作用強弱[6]。然而,由于DNTF在實驗條件下容易熔化和氣化[7],該方法在實踐過程中危險系數較高,對于研究DNTF體系與其他物質組成的混合體系之間的相互作用有一定的局限性[8]。因此,常用熱分析法和化學動力學模擬的方法研究DNTF與其他組分之間的相互作用[9-12]。
為進一步提高和穩定固體推進劑的燃燒效率與工藝性能,一些其他組分常需要添加在推進劑中作為助劑[13-14]。而添加劑所起作用不同,對其性能的要求不同。凡士林是推進劑中較為常用的一種工藝助劑,它可以有效提高改性雙基推進劑的工藝性能,同時凡士林為多種長鏈烷烴形成的混合物,其化學性質是惰性的,一般情況下與有機含能組分之間不會形成強的化學相互作用[15]。
本文通過實驗和理論兩種手段探索了DNTF與推進劑中助劑凡士林之間的相互作用,通過不同的實驗方法研究了DNTF與凡士林之間的化學相互作用,采用計算模擬方法研究了不同溫度范圍下DNTF與凡士林之間的物理相互作用,為DNTF基推進劑的安全使用提供理論支撐。
1 實驗方法
1.1 原料
DNTF(圖1),純度大于99%,西安近代化學研究所提供。凡士林為新能源化工公司提供的白凡士林,本工作中所使用的凡士林均指代白凡士林。
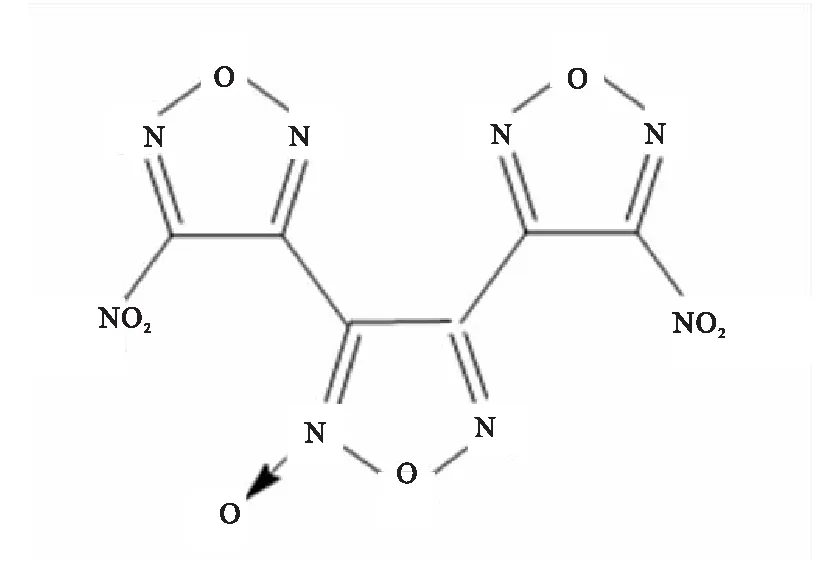
圖1 DNTF的分子結構
1.2 實驗儀器及測試條件
DSC實驗采用德國耐馳 DSC204 HP 型差示掃描量熱儀,氣氛采用高純氮,壓力為1 MPa,升溫速率為10 ℃/min。
TG實驗通過力可TGA-701型,反應為常壓,氣氛為高純氮氣。
原位紅外光譜為Nexus870型傅里葉變換紅外光譜儀,美國Thermo-Fisher公司,配備MCT-A檢測器,反應池為廈門大學制變溫反應池,升溫速率為5 ℃/min,儀器分辨率4 cm-1。
氣質聯用儀采用TSQ 8000 Evo,程序升溫至80 ℃并保持,采用毛細管色譜柱,選擇EI電離源。
DNTF與凡士林混合體系的撞擊感度采用GJB 772A—1997方法中601.2特性落高法獲得,落錘重量為5 kg,單次實驗量為50 mg。
2 計算方法
低溫狀態下DNTF與凡士林組分之間的相互作用分子動力學模擬研究通過Material Studio軟件實現。無定型結構的幾何優化選用COMPASS力場和Smart Minimization方法,收斂限為0.001 kcal/mol。MD模擬采用Nose-Hoover控溫方法和Berendsen控壓方法,范德華和靜電作用分別用Atom-based和Ewald方法計算,截取半徑選擇12.5 ?,樣條寬度取0.1 nm,緩沖寬度取0.05 nm,步長選擇1 fs,選擇等溫等壓(NPT)系綜,溫度為298.15 K,壓力為1.0×105Pa。模擬時間為250 ps,為消除不合理的能量和體積對計算結果的影響,選擇已經平衡的后50 ps體系用來計算相關性能。
3 結果分析與討論
3.1 凡士林對DNTF的高溫分解化學作用的實驗研究
3.1.1 DNTF與凡士林熱解反應
DNTF與VSL的1∶1混合物在1 MPa下10 ℃/min升溫的熱解過程放熱情況如圖2所示。DNTF初始放熱溫度為232 ℃,分解峰溫為271 ℃。該初始放熱溫度與文獻中報道的反應溫度240.6 ℃基本相符[16-18]。凡士林在超過200 ℃時緩慢分解,由于凡士林中烷烴組分較為復雜,放熱峰形成一個平緩的鼓包。DNTF/VSL與DNTF/C25H52兩個混合體系的熱分解初始溫度為170 ℃,峰溫為198 ℃,通過峰溫漂移值判斷[19],DNTF與凡士林之間分解過程的化學相互作用較明顯,放熱量(即峰面積積分)也有大幅度提升。

圖2 DNTF/VSL的DSC熱解曲線(1 MPa)
根據國軍標GJB 772A—1997 502.1[20]差示掃描量熱法判斷相容性的辦法,該體系不相容。混合組分較純DNTF來說,混合體系放熱分解峰較存在較大程度的前移,峰溫提前了73 ℃。該結果與南京理工大學李席等[11]通過DSC研究DNTF/Wax體系熱解得到的結果(峰溫提前了87.4 ℃)相似,證明了類凡士林物質與DNTF之間較強的化學相互作用。
凡士林對DNTF的加速分解作用,也可以體現在TG曲線中(圖3)。由DSC可知,200 ℃下DNTF只有少量分解。而從TG曲線可以看出,凡士林在升溫過程中只有少量分解,DNTF和DNTF/VSL在升溫過程中即開始有熱損失,是由于DNTF本身的升華現象引起的。而隨著溫度升高,DNTF/VSL的熱損失率在250 ℃之前高于DNTF本身,在250 ℃之后,DNTF純物質本身快速分解。這可能是由于DNTF分解過程中小分子的自催化作用引起的。而該現象也一定程度上說明了凡士林對于DNTF分解的促進作用。

圖3 DNTF/VSL的熱失重曲線(10 ℃/min)
3.1.2 DNTF/VSL熱分解機理
文獻[21]表明,DNTF可能有六種解離方式,其中活化能相對較低(30~50 kcal/mol)的有兩個過程,其一為C—NO2中NO2的旋轉導致CONO異構化中間體的形成,然后導致NO分子碎片的產生;另一種低活化能分解形式是兩邊的惡二唑環斷裂。
凡士林的主要成分是液體烷烴,烷烴可能在低溫狀態下與氧氣或者羥基自由基發生低溫氧化反應,而在高溫狀態直接發生裂解反應。反應遵循鏈引發、鏈增長和鏈終止的自由基反應機理,即通過烷烴分子化學鍵的斷裂產生自由基,再經過自由基之間的轉化和傳遞,最終形成穩定的產物分子[22]。
在3.1.1節中,通過DSC可以判斷DNTF分解和烷烴的裂解過程相互促進。為了進一步描述混合組分的分解歷程,通過原位紅外方法得到了DNTF與凡士林混合組分的分解產物信息。圖4描述DNTF/VSL在350 ℃下分解產物與DNTF純物質分解產物的紅外光譜,DNTF/VSL混合體系分解過程中可以看到2240 cm-1處明顯的N2O氣體峰。同時,DNTF/VSL混合體系在800~1800 cm-1處的峰基本消失,證實DNTF已經分解并趨于基本完全分解,剩余產物中烷烴量較多,在產物的紅外光譜中仍有較為明顯的烷烴C—H振動峰(3000 cm-1)。烷烴反應中間體極大地加速了DNTF的反應歷程,因此DNTF 的反應趨于完成,在350 ℃停止反應會剩余較多凡士林。對于烷烴分解加速DNTF的分解機理,結合文獻[23]可以這么解釋:由于烷烴分解過程中由于β-裂解產生大量的活性H自由基,H質子有利于與DNTF中初始分解過程中NO2的消除,從而加速DNTF的分解。

圖4 DNTF與DNTN/VSL分解產物的紅外光譜
3.2 常溫下DNTF與凡士林混合的相互作用計算
3.2.1 DNTF與凡士林混合相互作用模型建立
通過紅外光譜和氣質聯用分析(圖5)確定,白凡士林中主要成分由C20H42~C35H72的長鏈烷烴構成,雜質成分為萘等芳香類化合物。

(a) IR spetrum (b) GC-MS spetrum
為構建凡士林中主要成分的模型,選擇三種鏈長烷烴,構建三種鏈長烷烴(C20H42、C25H52、C30H62)無定型模型,以C25H52/DNTF為例,共混物模型中的原子數為1048,密度為1.12 g/cm3,DNTF與C25H52的質量比為1∶1。以同樣方法構建DNTF與凡士林中其他烷烴、雜質萘的共混體系模型,如圖6所示。

(a) DNTF/C20H42 (b) DNTF/C25H52
3.2.2 DNTF與凡士林組分混合體系的相互作用
對于分子間沒有強極性基團或氫鍵作用的有機體系,兩種材料的溶度參數之差(Δδ)只要滿足|Δδ|<(1.3-2.1) J1/2/cm3/2,共混體系就滿足相容原則[24-25]。兩組分的溶度參數差值越小,越容易滿足此條件、相容性越好[26-27]。
表1列出了DNTF與凡士林主要成分不同鏈長烷烴、雜質萘之間的相溶度參數。通過溶度參數計算可以發現,DNTF與各種烴均之間的溶度參數相差較大,其中與稠環芳烴萘的不溶程度最大。因此,通過溶度積參數判斷,DNTF與凡士林主要成分之間均不相容。
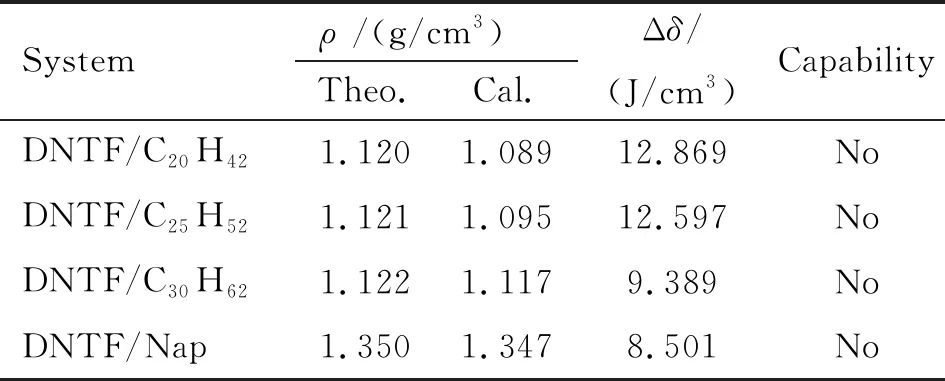
表1 DNTF與凡士林組分之間的相容性
混合模型通過無規共混后的穩定結構體積增大,密度減小。說明動力學模擬前初始結構比較松散。而經過混合后(圖7),DNTF分子間容易形成團聚,而烷烴分子間則向外圍遷移并團聚。DNTF與凡士林中烷烴組分的無規共混結構經過動力學穩定后逐漸趨于相分離[28]。

(a)Before (b)After
徑向分布函數RDF(Radical Distribution Function)可以描述混合體系中的相互作用性質。其中,混合體系的徑向分布函數表達式為
式中ρ為體系密度;ri為粒子坐標;δ為質點的狄拉克函數。
當原子距離在0.26~0.31 nm之間的相互作用屬于氫鍵,而0.31~0.5 nm屬于范德華作用,原子距離大于0.5 nm則屬于靜電相互作用[6]。
為了更好地揭示分子間相互作用本質,圖8中分析了DNTF/CnH2n+2及DNTF/Nap共混物分子模型中的分子間徑向分布函數。
由圖8可見,DNTF與DNTF之間能形成氫鍵作用(圖8(a))。而混合體系中DNTF與烷烴相互作用本質主要是范德華相互作用和靜電作用(圖8(b)~(d)), DNTF與凡士林中的烷烴之間混合物的徑向分布函數g(r)均不高于單純物質的徑向分布函數。因此,在DNTF與烷烴的混合體系中的相互作用強弱順序為

(a) DNTF/C20H42 (b) DNTF/C25H52 (c) DNTF/C30H62
DNTF/DNTF> CnH2n+2/CnH2n+2>DNTF/CnH2n+2
由于長鏈烷烴的鏈影響,DNTF與凡士林中各組分之間的相互作用強弱順序為DNTF/Nap>DNTF/C25H52>DNTF/C20H42≈DNTF/C30H62。
3.2.2 DNTF/VSL共混體系的結合能
DNTF與凡士林組分的分子間相互作用可以通過混合組分能量與純物質能量之差得到。DNTF與凡士林中主要組分烷烴形成的共混物能量中范德華相互作用強于靜電相互作用。分子間相互作用能可定量表征分子間的相互作用大小,當分子間相互作用能越大,共混體系越穩定[29]。
表2列出了DNTF與凡士林組分之間相互作用能。DNTF與烷烴之間的相互作用較為接近,而 DNTF與Nap之間的相互作用能較大。通過徑向分布函數(3.2節)的分析可以看出,氫鍵是造成相互作用能差別較大的原因。

表2 DNTF與凡士林組分之間的相互作用能
為表征在貯存和使用條件下溫度對混合物相互作用的影響,計算了DNTF/C25H52在不同溫度下的溶度參數,見圖9。

圖9 不同溫度下 DNTF/C25H52共混體系中的能量及溶度參數
結果表明,隨著溫度的升高,DNTF與烷烴之間的相互作用逐漸減增加。從溶度參數逐漸變小也說明了DNTF與烷烴之間的吸引作用越來越小,而排除作用越來越強,兩種混合物在升溫過程中相分離的趨勢越來越明顯[30]。
3.3 凡士林對DNTF撞擊感度的影響
凡士林對于DNTF的撞擊感度影響見表3。混合體系相比于純DNTF更加敏感。當施加外力撞擊時,會使DNTF與凡士林混合組分的安全性降低。說明凡士林對于DNTF的分解與爆炸具有促進作用。普遍認為炸藥起爆過程是局部“熱點”分解形成[31],從3.1節中DNTF與凡士林之間的熱分解研究中,凡士林可以催化DNTF的分解過程,降低DNTF的分解溫度。因此結合熱點理論,可將凡士林對DNTF撞擊感度的影響解釋為:在起爆過程中凡士林促進DNTF“熱點”處的分子分解,導致混合組分撞擊敏感度升高。

表3 DNTF與凡士林混合組分的撞擊感度
4 結論
采用差示掃描量熱(DSC)與原位紅外(In-situ IR)的方法,研究了DNTF與凡士林之間的化學相互作用。實驗結果表明,DNTF與凡士林體系的分解過程包含了DNTF的分解和烷烴的氧化和部分裂解過程。在裂解過程中,混合體系的熱解初始溫度較DNTF自身分解來說明顯提前。由于凡士林中烷烴的低溫裂解產物可以催化DNTF的熱解過程,使DNTF的分解溫度明顯地提前。
同時,通過分子動力學模擬的方法研究了共混狀態下DNTF與凡士林組分之間的相互作用,DNTF/CnH2n+2之間主要為靜電相互作用和范德華相互作用,DNTF/Nap之間存在氫鍵作用。通過溶度分析法判斷DNTF與凡士林中組分不相容。同時,研究了升高溫度對DNTF與凡士林共混體系的相互作用,發現隨著溫度升高,DNTF與凡士林分子之間的相互作用能逐漸減小,DNTF與烷烴之間的吸引作用越來越小,排除作用越來越強。
凡士林對DNTF撞擊感度的試驗結果表明,DNTF與凡士林的混合物感度比純DNTF高,雖然推進劑中使用的凡士林含量較低,凡士林能夠催化DNTF分解的特性是顯著的。為了保證安全性,建議在實際過程中,需要在含DNTF的推進劑中盡量避免使用凡士林添加劑。

