我國藥品抽檢質量風險提示函制度的探討
劉文 王翀 朱炯 胡增峣


中圖分類號 R951 文獻標志碼 A 文章編號 1001-0408(2021)21-2575-06
DOI 10.6039/j.issn.1001-0408.2021.21.03
摘 要 目的:為進一步完善我國藥品抽檢質量風險提示函(以下簡稱“提示函”)制度、加強藥品質量管理水平提供參考。方法:概述我國藥品抽檢的質量風險管理情況,對其中提示函的法律性質、主要內容和工作程序進行分析,以最新的2020年的提示函數據為例分析提示函在排查潛在藥品質量風險中的作用,并針對目前存在的問題提出完善建議。結果與結論:在基于法定標準檢驗的同時,我國藥品監督管理部門對可能因生產企業的藥品質量控制盲區或偏差而存在質量安全風險的藥品開展了探索性研究,并按照發現問題的嚴重程度分為嚴重風險和一般性風險,實施分級管理。提示函就是基于勸服優先的原則對一般性藥品質量風險制定的行政措施,不具有制裁性。其主要內容涵蓋風險排查整改所需全部信息(藥品基本信息、提示的風險信息、聯系人信息、發現風險的方法、排查整改要求、屬地省級藥監部門的職責),涉及承檢機構、中國食品藥品檢定研究院、國家藥監局、相關生產企業屬地省級藥監局與相關生產企業共五方責任主體,通過閉環管理的模式實現監管部門與生產企業之間的良性互動。2020年,國家藥監局共向286家生產企業發出312份提示函,提示準確率達87.91%,具有較好的科學性和針對性。生產企業針對提示函的內容進行了包括開展工藝驗證、修訂內控標準、加強生產過程控制等一系列整改措施,但也存在提示內容的合理性遭到生產企業質疑以及生產企業排查力度不足等問題。鑒于此,筆者建議生產企業要正確認識提示函的性質和價值,承檢機構應進一步提高發現問題的科學性和針對性,而藥監部門則要重點關注排查發現的問題,以共同促進藥品質量的提升。
關鍵詞 藥品抽檢;風險管理;提示函;勸服優先
ABSTRACT? ?OBJECTIVE: To provide a reference for further improving the quality risk reminder mechanism of the drug sampling and testing (called “the Reminder” as for short) in China, and strengthening the drug quality management. METHODS: The quality risk management situation of the drug sampling and testing were summarized, and the legal nature, main content and working procedures of the Reminder were analyzed. The latest data of the Reminder in 2020 were taken as an example to analyze the role of the Reminder in the investigation of potential drug quality risks, and made the suggestions for existing problems. RESULTS & CONCLUSIONS: Based on legal standards, Chinas drug regulatory departments had carried out exploratory research on drugs that may have quality and safety risks due to drug quality control blind spots or deviations of manufacturing enterprises, and divided them into serious risks and general risks according to the severity of the problems found, and implemented hierarchical management. The Reminder was an administrative measure for general drug quality risks based on the principle of persuasion first, and did not have sanctions. Its main content covered all the information required for risk investigation and rectification (basic drug information, suggested risk information, contact information, risk discovery methods, troubleshooting and rectification requirements, and responsibilities of local provincial drug regulatory departments). It involved five responsible parties, ie. the inspection institution, China Institute for Food and Drug Control, National Medical Products Administration, the provincial food and drug administration of the relevant manufacturing enterprises and the relevant manufacturing enterprises. Through the mode of closed-loop management, the benign interaction between regulatory authorities and manufacturing enterprises could been realized.? In 2020, National Medical Products Administration issued 312 reminders to 286 manufacturers, with an accuracy of 87.91%, which was scientific and targeted. The manufacturer had carried out a series of rectification measures for the contents of the Reminder, including carrying out process verification, revising internal control standards and strengthening production process control. However, there were also some problems, such as the rationality of the prompt contents being questioned by the manufacturer and the insufficient investigation of the manufacturer. It is suggested that the manufacturers correctly understand the nature and value of the Reminder. The inspection agency should further improve the scientific pertinence of the problems found, while the drug regulatory department should focus on the troubleshooting of the problems found, so as to jointly promote the improvement of drug quality.
KEYWORDS? ?Drug sampling and testing; Risk management; Reminder; Persuasion first
行政執法中的一個重要原則是勸服優先(persuasion first),是指在行政執法中首先考慮以勸導模式實現規制遵從,即以強制力較弱的監管措施促使被監管者主動建立內部合規體系,這樣可以合理配置監管資源、降低執法成本,有效實現監管目標[1]。《行政處罰法》規定,“實施行政處罰和糾正違法行為應堅持處罰與教育相結合,教育公民、法人或者其他組織自覺守法”;《藥品管理法》也規定了“對于尚不影響藥物安全性和有效性的輕微違規行為,應責令限期改正”[2]。
借鑒這一原則,我國于2014年建立了藥品質量風險提示函(以下簡稱“提示函”)制度,即藥品監督管理部門對國家藥品抽檢探索性研究中發現的尚不影響藥物安全性和有效性的一般性風險,向相關生產企業發出勸導性告知,要求其開展排查并采取必要的整改措施[3-4];生產企業據此采取優化工藝、加強生產過程管理、完善標準等措施,不斷提升藥品質量管理水平,主動落實藥品質量安全的主體責任。提示函從源頭上提高藥品質量方面發揮的作用愈加顯著,已成為我國藥品監管的重要策略。為進一步加強和完善我國提示函制度,筆者結合多年工作經驗,對提示函制度體系進行研究,以期為有關部門提供參考、為加強藥品質量管理提供借鑒。
1 國家藥品抽檢風險管理概述
人用藥物注冊技術要求國際協調會(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use,ICH)于2005 年發布《質量風險管理》(Quality Risk Management)的第Q9號技術文件,要求對藥品的整個生命周期進行質量風險管理(risk management)[5],即采取藥物警戒行動和干預等措施,識別、預防和減少藥品相關風險。這是對整個產品周期全面和持續降低風險的過程,旨在實現效益風險最優化[6]。近年來,我國國家藥品抽檢緊密結合監管需要,積極改革體制機制,借鑒ICH的理念加強藥品風險管理,提出了一系列創新性舉措,加大、加深、加強對假冒偽劣藥品和潛在質量安全風險的挖掘和處置,主要是在基于法定質量標準檢驗的同時,對可能因生產企業的藥品質量控制盲區或偏差而存在質量安全風險的藥品開展探索性研究[7],重點排查工藝處方、原料、生產過程、輔料、包裝材料(以下簡稱“包材”)等可能影響藥品內在質量的相關因素,為進一步提升藥品質量水平、加強藥品監管提供技術支持。
為合理配置藥品監管資源、提高風險管理效率,國家藥監局對于國家藥品抽檢探索性研究中發現的問題,按照嚴重風險和一般性風險實施分級管理。嚴重風險主要是國家藥品抽檢承檢機構經分析,認為探索性研究發現的對公眾用藥安全有效的不利影響較大或涉嫌主觀故意、違法違規而必須立即采取控制措施的問題[8];其管理措施主要是以飛行檢查或現場核查的形式對相關生產企業進行檢查,查實違法違規行為時依法依規立案查處。一般性風險即國家藥品抽檢承檢機構經分析,認為探索性研究發現的安全風險較低或非主觀故意、未涉嫌違法違規的問題[8];其管理措施主要是藥監部門以提示函的形式告知生產企業并提供檢驗方法,幫助生產企業主動建立內部合規體系、提高藥品質量。國家藥品抽檢具體實踐中發現一般性風險的發生率高于嚴重風險。加強一般性風險的管理,避免其進一步惡化或升級成為嚴重風險,與嚴重風險管理一樣,也對提升藥品整體質量水平、保護公眾用藥安全有效具有重要意義。
2 提示函的法律性質分析
如上所述,我國的提示函適用范圍是國家藥品抽檢探索性研究中發現的一般性問題,并且相關生產企業可以糾正偏差或消除風險,從而由國家藥監局向相關生產企業發出提示函并提供檢驗方法供其無償使用。這與有證據證明假冒偽劣藥品的核查處置以及上述嚴重風險的有因檢查等風險管理措施顯著不同。提示函是根據勸服優先的原則向相關生產企業發出的通知,目的是要求企業對提示的問題開展排查整改,而不涉及《藥品管理法》規定的藥監部門對有證據證明可能存在安全隱患的藥品采取告誡、約談、限期整改以及暫停生產、銷售、使用、進口等制裁性措施。因此,提示函不是處罰手段,不具有制裁性。另一方面,提示函向相關生產企業提供檢驗方法充分體現了我國藥監部門幫扶生產企業、寓服務于監管的作風。例如2020年國家藥品抽檢中,承檢機構在探索性研究中發現復方托吡卡胺滴眼液中存在環氧乙烷與托吡卡胺反應生成的未知雜質,并建立了該品種中托吡卡胺環氧乙烷化合物檢查方法,通過提示函的形式提示有關生產企業登錄中國食品藥品檢定研究院(以下簡稱“中檢院”)官網,在相應模塊中下載使用檢驗方法以加強對該雜質的控制。
提示函與美國食品藥品管理局(FDA)的無標題信(untitled letters)類似。美國FDA的無標題信也是針對藥品監管過程中發現的一般性違規行為,根據勸服優先原則向相對人發出的通知,以此對相對人進行提醒,以這種非處罰性的、強制力較弱的監管手段促使生產企業采取相應的措施,避免相同或類似行為再次發生[9]。其與我國提示函主要的不同在于美國FDA在其官方網站公開無標題信但不公開相對人的姓名或生產企業名稱,以“廣而告之”的形式要求相對人及時糾正違規行為;而我國的提示函發出后,國家藥監局會要求屬地省級藥監部門結合日常監督檢查,有針對性地加強對相關生產企業的風險管理,以此達到約束相關生產企業執行監管部門要求的效果。
綜上所述,我國的提示函不是對相關生產企業的處罰手段,而是針對其藥品生產過程中出現的偏差,以技術支持的方式實行的干預措施。這貫徹落實了《藥品管理法》關于藥品管理應滿足風險管理、全程管控、社會共治的要求,幫助藥品上市許可持有人開展藥品上市后研究,對藥品的安全性、有效性和質量可控性進行進一步確證,加強對已上市藥品的持續管理。
3 提示函的主要內容
為促進相關生產企業充分理解提示函的要求,便于其采取針對性的排查整改措施,提示函應涵蓋風險排查整改所需全部信息,主要包括以下內容。
3.1 藥品基本信息
提示函中的藥品基本信息包括國家藥品抽檢探索性研究中發現存在一般質量風險的藥品的通用名、生產企業及所在省份、藥品批號等。通過這些信息可以幫助相關省級藥監局鎖定被提示的生產企業,并指導該生產企業鎖定需開展風險排查的目標藥品及其生產過程。
3.2 提示的風險信息
提示函的主體內容即為提示的風險信息,包括對探索性研究中發現的一般質量風險內容、發現的途徑和現象,并基于探索性研究數據對可能造成這一風險的原因進行初步分析,以簡要但足夠詳細的事實描述為相關生產企業的風險排查提供參考。
3.3 聯系人信息
為便于生產企業在需要時針對具體問題與承檢機構進行技術溝通,提高風險排查整改的效率,提示函中會提供發現相關風險的承檢機構聯系人及聯系方式,同時也要求承檢機構認真解答相關生產企業的咨詢。
3.4 發現風險的方法
承檢機構發現風險所用的方法是提示函的另一項重點內容,包括承檢機構探索性研究的新建方法、參照其他藥品的方法或非實驗性方法。在提示函中告知生產企業這些方法的正文已通過中檢院官網公開,可自由下載[10],便于相關企業在需要時使用。
3.5 排查整改要求
提示函的目的即為相關生產企業對風險進行排查整改,因此提示函中會要求相關生產企業在規定時間內圍繞所提示風險認真排查可能存在的隱患,對確實存在問題的隱患及時采取整改措施并向屬地省級藥監部門報告。
3.6 屬地省級藥監部門的職責
國家藥監局要求屬地省級藥監局將提示函送達相關生產企業,督促指導企業針對提示的問題開展排查整改,結合日常監督檢查工作有針對性地加強對企業的風險管理,并匯總整理各相關生產企業的排查整改情況后報告給國家藥監局。
4 提示函的工作程序
按國家藥監局組織制定的工作程序,提示函涉及承檢機構、中檢院、國家藥監局、相關生產企業屬地省級藥監局、相關生產企業等五方責任主體,工作過程包括數據征集、專家研判、提示函發送、排查整改和結果反饋等5個階段,具體如下:
承檢機構在國家藥品抽檢探索性研究中發現一般性風險后整理數據和方法并按要求報送中檢院,中檢院組織相關領域的檢驗專家對所報風險進行函審。如函審提出不同意見,則中檢院及時反饋給承檢機構進行修改;然后中檢院再次組織專家以現場會議的形式作出進一步研判,提出具體的處置建議。中檢院根據專家會議決議整理相關數據后報送國家藥監局并公開其所用方法。國家藥監局部署相關生產企業屬地省級藥監局組織相關生產企業排查整改。屬地省級藥監局將提示函送達相關生產企業,告知排查整改的要求及書面報告結果的時限,并提供力所能及的幫助;而在收到相關生產企業的排查整改情況匯報后及時報告國家藥監局,并在下一步的工作中重點關注相關生產企業產品的質量狀況,必要時加強監管。國家藥監局組織中檢院將排查整改的情況反饋給承檢機構,供承檢機構在下一步的工作中參考。以此形成閉環管理模式,實現監管部門與生產企業之間的良性互動,如圖1所示。
5 提示函制度實施情況分析
本文對2014-2020年提示函的整體情況進行分析,并對最新的2020年提示函總體情況、排查情況和整改情況、排查后仍存在的問題等進行分析,結果如下。
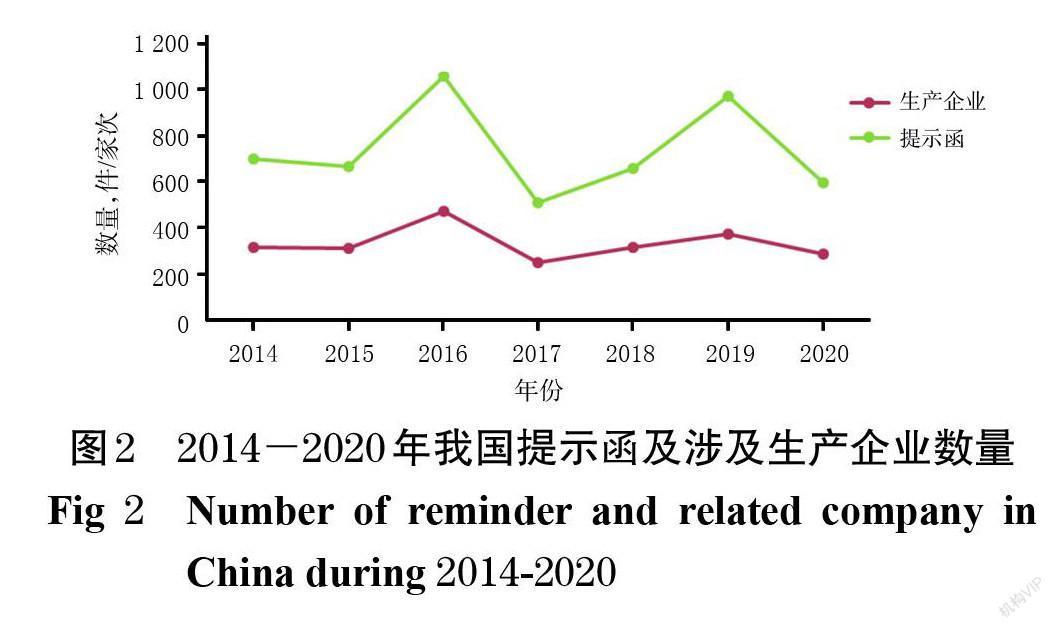
5.1 2014-2020年提示函整體情況
2014-2020年,國家藥監局已向2 323家次的生產企業發出2 837份提示函,涉及化學藥、中成藥、中藥飲片、生物制品、包材、輔料等各個類別的產品。由于每年國家藥品抽檢的具體藥品不同,其質量狀況各不相同,因此每年的提示函數量及被提示生產企業數量也隨之有所變化,如圖2所示。
5.2 2020年提示函整體情況
2020年,國家藥監局向28個省(區、市)及新疆生產建設兵團的286家生產企業發出312份提示函,主要涉及化學藥、中成藥、中藥飲片、血液制品和包材等51個品種的質量風險,整體情況如表1所示。提示函提示的質量風險主要包括在生產工藝控制、原料、輔料、包材、說明書、標簽標識等方面存在的缺陷或不足,承檢機構探索性研究發現這些問題的方法也在中檢院官網進行了同步公開。
5.3 2020年排查情況
各屬地省級藥監部門按提示函要求組織生產企業就提示函中的風險信息積極開展排查、分析和驗證并將排查整改情況反饋給國家藥監局。2020年,312份提示函中有6份中藥飲片的提示函由于涉及的6家生產企業已注銷,不會繼續生產藥品或繼續產生風險,故無排查必要。因此,在產的280家生產企業對306份提示函中的問題開展了排查,排查情況如表2所示。其中,以生產企業根據提示函對藥品生產全過程各環節開展排查并找到被提示的問題視為準確提示。從排查結果來看,各類藥品排查發現問題的提示準確率均超過85%,整體準確率達87.91%,說明2020年提示函具有較為滿意的科學性和針對性。
5.4 2020年整改情況
通過省級藥監局反饋的生產企業整改情況可以發現,各生產企業均開展了問題排查分析,查找原因并采取了具有針對性的多項整改措施,主要措施如下。
5.4.1 開展工藝驗證 提示函所提示的風險經排查發現生產工藝控制不佳者,其整改措施包括開展工藝驗證,必要時按要求申報變更。例如針對提示函提示的阿魏酸哌嗪片乙醇殘留量超標的問題,某生產企業的整改措施包括開展阿魏酸哌嗪片控制乙醇殘留顆粒預干燥時間和進風溫度的工藝驗證。
5.4.2 修訂內控標準 提示函所提示的風險經排查發現內控標準存在不足者,其整改措施包括對內控標準進行提高或完善。例如針對提示函提示的紅金消結膠囊缺少石細胞特征的問題,某生產企業的整改措施包括修訂成品內控質量標準,增訂石細胞鑒別項及鬼臼毒素含量測定控制項。
5.4.3 加強生產過程控制 提示函所提示的風險經排查發現生產過程控制不當者,需對其生產過程加強控制。例如針對提示函提示的安神補腦膠囊中的制何首烏、淫羊藿、甘草等原藥材指標性成分的轉移率較低的問題,某生產企業的整改措施包括加強中藥提取生產過程的管理,嚴格執行中藥提取過程藥材的揀、洗、潤、切、干燥等前處理工序,保證中藥炮制后的產品質量,加強對中藥提取、濃縮、醇沉、真空干燥等生產工序的工藝參數的監控。
5.4.4 加強“原、輔、包”質量控制 提示函所提示的風險經排查發現與原料藥、輔料或包材有關者,其整改措施包括加強對原料、輔料或包材的質量控制。例如針對提示函提示的注射用頭孢尼西鈉原料可能帶入異亞丙基丙酮雜質的問題,某生產企業的整改措施包括暫停使用某原料藥企業生產的頭孢尼西鈉原料用于制劑生產,并建立異亞丙基丙酮雜質檢測的方法與限度標準,同時對其他供應商原料生產工藝進行排查。
5.4.5 申請修訂藥品說明書 提示函所提示的風險經排查發現藥品說明書中存在缺陷或不足者,其整改措施包括申請修訂藥品說明書。例如針對提示函提示的復方感冒靈顆粒說明書中化學藥成分的安全性信息不完善的問題,某生產企業的整改措施包括對復方感冒靈顆粒近5年來的安全性信息進行評價,在藥品說明書中增加不良反應、用藥禁忌和注意事項等內容,現已完成補充申請備案。
5.4.6 加強人員培訓 提示函所提示的風險經排查發現生產人員的知識技能不足者,需加強對其相關人員的培訓。例如針對提示函提示的防風飲片薄層色譜中特征斑點較弱的問題,某生產企業的整改措施包括安排檢驗經驗豐富的人員對采購、驗收人員進行培訓,對防風栽培品與野生品如何鑒別等知識進行系統學習。
除上述整改措施外,大部分生產企業為控制藥品風險、減少用藥安全隱患,召回了已上市的藥品;也有生產企業在整改期間暫停相關品種的生產,待整改到位后恢復生產。以上情況充分說明,提示函可以有效規范企業的生產行為,促進企業生產管理水平的提升,進而防控潛在的藥品質量安全風險。
5.5 2020年排查存在的問題
通過排查情況可以發現,仍有27家生產企業的37份提示函經相關生產企業排查未能找到生產過程中存在的相應問題,分別占生產企業總數的9.64%(27/280)、占提示函總數的12.09%(37/306),涉及除血液制品外的所有類別的藥品,提示的問題則涵蓋了工藝處方、原料、輔料、藥品包材、說明書、標簽標識等各個方面。主要問題包括:(1)生產企業質疑提示風險的合理性——部分生產企業從中檢院官網下載相關品種的方法后開展研究,認為承檢機構的方法限度設置過高、無法重現承檢機構的檢驗結果、企業實驗室不具備承檢機構的實驗條件等,也未按提示函中所示的聯系方式與承檢機構進行溝通,即認為自身在藥品生產過程中不存在問題;(2)生產企業排查力度不足——部分生產企業收到提示函后僅對批生產記錄、批檢驗記錄、物料購進記錄、投料監控記錄等進行了檢查,認為符合現行版《藥品生產質量管理規范》(Good Manufacture Practices,GMP),卻忽略了這些記錄無法體現物料、人員、設施、設備、工藝、處方等所有可能影響藥品質量的細節問題,也未按中檢院官網公開的方法開展樣品檢驗研究。 這些問題都有待進一步解決。
6 討論
通過以上分析可以發現,當前我國化學藥、中成藥、中藥飲片、生物制品和包材的生產工藝、內控標準、原料、輔料、包材、生產過程、說明書等方面仍然存在諸多一般性風險。2014年至今,國家藥品抽檢探索性研究挖掘出了其中大量的問題,通過提示函使生產企業進行排查并采取有效的、有針對性的整改措施,以較高的科學性和針對性指導生產企業發現并解決問題,進一步規范藥品生產全過程,促進制藥行業健康發展,促進潛在用藥安全隱患的防控和藥品質量水平的持續提升。提示函這一藥品監管的創新性策略,也是對藥品監管科學理論的踐行和發展。
此外,藥監部門也應該認識到具體工作中仍存在諸多問題,不利于充分發揮提示函的作用。因此,為進一步加強和完善提示函制度、不斷提高藥品質量水平,筆者提出以下建議。
6.1 生產企業要正確認識提示函的性質和價值
部分生產企業向屬地省級藥監局反饋的排查整改情況中過度強調GMP合規,明顯帶有撇清責任的意思,由此可以發現企業對提示函的認識有待加強。生產企業應正確認識提示函是基于勸服優先原則的提醒,不具有制裁性,是承檢機構利用國家藥品抽檢的資源幫助生產企業發現并控制藥品質量風險的舉措。另一方面,美國FDA認為藥品生產企業不能僅僅滿足于GMP合規,GMP合規只是一個最低限度的基本要求,并不能說明生產工藝和管理體系不存在任何瑕疵;藥品生產企業若僅滿足于GMP合規,會失去提升藥品質量管理能力的機會,因而FDA鼓勵藥品生產企業主動采取措施不斷加強和完善藥品生產工藝和管理體系,積極與藥品監管機構進行溝通[11-12]。同理,我國的藥品生產企業也不能僅僅滿足于GMP合規,而應本著切實對藥品質量擔負主體責任的態度,正確理解提示函的性質及其對提高藥品質量的作用,消除對提示函的抵觸情緒,充分借助提示函中的問題提示及檢驗方法深入排查生產過程中可能影響藥品質量的風險,遇到問題時積極與承檢機構開展技術交流和溝通,不斷提高自身的藥品質量控制水平。
6.2 承檢機構進一步提高發現問題的科學性和針對性
藥品檢驗是通過科學的方法評價藥品質量特征、排查潛在風險,其準確性、規范性和公正性直接影響到檢驗機構的公信力[13-14]。對于部分生產企業排查未發現問題的情況,承檢機構也應認真反思報告的藥品質量風險的科學性,認真研究中檢院反饋的生產企業排查整改情況,在下一步的工作中對于成功的經驗要加以推廣和復制,對存在的缺陷和不足則要修正和改進。在以后的國家藥品抽檢探索性研究中,筆者建議承檢機構充分借助現有技術條件對抽檢品種的生產全過程開展調研,找到可能影響藥品質量的關鍵因素;在此基礎上設計詳實細致的探索性研究方案,建立科學合理的檢驗方法并進行嚴格的方法學驗證,加強探索性研究工作的質量管理,實現方法科學、數據準確;并將藥品質量風險的研究數據置于藥品工業化生產的背景中進行分析,將研究數據與生產企業的生產經營活動相關聯,識別其中存在的缺陷和不足,務必排除誤判的可能性,不斷提高提示函的科學性和針對性。
6.3 藥監部門重點關注排查發現的問題
針對生產企業根據提示函排查發現的問題,例如化學藥和包材中較為突出的工藝控制問題、中成藥的原料藥材質量問題、中藥飲片的炮制規范性問題等,建議屬地藥監部門繼續指導和幫扶相關生產企業整改到位,確保風險得到有效控制。另一方面,藥監部門要加強對上述問題的日常監管,將其列入重點檢查的內容。若藥監部門在后續檢查中發現相關生產企業未建立內部合規體系致使同樣的問題再次出現,則應采取強制力較強且具有制裁性的監管措施。例如藥監部門可借鑒美國FDA基于風險的檢查場地選擇模型(site selection model),將相關生產企業未按無標題信要求對藥品質量風險排查整改到位的情況視為優先檢查的風險因素[15],在后續日常監管中縮短對其檢查的時間間隔并開展重點檢查;發現問題時,繼續借鑒美國FDA無標題信的形式對其違規行為進行警告并對外公布,以在客觀上對其聲譽產生不利影響,達到懲戒的目的;后期根據相關生產企業的整改情況,決定撤銷警告或采取具有強制力、制裁性、威懾力的監管措施[16]。
參考文獻
[ 1 ] 盧超.社會性規制中約談工具的雙重角色[J].法制與社會發展,2019,25(1):146-163.
[ 2 ] 宋華琳,劉炫.美國FDA警告信的制度架構及啟示[J].中國食品藥品監管,2019(12):28-35.
[ 3 ] 國家食品藥品監督管理總局.國家藥品監管總局發出警示函 督促藥品生產企業排查風險提升藥品質量[EB/OL]. (2014-12-01)[2021-04-20]. https://www.nmpa.gov.cn/directory/web/nmpa/yaopin/ypjgdt/201412011034017- 64.html.
[ 4 ] 朱炯,王勝鵬,劉文,等.國家藥品抽檢藥品質量提示數據分析與探討[J].中國藥事,2020,34(8):909-915.
[ 5 ] ICH. ICH Q9:quality risk management[EB/OL].(2009-10- 03)[2021-04-21].http://www.ich.org/cache/compo/276- 254-1.html.
[ 6 ] 李幼平,文進,王莉.藥品風險管理:概念、原則、研究方法與實踐[J].中國循證醫學雜志,2007,7(12):843-848.
[ 7 ] 劉文,朱炯,胡駿,等.《藥品質量抽查檢驗管理辦法》與《藥品質量抽查檢驗管理規定》中檢驗和復驗內容的對比分析[J].中國藥房,2020,31(14):1665-1670.
[ 8 ] 劉文,朱炯,王翀.國家藥品抽檢風險管理主要舉措分析與建議[J].中國藥學雜志,2020,55(16):1394-1398.
[ 9 ] FDA. Issuance of untitled letters[EB/OL]. [2021-04-20]. https://www.fda.gov/inspections-compliance-enforcement- and-criminal-investigations/compliance-actions-and-acti- vities/issuance-untitled-letters.
[10] 朱炯,劉文,王勝鵬,等.我國藥品抽檢結果信息公開現狀分析與建議[J].中國藥學雜志,2020,55(18):1553-1558.
[11] FDA. Quality metrics for drug manufacturing[EB/OL].(2019-01-21)[2020-04-22]. https://www.fda.gov/drugs/pharmaceutical-quality-resources/quality-metricsdrug- manufacturing.
[12] 張景辰.加強事中監管,促進藥品產業的供給側改善:FDA質量量度計劃的啟示[J].中國食品藥品監管,2016(4):56-58.
[13] 王亞龍,王燕玲,張永.藥品檢驗過程中質量控制的必要性分析及有效措施探索[J].名醫,2019(2):24-26.
[14] 章瑩,孫國君,胡英.食品藥品檢驗研究院公信力影響因素與評價指標研究[J].中國藥房,2017,28(13):1746- 1749.
[15] FDA. Regulatory procedures manual,chapter 4:advisory actions[EB/OL]. [2021-04-22]. https://www.fda.gov/media/71878/download.
[16] FDA. Chapter 3:center for drug evaluation and research?[EB/OL]. [2021-04-22]. https://www.fda.gov/media/729-?59/download.
(收稿日期:2021-04-28 修回日期:2021-08-09)
(編輯:劉明偉)

