miR-30a對脂多糖誘導人臍靜脈血管內皮細胞自噬的影響
王麗君 趙瑜 胡燁 郭君平 張煒
miRNAs是一類廣泛存在于真核生物體的非編碼小RNA分子,其生物學效應廣泛,參與人體的生長發育、炎癥、免疫和腫瘤發生、發展等各個方面,是近年來的研究熱點[1]。miR-30a是miRNAs家族中的一員,在細胞生長和凋亡等多方面發揮重要的調節作用,與自噬關系尤為密切[2],但目前miR-30a相關研究主要集中于腫瘤相關領域[3],而對于其在炎癥模型中的作用卻知之甚少。在之前的研究中,筆者發現自噬在脂多糖(lipopolysaccharide,LPS)誘導血管內皮細胞(vascular endothelial cell,VEC)炎癥模型的炎癥調控中扮演了重要角色[4],而關于miR-30a是否也參與其中以及又是如何調控的,目前尚不清楚。因此,本研究探究miR-30a對LPS誘導人臍靜脈血管內皮細胞(human umbilical vein endothelial cells,HUVEC)自噬的影響及其可能機制,現報道如下。
1 材料和方法
1.1 實驗材料 LPS購自美國Sigma公司;DMEM/F12培養基和FBS均購自美國Gibco公司,細胞轉染載體Lipofectamine 2000和總RNA提取試劑Trizol均購自美國Invitrogen公司,反轉錄試劑盒與熒光定量PCR試劑盒均購自大連寶生物有限公司,細胞轉染質粒miR-30a-mimic和miR-30a-NC均購自廣州銳博生物公司,CCK-8試劑盒、BCA試劑盒均購自上海碧云天科技有限公司;兔抗人自噬相關基因(autophagy related gene 3,Atg3)抗體、泛素結合蛋白p62抗體、自噬蛋白微管相關蛋白1輕鏈3(microtubule-associated protein 1 light chain 3,LC3)抗體、β-actin抗體和羊抗兔二抗均購自英國Abcam公司;綠色熒光點-LC3(green fluorescence point-LC3,GFP-LC3)慢病毒質粒購自上海漢恒生物科技有限公司,HUVEC細胞購自上海奧賽爾斯生物技術有限公司。
1.2 細胞培養、分組和轉染 細胞培養:使用含10% FBS和1%雙抗的DMEM/F12培養基處理HUVEC細胞,細胞置于37℃、5% CO2恒溫培養箱中,每隔24 h至于倒置光學顯微鏡下觀察細胞的生長,取對數生長期的細胞用于實驗。實驗分組:(1)LPS組:HUVEC細胞給予LPS 20 μg/ml刺激 24 h(模擬炎癥,激活自噬);(2)NC組:HUVEC細胞加入miR-30a-NC轉染后再給予LPS 20 μg/ml刺激 24 h;(3)mimics 組:HUVEC 細胞加入miR-30a-mimics轉染后再給予LPS 20 μg/ml刺激24 h;(4)正常對照組(Control組):HUVEC細胞不予任何處理。細胞轉染:HUVEC細胞以每孔2×105個接種于6孔板中,培養至細胞密度70%左右,NC組和mimics組應用Lipofectamine 2000分別轉染miR-30a-NC和miR-30a-mimics,轉染方法參考試劑盒說明書,轉染后細胞繼續常規培養。
1.3 細胞增殖能力檢測 采用CCK-8法。取對數生長期的HUVEC細胞,按3 000個/孔接種于96孔板,待細胞完全貼壁后,更換培養液并按分組處理繼續培養24 h,每孔加入10 μl CCK-8工作液,培養1 h后用酶標儀測定在450 nm處的光密度(OD)值,并計算細胞存活率。細胞存活率(%)=(實驗組OD值-空白孔OD值)/(空白組OD值-空白孔OD值)×100%。
1.4 miR-30a相對表達量檢測 采用qRT-PCR法。將處理后的各組HUVEC細胞收集,采用Trizol法提取總RNA,測定總RNA濃度,取等量RNA反轉錄合成cDNA,采用SYBR Green進行 qRT-PCR,參照 qRT-PCR試劑盒配置相應的體系進行擴增,其中引物序列如下:miR-30a上游引物:5'-CACTCTCATGTAAACATCCTCGAC-3',下游 引 物 :5'-TATGGTTTTGACGACTGTGTGAT-3',內參U6上游引物:5'-CTCGCTTCGGCAGCACA-3',下游引物:5'-AACGCTTCACGAATTTGCGT-3',擴增條件如下:95℃30 s預變性(1個循環),95℃5 s,60℃30 s共40個循環,實驗完成后用2-ΔΔCt法計算miR-30a的相對表達量。
1.5 Atg3、p62、LC3-Ⅱ/LC3-Ⅰ等自噬相關蛋白表達水平檢測 采用Western blot法。收集實驗處理后的各組細胞,細胞充分裂解后提取總蛋白,BCA法測定總蛋白含量,聚丙烯酰胺凝膠電泳分離蛋白,濕法轉移至PVDF膜上,5%脫脂奶粉室溫下封閉1 h,TBST充分洗滌后加入一抗(Atg3、p62、LC3、β-actin,1∶1 000)4 ℃搖床過夜,TBST充分洗滌后加入二抗(1∶5 000)室溫孵育1 h,ECL化學發光法檢測蛋白的表達情況,再用ImageJ軟件進行定量分析。
1.6 免疫熒光觀察細胞自噬小體形成 各組細胞用GFP-LC3慢病毒質粒轉染細胞24 h,更換培養液按分組處理繼續培養24 h,在激光共聚焦熒光顯微鏡下觀察細胞內自噬小體情況。
1.7 統計學處理 采用SPSS 24.0統計軟件。計量資料以表示,兩組間比較采用兩獨立樣本t檢驗,多組間比較采用單因素方差分析,兩兩比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 LPS刺激后兩組細胞存活率和miR-30a相對表達量比較 LPS組細胞存活率明顯低于Control組,miR-30a相對表達量明顯低于Control組,差異均有統計學意義(均 P<0.05),見表 1。
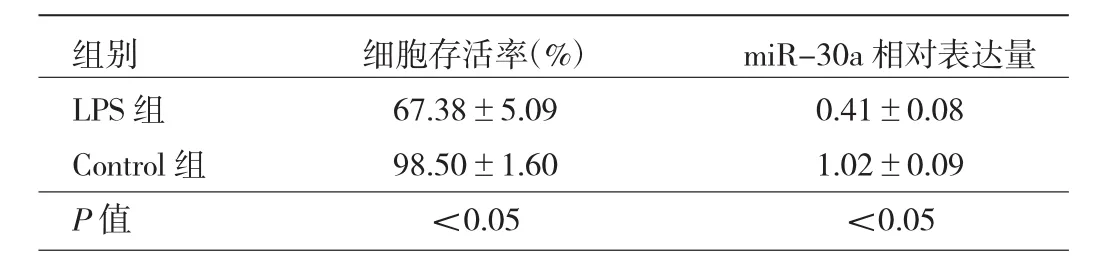
表1 LPS刺激后兩組細胞存活率和miR-30a相對表達量比較
2.2 LPS刺激后兩組細胞自噬相關蛋白表達水平比較 與Control組比較,LPS組細胞p62蛋白表達水平降低,Atg3蛋白表達水平升高,LC3-Ⅱ/LC3-Ⅰ比值升高,差異均有統計學意義(均P<0.05),見圖1、表2。
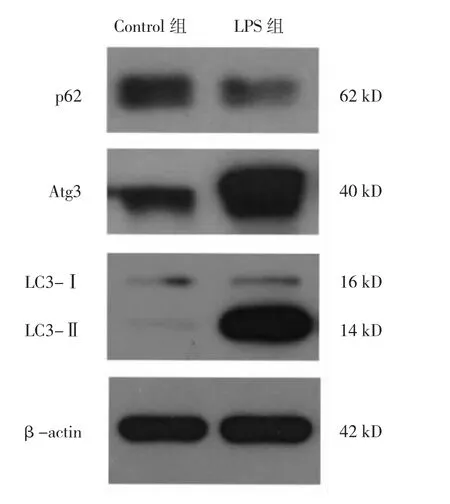
圖1 脂多糖(LPS)刺激后兩組細胞自噬相關蛋白表達的電泳圖(Atg3為自噬相關基因3;LC3為自噬蛋白微管相關蛋白1輕鏈3)
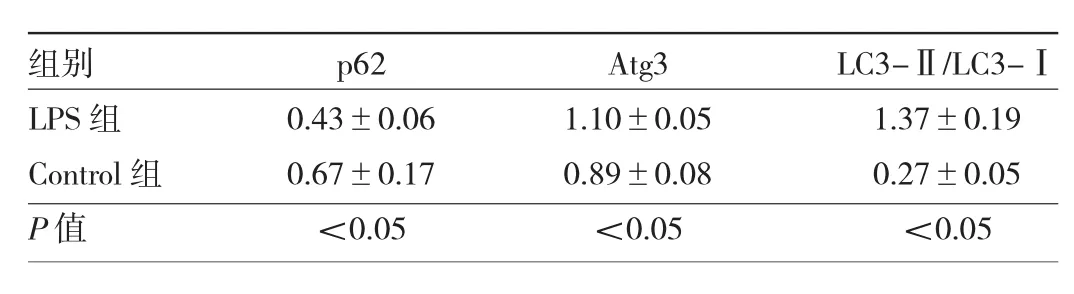
表2 LPS刺激后兩組細胞自噬相關蛋白表達水平比較
2.3 轉染miR-30a后LPS刺激3組細胞存活率和miR-30a相對表達量比較 轉染miR-30a后,與LPS組比較,mimics組細胞存活率明顯升高,miR-30a相對表達量明顯上升,差異均有統計學意義(均P<0.05),見表3。

表3 轉染miR-30a后LPS刺激3組細胞存活率和miR-30a相對表達量比較
2.4 轉染miR-30a后LPS刺激3組細胞自噬相關蛋白表達水平比較 轉染miR-30a后,與LPS組比較,mimics組細胞p62表達水平升高,LC3-Ⅱ/LC3-Ⅰ比值和Atg3表達水平降低,差異均有統計學意義(均P<0.05),見圖 2、表 4。

圖2 轉染miR-30a后3組細胞p62、自噬相關基因3(Atg3)、自噬蛋白微管相關蛋白1輕鏈3(LC3)-Ⅱ和LC3-Ⅰ蛋白表達的電泳圖
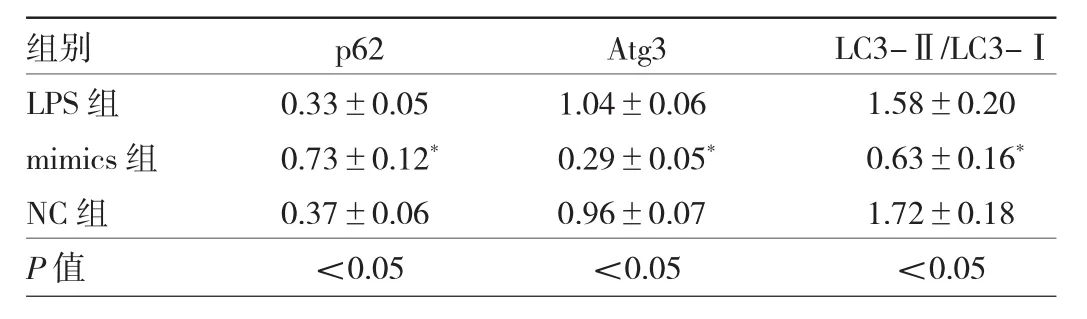
表4 轉染miR-30a后3組細胞p62、Atg3、LC3-Ⅱ和LC3-Ⅰ蛋白表達水平比較
3 討論
VEC是覆蓋于血管內膜表面的單層細胞,能通過分泌多種血管活性物質對各種信號作出反應,對維持心血管系統穩態也具有十分重要的意義[5]。當VEC受到各種刺激或損傷時,細胞會產生適應性自噬,并通過溶酶體吞噬降解受損細胞器和異常蛋白質,為細胞提供營養物質,維持血管穩態[6],這種程度的自噬往往是有益的;但當刺激持續存在或刺激強度過大時,細胞可能會發生過度的自噬而導致細胞死亡和細胞凋亡,血管穩態失衡[7],這種自噬往往是有害的,因此調控自噬有可能成為動脈粥樣硬化治療的新靶點。miRNAs廣泛參與基因表達調控,可通過調控自噬過程中關鍵蛋白的表達,進而參與動脈粥樣硬化的發病過程,具有重要調節作用[7]。
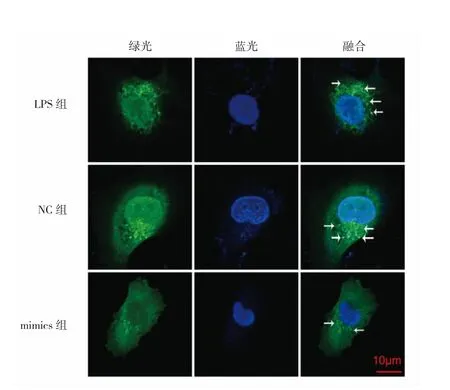
圖3 轉染miR-30a后3組細胞自噬小體(箭頭所示綠色熒光點)變化的激光共聚焦圖(LPS為脂多糖)
miR-30a是與自噬關系最為密切的miRNAs之一。在多種腫瘤細胞模型中,miR-30a能通過靶向調控自噬相關基因Beclin1表達影響腫瘤細胞自噬活性,從而影響腫瘤的增殖、侵襲和耐藥等各個方面[8-9];在哮喘模型中,miR-30a能通過下調自噬相關基因5來抑制自噬,在氣道重塑中發揮抗纖維作用[10];在急性肺損傷炎癥模型中,miR-30a能通過靶向調控人類runt相關轉錄因子2減輕LPS誘導的A549損傷和小鼠肺損傷[11]。本實驗結果顯示,LPS處理后HUVEC細胞miR-30a相對表達水平下降,細胞活力降低,自噬水平增加(自噬的選擇性底物p62蛋白表達水平降低),說明LPS誘導HUVEC炎癥模型中存在過度自噬,與之前報道文獻相一致[12];而進一步用miR-30a-mimics過表達處理上調miR-30a水平后,發現這種LPS誘導的過度自噬明顯被抑制,細胞活力明顯回升,提示miR-30a能通過抑制過度自噬來減輕LPS誘導HUVEC損傷。
細胞自噬激活后主要受Atg調控[13]。其中Atg3是一個調控自噬的類泛素化的蛋白基因,主要參與自噬體延伸過程中的第2個泛素樣通路,促進LC3和脂分子磷脂酰乙醇胺的結合,并在LC3-Ⅱ的形成中發揮重要作用[14],LC3-Ⅱ是自噬標志性蛋白,其含量與自噬泡數量呈正相關,LC3-Ⅱ/LC3-Ⅰ也是評估自噬水平高低的經典指標[15];此外Atg3也參與了自噬蛋白的翻譯后磷酸化、乙酰化等多種修飾過程[16]。在非小細胞肺癌細胞模型中,沉默Atg3可減輕自噬活性,通過上皮細胞間質轉化影響腫瘤侵襲[17];而在乳腺癌細胞模型中,過表達Atg3能夠通過細胞自噬抑制鹽霉素誘導的乳腺癌細胞凋亡[18];在肝癌細胞模型中,miR-30a可靶向調控Atg3介導的自噬抑制肝癌細胞的侵襲和轉移[19]。本實驗結果顯示,LPS作用于HUVEC后,Atg3蛋白表達水平增加,LC3-Ⅱ/LC3-Ⅰ比值升高;而進一步用miR-30a-mimics過表達處理上調miR-30a水平后,Atg3蛋白表達下降,LC3-Ⅱ/LC3-Ⅰ比值降低,GFPLC3單熒光自噬體系也直觀的發現自噬小體明顯減少,提示miR-30a能抑制自噬來減輕LPS誘導HUVEC損傷。但由于自噬受多種基因和蛋白的調控,miRNA只是眾多可能的調節因素之一,其他如lncRNA和circRNA等諸多因素都可能牽涉其中[20],具體miR-30a是如何調控自噬,以及是否還有其它的具體調控因素和潛在機制都還有待進一步研究證實。
綜上所示,過表達miR-30a能抑制LPS誘導HUVEC產生的過度自噬,從而減輕細胞損傷。因此,miR-30a可能是用于調控血管內皮炎癥損傷的新治療靶點。

