亞精胺浸種對鹽堿脅迫下香椿種子萌發的影響
閆聰 趙胡 樊明琴

摘 要:以紅香椿種子為材料,用0.3mmol·L-1亞精胺浸種處理12h,設置濃度為0、25、50、100mmol·L-1的混合鹽堿溶液模擬鹽堿環境,研究亞精胺浸種對鹽堿脅迫下香椿種子萌發、幼苗生長以及鹽堿抗性的影響。結果表明:在鹽堿脅迫下,香椿種子的發芽率、發芽勢、發芽指數、胚根長度以及香椿幼苗的存活率、根長均顯著下降;種子中的抗氧化酶、淀粉酶活性以及幼苗中的抗氧化酶活性、脯氨酸含量均有所上升。亞精胺浸種通過進一步提升抗氧化酶、淀粉酶的活性、增加脯氨酸的含量,有效地緩解了鹽堿脅迫對香椿種子及幼苗造成的損害,使種子及幼苗的表觀指標顯著增長。由此可見,0.3mmol·L-1亞精胺浸種能夠有效促進鹽堿脅迫下香椿種子的萌發及其幼苗的生長,并提高香椿幼苗對鹽堿的抗性。
關鍵詞:亞精胺;香椿種子;萌發;鹽堿脅迫
中圖分類號 S644.4文獻標識碼 A文章編號 1007-7731(2021)22-0036-07
Effect of Spermidine Soaked Seed on Germination of Toona sinensis Seed under Saline and Alkali Stress
YAN Cong1 et al.
(1School of Biology and Food Engineering Institute, Fuyang Normal University, Fuyang 236037, China)
Abstract: The seeds of Toona sinensis were treated with 0.3mmol·L-1 exogenous Spermidine solution for 12 hours. The mixed saline alkali solutions of 0, 25, 50 and 100mmol·L-1 were set to simulate the saline alkali environment. The treated seeds were divided into groups and placed in the above simulated saline alkali environment for germination test seedling growth and related enzyme activities. It proved that the germination rate, vigor index and radicle length of Toona sinensis Seeds decreased significantly under saline alkali stress. The survival rate and the length of aboveground and underground parts of Toona sinensis seedlings also decreased significantly under saline alkali stress. Under the same saline alkali conditions, the germination speed, vigor index and radicle length of the seeds treated with Spermidine were higher than those treated with distilled water. After the seeds treated with Spermidine grew into seedlings, the survival rate and the length of aboveground and underground parts of the seedlings treated with Spermidine were also higher than those treated with distilled water. In addition, Spermidine soaking can improve the activities of amylase and antioxidant enzymes in seeds, increase the activities of antioxidant enzymes and proline content in seedlings, so as to effectively alleviate the damage caused by saline alkali stress. In conclusion, 0.3mmol·L-1 Spermidine soaking can effectively promote the germination of Toona sinensis Seeds under saline alkali stress, and improve the adaptability of seedlings under saline alkali environment.
Key words: Spermidine; Toona sinensis seed; Germination; Saline-alkali stress
香椿(Toona sinensis)為楝科香椿屬的落葉喬木,在我國長江南北地區分布廣泛。香椿在春季萌發的新芽由于具有其特殊的風味而深受人們的喜愛,具有較高的市場價值。香椿適宜在土壤肥沃且濕潤、光照充足的環境中栽植,適宜其生長的土壤酸堿度在pH5.5~8.0。目前,對香椿幼苗在脅迫條件下的生理特性變化以及外界因素對香椿種子萌發的影響被越來越多的人所關注。
鹽堿脅迫是對植物正常生長發育起阻礙作用的非生物脅迫,也是制約經濟作物生產和影響生態環境建設的嚴峻問題。首先,它具有超出適宜植物生長范疇的鹽濃度而產生的鹽脅迫,這一因素會引發滲透脅迫、離子毒害、氧化應激等不利影響。其次,在堿脅迫下,pH的升高會與鹽脅迫引發的次生鹽害共同作用,對植物的根系產生更嚴重的損害,植物對礦物質的吸收受阻,進而使植物體受到嚴重的營養脅迫[1-2]。植物內部用以維持自身正常生長的穩態環境被打破,各種代謝活動出現明顯的變化。植物在鹽堿脅迫下,會采取一系列的調控措施來應對不良因素的影響。此時,植物體內的一些重要的酶、活性物質以及與這一調控過程相關的生理生化成分都將發生明顯的改變。與此同時,還可以從較為直觀的層面即植物的外部形態與生長發育狀況來推斷其所受脅迫損傷的程度。植物在表觀層面所呈現出對鹽堿脅迫的響應,集中表現在地上與地下生物量的分配。混合鹽堿脅迫下,植物高度、葉片數、莖長及地上部干物質重均有所下降,地下部分含水量和幼苗根長下降[3],導致鹽堿脅迫下植物的萌發率明顯下降以及植株的成活率顯著降低。研究作物的耐鹽堿機理,對于開發和有效利用鹽堿地有重要的現實意義[4]。
亞精胺(spermidine,Spd)又稱三鹽酸亞精胺,是一種廣泛存在于植物體內的多胺類物質,由于與脅迫狀態下植物的抗逆性密切相關,被視為提高植物應對逆境抵抗能力的優良材料。植物在環境壓力下,體內活性氧的含量大幅升高,膜脂因發生過氧化及脫脂化作用而受到損傷,進而影響到植株的正常代謝[5]。此時,采用適宜濃度的外源亞精胺溶液進行處理,可以使植物積累滲透物質,提高抗氧化酶等代謝調節相關的酶的活性,以此有效緩解滲透脅迫以及代謝失調所造成的傷害,進而使其抗逆性得到提升。
目前,對于外源亞精胺試劑浸種可以提高植物種子的萌發率、增強其萌發后對不良環境的適應能力的研究,已經在多類植物中得到證明。亞精胺浸種可以提高白三葉草種子在滲透脅迫下的萌發能力,同時提高其幼苗對該脅迫環境的適應性,這可能與亞精胺能夠增強三葉草種子內的淀粉酶活性有關[6]。亞精胺浸種也被證實可以提高番茄種子的萌發能力,促進番茄幼苗的生長,并且能夠提高番茄幼苗對高溫的抗性[7]。此外,隨著近年來圍繞如何有效利用鹽堿土地的研究被越發重視,有關提升植物在鹽堿脅迫下的萌發能力以及幼苗在鹽堿環境下的抗性也成為了研究熱點。亞精胺也被證實能夠有效提升植物的鹽堿抗性。經過亞精胺浸種處理的苜蓿種子,有效緩解了鹽堿脅迫所造成的傷害[8]。但關于亞精胺能否促進鹽堿脅迫下香椿種子的萌發,能否提升香椿幼苗在鹽堿脅迫下的適應能力,這一研究方向還沒有詳細的報道。
世界上約有20%的耕地受到鹽堿化的影響,且惡化程度逐年增大[9]。預計到2050年,50%以上的耕地會因鹽堿化而無法正常栽植作物[10],屆時可用耕地進一步縮減將會導致作物產量的顯著下降,這將會給蔬菜作物安全帶來不小的沖擊。結合鹽堿土地的利用問題以及多胺類物質可以有效提高植物抗逆性的特點,本試驗以紅香椿種子為試驗材料,研究亞精胺浸種對鹽堿脅迫下香椿種子萌發和幼苗生長的影響。試驗中記錄表觀層面特征指標的變化,同時選取不同時間點的試驗材料進行淀粉代謝的動態分析,對比不同處理下過氧化物酶、超氧化物歧化酶等重要酶的活性差異,以期尋找到得以提升鹽堿脅迫下紅香椿種子萌發能力的有效途徑,為證明試驗結果的準確性以及理解本試驗涉及的相關機制提供依據。
1 材料與方法
1.1 試驗材料 試驗材料選自產地為陜西安康的紅香椿種子,其來源于陜西秦巴紅葉生態農林開發有限公司,種子為去翅處理后的無翅凈籽狀態。材料采購后置于阜陽師范大學植物生理學實驗室的冰箱中進行冷藏保存。
1.2 試驗方法
1.2.1 香椿種子處理與鹽堿脅迫 在進行正式的萌發試驗前,需要按照試驗設置的組別挑選紅香椿種子。選種要求為籽粒飽滿、大小均勻、色澤明亮的個體,數量設置為每組60粒。本次試驗設置2個平行試驗組,即蒸餾水浸種處理組與0.3mmol/·L-1亞精胺浸種處理組。浸種處理結束后,各組將繼續細分為4個處理,分別在0、25、50、100mmol·L-1的鹽堿溶液中進行萌發實驗,鹽堿試劑為0、25、50、100mmol·L-1混合鹽堿溶液(將氯化鈉、碳酸氫鈉、硫酸氫鈉、碳酸鈉按照1∶9∶9∶1的比例溶于蒸餾水配置成鹽堿溶液,pH為8.5±0.1)。本次試驗共計8個組別。每個組別重復3次,各項表觀指標與生理指標同樣進行3次重復測定。
為方便后續操作與區分,將8個試驗組命名如下:以蒸餾水浸種處理的稱為CK組,依據后續萌發實驗中種子所處鹽堿環境的區別,將CK組的4個處理分別命名為CK0、CK25、CK50、CK100;以亞精胺浸種處理的稱為S組,同樣依據萌發實驗中種子所處鹽堿環境的區別,將S組的4個處理分別命名為S0、S25、S50、S100。按照試驗組別的設置,選取8只潔凈干燥的燒杯,依此寫上8個試驗組的名稱,每個燒杯中放入挑選好的紅香椿種子。選種結束后即可進入消毒階段。消毒方式為配制濃度為1%的次氯酸鈉溶液作為消毒液,將適量的消毒液加入上述盛有種子的燒杯中,進行時長為30min的浸泡消毒。浸泡消毒后需倒盡消毒液并用蒸餾水沖洗多次。
萌發試驗的第1步為浸種處理,CK組中加入等量蒸餾水,S組中加入等量濃度為0.3mmol/L的亞精胺溶液,將盛有浸種試劑與香椿種子的燒杯置于恒溫箱內靜置12h,溫度設置為22℃,恒溫箱內處于無光照的黑暗狀態。浸種處理12h后,取出燒杯并倒盡浸種試劑,用蒸餾水沖洗3次。取24個潔凈干燥的培養皿,按照上述試驗組別的編號進行標記,并在皿底放入2層潔凈的紗布。按照試驗組別的設置,在上述培養皿中分別加入等量濃度為0、25、50、100mmol·L-1的混合鹽堿溶液。隨后,將上述處理好的種子放置于編號相同的培養皿中,用鑷子擺放整齊以便后續的觀察與記錄。將光照培養箱的溫度設置為22℃,光照強度設置為0級,相對濕度設置為70%。將上述的培養皿移入培養箱中。
待萌發期指數記錄完畢后,幼苗需要繼續培養一段時間才能移栽入穴盤。此階段需將光照培養箱的溫度設置為22℃,光照強度設置為4級,光照時長設置為12h/d。待幼苗狀態穩定后,再將其移栽入穴盤。穴盤基質為營養土,用水澆透基質使其成較小的團塊狀,劃分好區域并按試驗組別進行標記,將對應組別的幼苗移栽入該區域。全部移栽結束后,將其放入阜陽師范大學溫室大棚內繼續培養。
1.2.2 香椿種子萌發期表觀指標的測定方法 萌發試驗階段需要進行為期7d的連續觀察。觀察中記錄每1天的發芽數,并且保證每天于同一時間進行相關數據的統計。選取種子發芽第3天的發芽數為基礎數據,進行發芽勢的計算。處理萌發階段記錄的萌發數與其對應的萌發天數的比值,進行有關發芽指數的計算。7d連續觀察結束后,整理各組最終的發芽數進行發芽率的計算。在萌發試驗結束后,于每1個試驗組中隨機挑選10株胚根完整的香椿幼苗進行胚根長度的測量。由于根系生長過程中易發生彎曲,可用細線緊貼根系從子葉著生處至根尖末梢,隨后取下細線并將其伸直即可用直尺測量出對應植株的根長。
計算公式如下:
發芽率(%)=(萌芽種子數/供試香椿種子數)×100%[11];
發芽勢(%)=(發芽3d種子發芽數/種子總數)×100%[12];
發芽指數:GI=∑GT/Dt;
式中:GI為發芽指數,Gt為萌發數,Dt為對應的萌發天數[12]。
1.2.3 香椿幼苗期表觀指標的測定方法 萌發試驗結束后,將狀態穩定的香椿幼苗移栽至穴盤,于溫室大棚中繼續培養30d。培養期結束時,香椿幼苗的真葉完全展開,其根系也適應了基質的環境并有了進一步的生長,適宜進行各項苗期指標的測定。首先進行各組幼苗存活率的統計,隨后將其移出基質用直尺測量其地上與地下部分的長度,地上與地下部分區分點為根莖結合處。計算公式如下:
存活率(%)=(現存植株數/移栽總數)×100
1.2.4 香椿種子及幼苗的生理指標的測定方法 萌發試驗階段選取不同處理的種子作為材料,使用氮藍四唑法進行SOD活性的測定,以比色法進行POD活性的測定,參考李合生所著實驗書進行淀粉酶活力的測定[13]。幼苗階段選取于溫室大棚培養30d后的香椿幼苗為材料。選取幼苗真葉部分進行SOD、POD活性的測定,方法同萌發期一致。選取幼苗真葉進行脯氨酸含量的測定,方法為磺基水楊酸法。
1.2.5 數據處理 試驗數據用Excel2016軟件進行統計并作圖,用SPSS20.0軟件進行分析,采用最小顯著差數法進行顯著性檢驗。
2 結果與分析
2.1 亞精胺浸種對鹽堿脅迫下香椿種子表觀指標的影響 由表1可知,鹽堿脅迫下香椿種子的發芽率、發芽勢、發芽指數、根長均隨所處鹽堿溶液濃度的增高而下降。首先,與CK0相比,以蒸餾水浸種但處于25、50、100mmol·L-1鹽堿溶液中進行萌發的CK25、CK50、CK100組的種子,其發芽率顯著下降,與CK0相比分別下降了5.57%、13.84%、22.23%。
其次,受鹽堿脅迫的CK25、CK50、CK100組,在發芽勢、發芽指數方面對比CK0顯著下降,發芽勢分別下降了16.67%、32.77%、48.89%,發芽指數分別下降了15.54%、36.41%、55.89%。再次,在根長上,CK25、CK50、CK100組與CK0的數據對比可得,CK25根長較CK0差異不顯著,CK50、CK100組的根長較CK0組顯著下降,CK50、CK100組的根長與CK0相比分別下降了64.71%、80.07%。
香椿可以在微偏堿性的土壤中正常生長,在部分鹽堿地區被視為優質的綠化樹種。綜上可以推測香椿種子可以耐受一定程度的鹽堿脅迫,可以在此范圍內保持較好的萌發狀態。從CK50與CK100組的萌發狀態可得,超過一定閾值后鹽堿脅迫對香椿種子的萌發會產生較大的影響,在50mmol·L-1的鹽堿環境中萌發的香椿其根長已有顯著的下降。此外,在萌發試驗階段,CK100組的香椿種子胚根因鹽堿脅迫未能正常生長。最后,CK100香椿種子因脅迫程度過高而腐壞在培養基中,未能長成幼苗,也無法收集到足夠的材料進行萌發階段的生理指標的測定。
由表2可知,亞精胺浸種對未受鹽堿脅迫紅香椿種子的發芽率、萌發后的根長無顯著影響,但顯著提升了香椿種子的發芽勢及發芽指數。
此外,受鹽堿脅迫的6組中,經亞精胺浸種處理的S25、S50、S100組顯著提高了同等脅迫處理CK25、CK50、CK100組的發芽率、發芽勢及發芽指數。S25、S50、S100組與對應的CK25、CK50、CK100組相比,發芽率分別提高了3.34%、6.05%、5.55%,發芽勢分別提高了8.34%、6.66%、6.12%,發芽指數提高了6.88%、10.54%、9.03%。
最后,在根長方面,CK0、S0、CK25、S25等4組根長無顯著性差異,CK50、S50、CK100、S100等4組根長無顯著差異。在0mmol·L-1、25mmol·L-1混合鹽堿溶液中萌發的種子,其根長顯著大于在50mmol·L-1、100mmol·L-1混合鹽堿溶液中萌發的種子。
由此可見,亞精胺浸種促進香椿種子的萌發,一定程度上緩解了鹽堿脅迫對香椿種子萌發的抑制作用。
2.2 亞精胺浸種對鹽堿脅迫下香椿種子萌發過程中淀粉酶活性的影響 由圖1可知,不同處理的α-淀粉酶活性在第0d無顯著差異。在種子萌發的第0、3、7天,不同處理的α-淀粉酶活性均呈現出先升后降的變化趨勢。CK25、CK50組種子的α-淀粉酶活性在萌發第3天和第7天均顯著高于CK0組。CK25組在萌發第3、7天的α-淀粉酶活性對比相同萌發天數的CK0組酶活性,分別提升了18.53%、12.13%。CK50組則分別提升了31.66%和23.70%。S25、S50組種子的α-淀粉酶活性在第3天和第7天均顯著高于CK25、CK50組。S25組在萌發第3、7天的α-淀粉酶活性較相同萌發天數的CK25組酶活性,分別提高了9.12%、22.68%。S50組在萌發第3、7天的α-淀粉酶活性較相同萌發天數的CK50組酶活性分別提高了18.77%、55.14%。S0組種子的α-淀粉酶活性與CK0組的酶活性相比,在種子萌發的第0、3、7天均無顯著性差異。
由圖2可知,在萌發第0天,β-淀粉酶的活性于各組處理之中無顯著差異。在種子萌發的第0、3、7天,β-淀粉酶的活性變化在CK0組中呈現先升后降的趨勢,而在CK25、S25、CK50、S50等4組中則為持續升高的趨勢。
CK25、CK50組種子的β-淀粉酶活力在萌發第3d和第7d均顯著高于CK0組。CK25組在萌發第3、7天的β-淀粉酶活性對比相同萌發天數的CK0組酶活性,分別提升了7.13%、92.80%,CK50組則分別提升了17.38%、115.71%。
S25、S50組種子的β-淀粉酶活性在第3天和第7天均顯著(P<0.05)高于CK25、CK50組。S25組在萌發第3、7天的β-淀粉酶活性較相同萌發天數的CK25組酶活性,分別提高了13.09%、12.15%。S50組在第3、7天的β-淀粉酶活性較相同萌發天數的CK50組酶活性,分別提高了20.96%、22.08%。S0組種子的β-淀粉酶活性與CK0組的酶活性相比,在種子萌發的第0、3、7天均無顯著性差異。
由圖3可知,(α+β)-淀粉酶活性,在第0、3、7天的變化趨勢與β-淀粉酶活性變化趨勢相似。在萌發第0天,(α+β)-淀粉酶的活性于各組處理之中無顯著差異。在種子萌發的第0、3、7天,(α+β)-淀粉酶的活性變化在CK0組中呈現先升后降的趨勢,而在CK25、S25、CK50、S50等4組中則為持續升高的趨勢。
CK25、CK50組種子的(α+β)-淀粉酶活力在萌發第3d和第7d均顯著高于CK0組。CK25組在萌發第3、7天的(α+β)-淀粉酶活性對比相同萌發天數的CK0組酶活性,分別提升了9.09%、77.91%,CK50組則分別提升了19.84%、98.72%。
S25、S50組種子的(α+β)-淀粉酶活性在第3天和第7天均顯著(P<0.05)高于CK25、CK50組。S25組在萌發第3、7天的(α+β)-淀粉酶活性較相同萌發天數的CK25組酶活性,分別提高了12.35%、13.38%。S50組在第3、7天的(α+β)-淀粉酶活性較相同萌發天數的CK50組酶活性,分別提高了20.54%、25.87%。S0組種子的(α+β)-淀粉酶活性與CK0組的酶活性相比,在種子萌發的第0、3、7天均無顯著性差異。
綜上所述,受到鹽堿脅迫的香椿種子會提升自身的淀粉酶活性,而經過亞精胺浸種處理后再受到鹽堿脅迫的香椿種子,其在萌發的過程中淀粉酶活性會進一步的提升。淀粉酶的作用為催化淀粉水解,水解生成的糖類物質可以參與到植物的代謝過程,為植物提供能量。由此可知,香椿萌發階段通過提升淀粉酶活性加速淀粉向糖類物質的轉化,從而應對鹽堿脅迫,而亞精胺處理后再受到鹽堿脅迫的香椿則進一步加速了這一轉化過程。
2.3 亞精胺浸種對鹽堿脅迫下香椿種子中SOD、POD活性的影響 由圖4、圖5可知,鹽堿脅迫下香椿種子的SOD、POD活性較未受脅迫處理的種子有了顯著的提升。隨著鹽堿濃度的升高,2種酶的活性隨之上升。經亞精胺浸種處理后再受鹽堿脅迫的種子,SOD、POD的活性有進一步的提升。CK25與CK50組較CK0組酶活性顯著升高。其中,CK25組SOD活性較CK0組提升了101.74%,POD活性較CK0組提升了12.23%。CK50組SOD活性較CK0組提升了346.28%,POD活性較CK0組提升了34.57%。相同鹽堿脅迫下,S組種子的SOD、POD活性較CK組顯著升高。其中,S25組SOD活性較CK25組提升了39.39%,POD活性提升了18.52%。S50組的SOD活性較CK50組提升了33.90%,POD活性提升了20.62%。S0組較CK0組SOD、POD的活性顯著升高,SOD活性上升了48.91%,POD活性上升了9.61%。
綜上可知,香椿種子在鹽堿脅迫下,其SOD、POD活性得到了顯著提升。這2種酶在植物體內消除活性氧的反應,以減輕活性氧積累對植物體的損傷。亞精胺浸種處理后再受到鹽堿脅迫的種子,其體內SOD、POD活性進一步提升,進而緩解了種子在鹽堿脅迫下萌發受阻的情況。
2.4 亞精胺浸種對鹽堿脅迫下香椿幼苗表觀指標的影響 由表3可知,隨著鹽堿脅迫程度的增大,幼苗移栽30d后的存活率不斷下降,其地上部分與地下部分的生長均受到了鹽堿脅迫的阻礙。S0組與CK0組相比其存活率有了顯著的提升,S0組存活率較CK0組提升了5.91%,而S0組與CK0組的地上部分長度、地下部分長度差異均不顯著。在鹽堿脅迫狀態下,經過亞精胺浸種處理可以顯著提高幼苗的存活率,促進幼苗根系的生長。S25組與CK25相比較,其存活率提升了8.89%,地上部分長度差異不顯著,地下部分長度差異顯著,S25組的地下部分長度較CK25組增長了49.19%。S50組與CK50組相比,其存活率提升了11.12%,地上部分長度差異不顯著,地下部分長度差異顯著,S50組的地下部分長度較CK50組增長了198.36%。
由此可見,在鹽堿脅迫下,蒸餾水浸種處理后萌發的香椿幼苗其根系受損嚴重,而相同脅迫環境下,亞精胺浸種處理能有效地緩解鹽堿脅迫下香椿幼苗根系生長受阻的狀況。綜上可知,鹽堿脅迫下,通過亞精胺浸種處理可以有效地促進幼苗根系的生長,顯著提升了香椿幼苗的存活率。
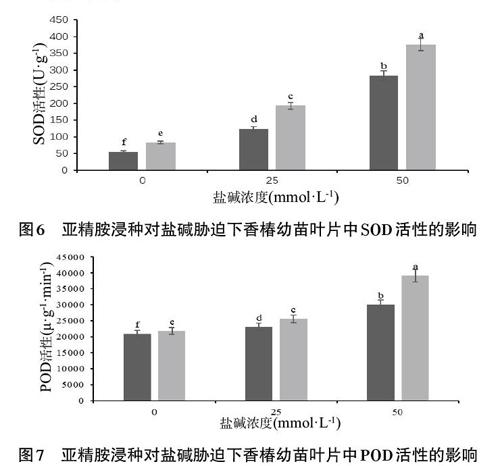
2.5 亞精胺浸種對鹽堿脅迫下香椿幼苗葉片中SOD、POD活性的影響 由圖6與圖7可知,鹽堿脅迫下香椿幼苗葉片中SOD、POD的活性顯著升高,并且隨著脅迫程度的加大,葉片中SOD、POD的活性會隨之升高。通過分析CK25、CK50組與CK0組的數據可得,其SOD活性較CK0組分別升高121.98%、407.25%,其POD活性分別升高了10.20%、42.98%。
相同鹽堿脅迫環境下,S組香椿幼苗葉片中SOD與POD的活性較CK組顯著升高。S25組與CK25組相比,其SOD活性升高了55.65%,POD活性提升了10.91%。S50組與CK50組相比,其SOD活性升高了33.04%,POD活性提升了30.72%。此外,S0組幼苗葉片中SOD、POD的活性與CK0組相比也有顯著地提升,其SOD活性升高了49.21%,POD活性提升了4.32%。
綜上可知,鹽堿脅迫下,香椿幼苗葉片中SOD與POD的活性顯著提升,而抗氧化酶活力的提升可以加速積累在植物體內的活性氧的消除。在亞精胺浸種處理后,其葉片中的抗氧化酶的活性將會進一步的提升,從而緩解鹽堿脅迫對香椿幼苗生長的阻礙,提升幼苗應對鹽堿脅迫的抗性。
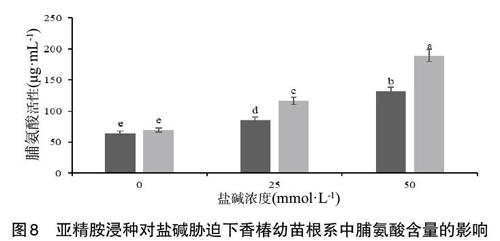
2.6 亞精胺浸種對鹽堿脅迫下香椿幼苗根系中脯氨酸含量的影響 由圖8可知,隨著鹽堿溶液濃度的升高,香椿幼苗根系中脯氨酸的含量顯著增加。CK25、CK50組與CK0組相比,其脯氨酸的含量分別增加了32.57%、103.26%。此外,在相同程度的鹽堿脅迫下,S組香椿幼苗根系中脯氨酸的含量較CK組顯著增加。S25組與CK25組相比,其根系中脯氨酸的含量增加了35.96%。S50組與CK50組相比,其根系中脯氨酸的含量增加了43.96%。此外,S0組幼苗根系中脯氨酸的含量與CK0組相比差異不顯著。
綜上可知,鹽堿脅迫下香椿幼苗通過增加脯氨酸在根系中的含量來響應脅迫。脯氨酸作為滲透調節物質,在防止植物細胞因外界不良環境而造成的水分大量流失,維持細胞膜完整性等方面發揮著重要的作用。而亞精胺浸種后,鹽堿脅迫下香椿幼苗的根系之中,脯氨酸的含量進一步增加,通過脯氨酸在調節滲透平衡方面的重要作用,緩解鹽堿脅迫對香椿幼苗根系的損害。
3 討論
3.1 亞精胺浸種對鹽堿脅迫下香椿種子萌發的影響 植物對于鹽堿脅迫的響應,不僅可以從其自身出發,從內而外的進行調節,同樣也可以接受由外界因素帶來的影響,從而由外到內引發相關調節機制的變化。鹽堿脅迫作用方式為多因素綜合作用,在綜合作用的影響下能夠顯著降低香椿種子的發芽率、發芽勢、發芽指數并阻遏胚根的生長。鹽堿脅迫的存在破壞了滲透平衡,導致細胞內水分的大量流失,根系吸水困難。亞精胺作為一種可以提高植物應對逆境的抵抗能力的活性物質,與植物對脅迫的響應聯系密切。本試驗結果表明,施用外源亞精胺試劑處理香椿種子可以提升種子應對鹽堿脅迫的能力,緩解鹽堿脅迫對其造成的損害,促進種子的萌發以及胚根的生長。亞精胺浸種可以提高鹽堿脅迫下香椿種子的淀粉酶活力,加速淀粉水解為小分子糖類物質的過程,以供種子的萌發與生長。淀粉加速分解可以促進糖類物質的積累,除供給植物生長所需外,還可以作為滲透調節物質發揮作用。此外,亞精胺浸種提升了鹽堿脅迫下香椿種子內抗氧化酶的活性,增強了植物在鹽堿脅迫下的抵御能力。
3.2 亞精胺浸種對鹽堿脅迫下香椿幼苗生長的影響 鹽堿脅迫能夠顯著降低香椿幼苗的存活率、地上及地下部分的長度,而香椿幼苗自身對該脅迫具有一定的抵抗能力。通過試驗中對其真葉部分SOD、POD活性的測定可知,鹽堿脅迫下香椿幼苗體內的保護酶活性升高,用以緩解因脅迫造成的損害。此外,通過對香椿幼苗根系部分的脯氨酸含量的測定可知,除提升保護酶活性這一機制外,增加體內脯氨酸的含量,也是植物自身抵抗鹽堿脅迫的一項重要機制。在相同的鹽堿環境下,經外源亞精胺試劑處理后生長而成的幼苗,其對于鹽堿脅迫的抵抗性顯著增強。SOD、POD可以幫助細胞抵御活性氧造成的傷害、保護細胞膜、控制膜脂過氧化以及清除植物體內的自由基,以此提高植物對鹽堿脅迫的抗性。脯氨酸作為滲透調節物質參與植物體內的滲透調節,它能夠提高脅迫狀態下細胞內溶質的濃度、降低細胞水勢、增強細胞的吸水能力,其含量的增加可有效防止細胞內水分的過度流失。此外,脯氨酸在保持細胞膜完整性方面也發揮著重要的作用。由此可知,外源亞精胺通過增強抗氧化酶活性、增加滲透調節物質的含量等多方面的抵抗能力,響應鹽堿脅迫帶來的綜合作用,從而有效地促進了香椿幼苗在鹽堿脅迫下的生長。
4 結論
由本次試驗可知。0.3mmol·L-1亞精胺浸種能夠有效促進鹽堿脅迫下香椿種子的萌發及其幼苗的生長,并提高香椿幼苗對鹽堿的抗性。
參考文獻
[1]郭瑞,李峰,周際,等.亞麻響應鹽、堿脅迫的生理特征[J].植物生態學報,2016,40(1):69-79.
[2]CAPULA-RODRIGUEZ ROBERTO, VALDEZ-AGUILAR LUIS A, CARTMILL DONITA L, et al. Supplementary Calcium and Potassium Improve the Response of Tomato (Solanum lycopersicum L.) to Simultaneous Alkalinity, Salinity, and Boron Stress[J]. Communications in Soil Science and Plant Analysis, 2016, 47(4):505-511.
[3]BINSHUO LIU, CHUNLI KANG, XIN WANG, et al. Physiological and morphological responses of Leymus chinensis to saline-alkali stress[J]. Grassland Science, 2015, 61(4):217-226.
[4]王佺珍,劉倩,高婭妮,等.植物對鹽堿脅迫的響應機制研究進展[J].生態學報,2017,37(16):5565-5577.
[5]ASISH KUMAR PARIDA, ANATH BANDHU DAS. Salt tolerance and salinity effects on plants: a review[J]. Ecotoxicology and Environmental Safety, 2005, 60(3):324-349.
[6]潘明洪,李州,彭丹丹,等.亞精胺浸種對滲透脅迫下白三葉種子萌發及淀粉代謝的影響[J].植物生理學報,2014,50(4):426-432.
[7]王玉,劉國州,蔡溧聰,等.亞精胺浸種對番茄種子萌發及幼苗高溫抗性的影響[J].中國蔬菜,2020,(5):34-39.
[8]夏關雪瑩,王冰,屈琳俐,等.亞精胺浸種緩解鹽堿脅迫對苜蓿生長抑制的研究[J].中國草地學報,2019,41(5):17-23.
[9]XIAXIANG ZHANG, ZHIQIANG SHI, YOUJIA TIAN, et al.Salt stress increases content and size of glutenin macropolymers in wheat grain[J]. Food Chemistry, 2016, 197:516-521.
[10]WANGXIA WANG, BASIA VINOCUR, ARIE ALTMAN. Plant responses to drought, salinity and extreme temperatures: towards genetic engineering for stress tolerance[J]. Planta, 2003, 218(1):1-14.
[11]李文嬈,張歲岐,山侖.水分脅迫下紫花苜蓿和高粱種子萌發特性及幼苗耐旱性[J].生態學報,2009,29(6):3066-3074.
[12]焦樹英,李永強,沙依拉·沙爾合提,等.干旱脅迫對3種狼尾草種子萌發和幼苗生長的影響[J].西北植物學報,2009,29(2):308-313.
[13]李合生.植物生理生化實驗原理和技術[M].北京:高等教育出版社,2000:169-172. (責編:張宏民)

