運脾化濁顆粒對糖尿病合并脂肪肝大鼠模型的干預機制
肖 洋,柯 婷,李 婷,王高雷,杭 程,王露露,師韓菲,董丹丹,祁海燕
(陜西省中醫醫院,陜西 西安 710003)
隨著現代社會生活水平不斷提高,糖尿病合并脂肪肝人群與日俱增。據流行病學調查研究顯示,健康人群脂肪肝發病率約為20%~30%[1],而在糖尿病患者人群中約76%患者合并脂肪肝,脂肪肝患者血糖損害或糖尿病發病率約18%~33%[2-3]。長期糖脂代謝紊亂可導致血管、神經、心臟等組織器官功能缺陷和衰竭,加重肝臟脂肪樣變,可進一步產生或加重肝臟細胞癌變及心血管事件風險,嚴重危害人類健康[4-6]。目前公認的胰島素抵抗是兩者共同發病機制,胰島β細胞為維持體內血糖平穩,肝臟組織在胰島素抵抗下,需分泌胰島素代償,導致高胰島素血癥,且需提高內固醇調控組件蛋白1-C(SREBP-1c)及肝X受體(LXR)的呈現。平衡體內脂肪生成基因表達的SREBP-1c,升高脂肪酸合成作用,加速肝細胞內脂肪儲存。LXR是新發現的一種肝臟內脂質調節因子,其可與SREBP-1c形成正反饋調節回路,參與調控肝臟內的脂質生成過程。另外,葡萄糖可通過激活轉錄因子碳水化合物反應原件結合蛋白(ChREBP)表達,促進脂肪酸生物合成。ChREBP亦可促進肝臟內丙酮酸激酶活性,為肝臟游離脂肪酸(Free fattyacids,FFAs)和甘油三酯(Triglyceride,TG)合成提供底物。因此,ChREBP成為中藥干預研究的重要靶點[7]。
中醫學認為糖尿病屬“消渴”范疇,主要病機為氣陰兩傷、血瘀于絡,而脂肪肝屬“淤濁”,發病機制乃情志不舒、肝郁氣滯、氣滯血瘀、濕痰內停、痰瘀痹阻肝絡[8]。凡飲食不節,過食肥甘厚膩之品,胃不主受納,陽明胃腸生熱化燥傷津,“脾胃同居中焦”,胃腸燥熱太過,則反傷脾氣,脾不主運化,氣機不行,清陽不升,濁陰不降,清濁互亂于中,痰飲內生,郁滯中焦;日久疾病由太陰發展至厥陰。“肝屬木,腎屬水,肝為腎之子,母欲受邪,子先代之”,故本病核心病機為“胃熱脾困、痰濁瘀結”[9]。針對這一病機,設辛開脾困、苦降胃熱、酸化陰精之法,研制運脾化濁方,本方具有清熱降氣、開郁運脾、化痰活血之功。該方前期經過大量臨床療效觀察,可有效改善機體糖、脂代謝及胰島素抵抗[10-11]。同時研究證實,運用運脾化濁方辛開脾困、苦降胃熱、酸化陰精,可有效改善該類患者肝脾CT比值及胰島素抵抗指數,其安全性較高,臨床療效較好[12]。
本研究通過建立2型糖尿病合并脂肪肝大鼠模型,通過運脾化濁中藥單用,西藥單用及運脾化濁中藥聯合西藥的干預,闡述運脾化濁方對模型大鼠生化指標的影響、肝臟病理變化,并運用PCR法檢測蛋白SREBP-1、ChREBP、PPARa和調節因子LXR的作用機制。
1 材料與方法
1.1 實驗材料
1.1.1 實驗動物:選用SPF級SD健康雄性大鼠33只(許可證號NO1103222011002509,北京華阜康公司),體重(100±20)g。飼養于干凈實驗室,環境溫度為(21±3)℃,相對濕度為60%~80%,自然光照射。保持安靜環境,自由飲水進食。
1.1.2 實驗藥物與試劑:運脾化濁免煎制劑由陜西省中醫醫院米氏內科內分泌二科提供,陜西省中醫醫院中藥免煎制劑中心配制。鏈脲佐菌素(Streptozocin)批號:S1030-100mg。DEPC水:1 ml DEPC加入1000 ml雙蒸水中,37 ℃飽和24 h后121 ℃濕熱滅菌30 min配成1‰ DEPC水。ligo(dT)18 Primers (TaKaRa D511):首次使用時溶于280 μl DEPC水。1.5 mmol/L Tris-HCl pH 8.8緩沖液(貨號Cat#T1010)、1 mmol/L Tris-HCl pH 6.8緩沖液(貨號Cat#T1020)、30%的丙烯酰胺制膠液(29∶1)(貨號Cat#A1010)、RIPA裂解液(貨號P0013B)、TEMED(貨號L19S10G98319)、B10FROXX(貨號4240GR100)、過硫酸銨(貨號A1004)。TWEEN 20(貨號:1247ML500);甘氨酸(貨號Cat#G8200);Tris(貨號1115GR500);氯化鈉;抗體PPAR-a(抗體名52KD);WBSCR(抗體名93KD);SREBP-1(抗體名122KD);LXR-A(抗體名50KD);Gapdh (抗體名37KD);Goat Anti-Rabbit IgG(二抗)。
1.1.3 實驗儀器:離心機(德國Eppendorf-5430)、包埋機(型號KD-BM,浙江省金華市科迪儀器設備有限公司)、病理切片機(型號KD-2258,浙江省金華市科迪儀器設備有限公司)、攤片機(型號KD-P,浙江省金華市科迪儀器設備有限公司)、凍臺(型號KD-BL,浙江省金華市科迪儀器設備有限公司)、烤箱(型號PHG-9070A,上海精宏實驗設備有限公司)、載玻片及蓋玻片(型號10212432C,江蘇世泰實驗器材有限公司)、正置光學顯微鏡(型號OLYMPUS CK31,日本奧林巴斯)、成像系統(型號TVO.63XC-MO,明美Mshot)、鼓風式干燥箱(型號101-3,上海錦屏儀器儀表有限公司)、蒸氣消毒器(型號YXQG02,山東新華醫療器械股份有限公司)、電熱式電熱恒溫鼓風干燥箱(型號DHG-9145A,上海一恒科技有限公司)。
1.2 實驗方法 所有實驗大鼠適應性喂養1周后,按照隨機數字表分為兩組,除空白組予以0.9%氯化鈉溶液外,余組大鼠均予以高糖高脂(成分:10%蔗糖、10%蛋黃、10%豬油、1.5%膽固醇、0.5%膽鹽、68%基礎飼料混合)飼料喂養1個月后,連續5 d每天給予STZ 40 mg/(kg·d),腹腔內注射,STZ 7 d后,用血糖儀取尾靜脈血測空腹血糖,以連續3 d大鼠空腹血糖值(FBG)高于11.1 mmol/L作為大鼠造模成功標準。成模后繼續給予高糖高脂飲食喂養1個月,建立非酒精性脂肪肝大鼠模型。將造模成功的糖尿病大鼠隨機分為四組,運脾化濁組、運脾化濁聯合二甲雙胍組、二甲雙胍組、模型組。正常組每日予以0.9%氯化鈉溶液灌胃1 ml/只;運脾化濁組每日予以免煎中藥灌胃3 ml/只;運脾化濁聯合二甲雙胍組每天灌胃運脾化濁顆粒2 ml/只、二甲雙胍1 ml/只;二甲雙胍組每天灌胃3 ml/只。治療8周結束后3 d處死大鼠,取全血或血清檢測生化指標,取肝臟組織進行HE染色觀察。
取肝臟組織樣品(約30~100 mg)分放入盛有1 ml變性緩沖液(TRIZOL)的手動勻漿器中,在冰浴中充分勻漿。將勻漿液移至1.5 ml的Eppendorf管中,15~30 ℃靜置5 min。加入0.2 ml氯仿充分混勻15 s,15~30 ℃下靜置2~3 min,4 ℃下12000 r/min離心15 min。取上層水相置于新的EP管內,加入等體積的異丙醇,混勻后靜置10 min,4 ℃下12000 r/min離心10 min。棄去上清,加入1 ml的80 %乙醇清洗沉淀,4 ℃下10000 r/min轉離心10 min。清洗2次,室溫風干沉淀約20 min,用30 μl DEPC水溶解沉淀,取1 μl稀釋100倍后測OD260。計算濃度:RNA濃度(μg/μl)=OD260×40×稀釋倍數/1000。進行RT反應,制備cDNA模板,再進行實時定量PCR。
2 結 果
2.1 各組大鼠肝臟病理變化 各組大鼠的病理表現,見圖1。正常對照組:肝組織結構清晰完整,肝小葉結構正常,以中央靜脈為中心向四周放射的肝細胞排列整齊,肝竇清晰可見,肝細胞內無脂滴沉積和炎細胞浸潤。模型組:肝細胞結構紊亂,呈中-重度脂肪變性。肝小葉結構不清晰,可見腫脹和氣球樣變肝細胞,肝細胞索模糊不清,肝竇消失。運脾化濁聯合二甲雙胍組:大部分肝臟組織恢復正常,肝小葉結構清晰,肝細胞索排列呈放射狀,少量小脂滴存在于胞漿內,細胞核位置居中,無炎細胞浸潤。二甲雙胍組:肝細胞索較整齊,肝細胞輕度腫脹,有大小不等的圓形脂滴空泡存在于胞質內,細胞核不居中。運脾化濁組:肝小葉結構清晰度尚可,肝索排列呈放射狀。
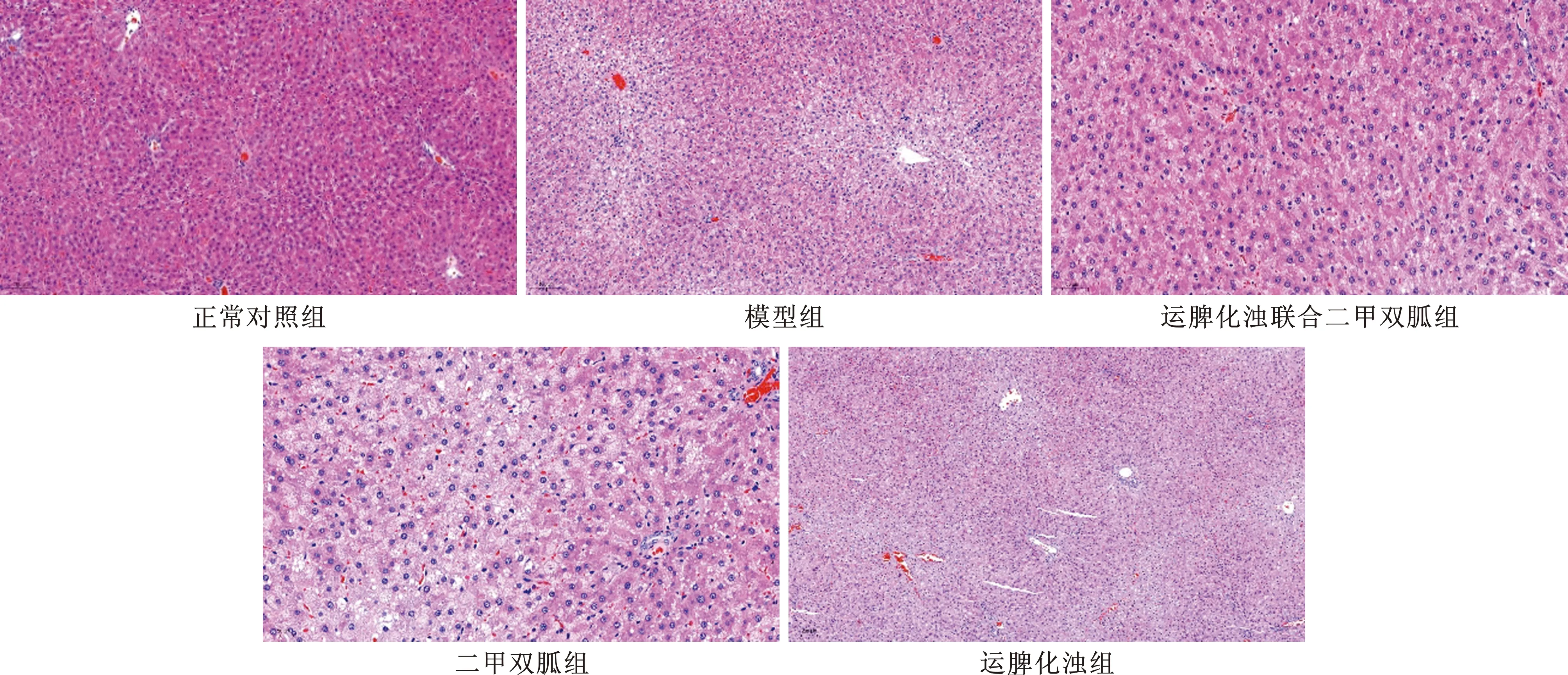
圖1 各組大鼠肝臟病理表現(HE染色,×10)
2.2 各組大鼠血清丙氨酸氨基轉移酶(ALT)、天門冬氨酸氨基轉移酶(AST)、游離脂肪酸(FFA)及甘油三酯(TG)比較 見表1。各組大鼠血清ALT比較,差異有統計學意義(F=15.587,P<0.01)。各組大鼠血清ALT比較,正常對照組較其他各組大鼠ALT無明顯升高(P<0.01),二甲雙胍組與運脾化濁聯合二甲雙胍組相比,差異有統計學意義(P<0.01),說明應用二甲雙胍比聯合運脾化濁方案能更有效改善大鼠ALT水平。各組大鼠血清AST、FFA水平比較,差異無統計學意義(均P>0.05),說明二甲雙胍與運脾化濁方在改善大鼠血清AST、FFA效果相當。正常對照組大鼠血清TG與模型組比較,差異有統計學意義(P<0.01),運脾化濁聯合二甲雙胍組比模型組能更有效的改善大鼠TG水平。

表1 各組大鼠血清丙氨酸氨基轉移酶、天門冬氨酸氨基轉移酶、游離脂肪酸、甘油三酯比較
2.3 各組大鼠ChREBP、SREBP-1、LXR及PPARa比較 見表2。模型組大鼠ChREBP水平高于正常對照組、運脾化濁聯合二甲雙胍組、運脾化濁組,差異有統計學意義(均P<0.01)。二甲雙胍組ChREBP水平低于模型組,差異有統計學意義(P<0.05)。模型組大鼠SREBP-1水平高于運脾化濁聯合二甲雙胍組,差異有統計學意義(P<0.05)。運脾化濁聯合二甲雙胍組、二甲雙胍組、運脾化濁組的LSR水平均低于模型組,差異有統計學意義(均P<0.05)。運脾化濁聯合二甲雙胍組的LSR水平低于二甲雙胍組、運脾化濁組,差異有統計學意義(均P<0.05)。與模型組比較,運脾化濁聯合二甲雙胍組、二甲雙胍組、運脾化濁組的PPARa水平均高,差異無統計學意義(P>0.05)。運脾化濁聯合二甲雙胍組的PPARa水平高于二甲雙胍組,差異無統計學意義(P>0.05);運脾化濁聯合二甲雙胍組的PPARa水平低于運脾化濁組,差異無統計學意義(P>0.05)。

表2 各組大鼠血清ChREBP、SREBP-1、LXR、PPARa蛋白表達比較
3 討 論
糖尿病合并脂肪肝是臨床常見代謝性疾病,胰島素抵抗是糖尿病與脂肪肝共同發病機制[13],目前認為脂肪肝發病機制為“二次打擊”。胰島素抵抗引起肝細胞脂質蓄積并誘導機體對內源性損害因子的敏感性增加即為“第一次打擊”;在此基礎上,被活化因子通過氧化應激與脂質過氧化等反應,損傷肝細胞,促進肝臟炎癥反應,導致肝臟細胞壞死或纖維化,即為“二次打擊”[14-15]。因此當前治療本病研究熱點之一即調節糖脂代謝、改善胰島素抵抗。中醫藥能改善胰島素抵抗、抑制脂質過氧化,減少氧化應激,調控“二次打擊”內環境穩態[16]。
運脾化濁方基于“胃熱脾困、痰濁瘀結”病機而立,本方以半夏瀉心湯化裁,半夏、干姜、薤白味辛,開散郁滯而化痰濁;脾主升清、胃主降濁,氣滯則濕阻,濕滯而化熱,熱郁生痰,痰瘀互結,久病陳疴[17],故以黃連、黃芩、郁金、決明子味苦,瀉脾胃、腸道之郁熱;黨參、薏苡仁、甘草味甘,健運脾氣,并能預防苦寒藥物損傷脾胃[18]。張錫純言:“苦以甘藥佐之,化瘀血而不傷新血,開郁氣而不傷正氣,其性尤和平也。”山楂酸甘,善消肉食、油膩之積滯,兼有行氣化瘀之效,調暢氣機而助辛甘諸藥消食化痰,白芍斂陰柔肝[19]。有研究證實,白芍有效成分能抗血栓、降脂、降糖、保肝,改善缺血等[20]。丹參、郁金、川芎、三七四味,活血化痰、行氣斂陰,既能祛除機體產生之瘀,又能預防體內瘀血的產生。全方以辛開、苦降、酸化三法合用,共奏開郁運脾、清瀉郁熱、酸化陰精、化痰活血之功。
本實驗通過建立糖尿病合并脂肪肝大鼠模型,應用運脾化濁顆粒與鹽酸二甲雙胍片進行對照研究。結果表明,二甲雙胍降酶優于運脾化濁顆粒,兩者在降脂及ChREBP方面具有等效性。運脾化濁顆粒與二甲雙胍在降低SREBP-1及LXR方面具有協同作用,而在降低PPARa方面優勢不顯著。

