影響原發性高血壓伴OSAHS患者短期血壓變異性的相關因素分析
王慶民
(濮陽市安陽地區醫院,河南 安陽 455000)
原發性高血壓發病機制尚不明確,該病的發生與遺傳因素、環境因素及精神因素、睡眠障礙有關,大量流行病學調查顯示睡眠呼吸暫停通氣綜合征(Obstructive sleep apnea-hypopnea syndrome,OSAHS)與原發性高血壓有關[1,2]。評估影響原發性高血壓伴OSAHS患者短期血壓變異性的因素有助于改善患者預后。在本研究中,以137例患者為研究對象,探討患者短期血壓變異性改變情況并分析影響其血壓變異性的因素。
1 資料與方法
1.1 一般資料
以2017年3月~2019年5月濮陽市安陽地區醫院137例診斷為原發性高血壓伴OSAHS患者為研究對象,患者均符合原發性高血壓診斷標準,且日間嗜睡(ESS評分≥9 分)等癥狀,查體顯示咽腔狹窄、扁桃體腫大、懸雍垂粗大,查體睡眠呼吸暫停和低通氣指數(AHI)>5次/h者可診斷為OSAHS。按照AHI指數分為輕度組(AHI在5~15/h)、中度組(AHI在15~30/h)、重度組(AHI>30/h)。其中輕度組51例,中度54例,重度32例。
1.2 方法
選用澳大利亞 Compumedics E系列的多導睡眠監測儀,囑咐患者患者患者入組后均進行動態血壓監測,采用美國產Spacelab-90127型血壓監測儀,設定動態血壓15次/min,根據患者不同活動狀態設定4個時間段。睡眠階段(0∶00~5∶00)、早晨階段(7∶00~11∶00)、中午階段(15∶00~18∶00)和傍晚階段(19∶00~22∶00),分析不同時間段的血壓變異性,以收縮壓的CV表示BPV。計算方式如下:CV收縮壓標準差/收縮壓平均值×100%。
1.3 觀察指標
記錄不同時間段的收縮壓及CV值,檢測研究對象的血清ET-1、NO、Hcy水平,應用心臟彩色超聲儀評估LA(左心房直徑)、LV(左心室直徑)及E/A數值,比較高血壓等級。
1.4 統計學方法
采用SPSS22.0版本進行統計學分析,對于多組重復測量計量資料比較可采用F檢驗,高血壓分級為等級資料,采用Ridit分析,并采用Pearson相關性分析因素之間的聯系,以P<0.05表示差異具有統計學意義。
2 結果
2.1 3組血壓監測及血壓變異性分析(見表1)
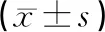
表1 3組血壓監測及血壓變異性分析
2.2 影響血壓變異性相關因素分析(見表2)
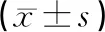
表2 影響血壓變異性相關因素分析
2.3 影響CV的相關性分析
經Pearson相關性分析顯示,ET-1、Hcy、高血壓分級與CV呈負相關,差異均具有統計學意義(r=-0.73、-0.65、-0.78,P<0.05),NO與CV呈正相關,差異均具有統計學意義(r=0.81,P<0.05)。
3 討論
OSAHS亦是臨床中較為常見的一種慢性睡眠疾病,隨著年齡、體重的增長可發生睡眠時上氣道塌陷阻塞,繼而引起呼吸暫停和通氣不足,并伴有鼾聲,因睡眠中長期間斷性低氧、高碳酸血癥,導致血管內皮功能障礙,最終引起血壓升高,同時血壓長期持續升高亦會導致血管內皮損傷,加重OSAHS,呈惡性循環,可影響BPV數值[3]。BPV具有時間依賴性,同一個人在不同時間段的CV值并不一致[4]。本研究中不同嚴重程度OSAHS患者的CV值存在明顯差異,包括睡眠階段、早晨階段、中午階段、傍晚階段,輕度組的CV低于重度組,且睡眠階段、早晨階段中,輕度組CV低于中度組,但血壓在3組里的差異并無統計學意義(P>0.05),從而提示臨床可通過評估CV值判斷患者不同時間段的血壓變化情況更具有代表性。因BPV的升高、降低與交感神經活動、血管內皮功能有關,與OSAHS的發生中扮演一定角色,通過評估高血壓患者不同嚴重程度OSAHS的CV值。在本研究中,3組的ET-1、NO、Hcy及LA、高血壓等級比較,隨著OSAHS病情加重,患者血清的ET-1、Hcy及LA值升高,其中ET-1、NO是血管活性因子,ET-1是血管內較為強烈的一種血管收縮因子,當血管內皮細胞損傷時,大量ET-1進入血液還可引起微血栓,NO則是反應血管內皮細胞結構和功能的重要標志物,Hcy則是一種含硫分子氨基酸,當Hcy水平升高時易被氧化成Hcy化合物,間接損傷血管內皮,并影響高血壓分級,因而中重度OSAHS患者的高血壓等級也較高。
綜上所述,OSAHS引起血壓升高機制可能與氧化應激、缺氧刺激有關,且二者相互影響,加重病情進展,不同病情嚴重程度患者在不同時段的血壓變異性存在較大差異,尤其是夜間睡眠期間,缺氧對血壓波動較大。

