細胞中溶酶體相關的自噬調控
周程,潘光玉,廖洪濤,譚寧
(1.桂林醫學院 a.基礎醫學院免疫學教研室,b.研究生學院,c.生物技術學院,d.科學實驗中心,廣西 桂林 541000;2.廣西全生命周期健康保健研究重點實驗室,廣西 桂林 541000)
溶酶體是自噬、內吞作用降解的場所,被認為是細胞內的“清道夫”。19世紀中期,de Duve在研究胰島素的作用機制時,在細胞內偶然發現包含溶解活性的囊樣結構,隨后被命名為溶酶體[1]。由于溶酶體液泡ATP酶(vacuolar ATPases,V-ATPases)維持溶酶體的酸性環境[2],再加上管腔內大量的水解酶,形成了一個適合分解主要大分子的細胞器,包括糖類、脂質和蛋白質[3]。這些大分子一旦降解,產生的非酯化脂肪酸、單糖和氨基酸就會通過特定的通透酶運輸至細胞質,然后被細胞合成代謝過程重新利用[4]。此外,除溶酶體進行的基礎水平降解過程外,在饑餓和應激過程中,細胞自噬的自我分解代謝途徑也與溶酶體的分解代謝功能密切相關。
隨著研究的進展,新的研究發現細胞自噬的主要調節因子哺乳動物雷帕霉素靶蛋白復合體1(mammalian target of rapamycin complex 1,mTORC1)定位于溶酶體表面[3]。這提示溶酶體不再只是一個執行簡單降解功能的細胞器,也可以作為代謝信號傳遞的平臺,可以檢測并傳遞細胞信號,執行下游應答并產生新的應答傳遞,是一個動態的集成信號平臺。現就溶酶體的基本情況、參與的自噬生物過程、溶酶體與自噬信號AMP活化的蛋白激酶(AMP-activated protein kinase,AMPK)和mTORC1的調控關系以及以溶酶體為靶向的抗腫瘤治療進展予以綜述,以豐富溶酶體信號網絡,為腫瘤治療提供新思路。
1 溶酶體概述
1.1溶酶體的生物發生 溶酶體是存在于真核細胞中的單層囊泡狀細胞器,根據細胞類型溶酶體從不同的降解活性、腔內pH值、降解底物通道、形態等方面形成異質種群。溶酶體主要起源于細胞內的囊泡運輸系統,經細胞內吞作用形成內吞小泡,攝入細胞外大分子物質并運輸至早期內吞體,再通過晚期內吞體進一步形成溶酶體。
在細胞內吞過程中,細胞外和細胞質膜的分子被內化(如網格蛋白介導的內吞作用),在該過程中,富集在質膜亞結構域內的內吞底物通過內陷最終與質膜分離,釋放出一個內吞小泡。內吞小泡含有特定的Rab GTP酶和可溶性N-乙基馬來酰亞胺敏感因子附著蛋白受體復合體(soluble N-ethylmaleimide-sensitive factor attachment protein receptors complex,SNARE)介導其與早期內吞體融合。早期內吞體是一種小泡狀結構的聚集體,其作用是對細胞內待降解的底物進行分類,回收到細胞質膜,或將內吞小泡回收至高爾基體,或輸送至晚期內吞體,最終在溶酶體中降解[5]。Rab5可識別典型的早期內吞體,有助于內吞小泡和其他早期內吞體的系鏈和融合,使早期內吞體成熟為多泡體,然后變成晚期內吞體。其中,Rab5逐漸被同一內吞體上的Rab7a替換,這種替換不僅有助于促進早期內吞體成熟,還可誘導新的功能完整的Rab5陽性早期內吞體形成[6]。當Rab7被激活后,Rab7通過與Rab7相互作用的溶酶體蛋白和微管依賴性動力蛋白結合,并通過與卷曲螺旋結構域蛋白1和運動蛋白結合,從而調節晚期內吞體的定位。晚期內吞體接收來自內質網和高爾基網新合成的溶酶體膜蛋白和水解酶,最終轉變為溶酶體[5]。
1.2溶酶體的生物功能 溶酶體富含多種水解酶,位于膜上的V-ATPases維持內腔pH值<5,因此被稱為細胞的水解中心[2]。溶酶體可以儲存額外的離子和代謝物,包括Ca2+、磷酸鹽、ATP和Zn2+[7],作為細胞消化的主要場所,溶酶體還可通過回收和提供大量有價值的組分(如氨基酸、糖類、脂類和核酸酶)來支持細胞的功能。此外,作為細胞自噬的最終降解場所,溶酶體能夠感知細胞內狀態,包括營養、能量水平以及有害因素,這與mTORC1[8]密切相關。mTORC1通過抑制自噬起始復合物和轉錄因子EB的核移位而被激活,從而啟動促生長過程和抑制自噬,并控制溶酶體和自噬基因的轉錄水平[9]。在饑餓信號的刺激下,mTORC1與溶酶體分離,AMPK被激活,從而誘導自噬[8]。
除細胞代謝功能外,溶酶體在免疫反應[10]和膜修復[11]過程中也發揮重要作用。在免疫過程中,溶酶體能夠檢測到早期感染,并有助于促進免疫反應以抵御新出現病原體的攻擊。在膜修復中,溶酶體可以感應到質膜和內部膜室的損傷,從而啟動膜修復或清除機制。
2 溶酶體與自噬生物過程
2.1溶酶體與自噬底物的降解 細胞自噬是一種高度保守的分解代謝過程,細胞中許多成分的清除均依靠此途徑。根據底物進入溶酶體途徑不同可將自噬分為3類:巨自噬、微自噬和分子伴侶介導的自噬。微自噬是通過溶酶體膜內陷的形成,將小的胞質碎片攝取到溶酶體中;分子伴侶介導的自噬則對含有賴氨酸-苯丙氨酸-谷氨酸-精氨酸-谷氨酰胺樣基序的底物具有高度選擇性[12];巨自噬的特征是形成雙層膜結構的自噬體,然后與溶酶體融合形成自噬溶酶體,能降解和再循環被吞噬的物質[13]。在細胞自噬最后的降解階段,自噬體內膜降解后,溶酶體酶進入自噬底物。60多種溶酶體水解酶[3]協同作用,消化核酸、脂質、細菌等各種被隔離入自噬溶酶體的物質[14]。研究表明,與自噬蛋白無明顯關聯的疾病中,自噬功能受損可導致溶酶體酸化作用削弱,用酸性納米微粒、藥物或哺乳動物雷帕霉素靶蛋白抑制劑處理溶酶體可以恢復自噬通量,表明酶功能正常的重要性[15]。
2.2溶酶體與自噬溶酶體形成 自噬的一個關鍵步驟是自噬體通過與溶酶體融合獲得降解酶。自噬體通過Rab GTP酶、錨定因子和SNARE,經過內溶酶體系統不同階段的多個融合過程,最終形成具有降解功能的自噬溶酶體[16]。其中,Rab7通過其效應因子Pleckstrin同源結構域包含蛋白家族成員1、卷曲螺旋結構域蛋白1、同型融合和蛋白質分選復合體結合微管相關蛋白1輕鏈3,促進溶酶體和自噬體的融合[17]。
自噬體與溶酶體融合是由突觸融合蛋白17(syntaxin 17,STX17)-突觸小體相關蛋白(synaptosomal-associated protein,SNAP)29-囊泡相關膜蛋白(vesicle-associated membrane protein,VAMP)7/VAMP8或STX7-SNAP29-YKT6(YKT6 v-SNARE homolog)之一直接介導[16,18]。在自噬體-溶酶體融合過程中,同型融合和蛋白質分選復合體能夠直接或通過Pacer與溶酶體ADP核糖基化因子樣蛋白8B(ADP-ribosylation factor like protein 8B,Arl8b)和自噬體Qa-SNARE STX17相互作用[15,19]。STX17是哺乳動物中發現的第一個自噬體SNARE。STX17定位于自噬體,VAMP7或VAMP8定位于溶酶體或晚期內吞體,通過招募胞質中含有SNAP29的兩個SNARE結構域,使SNARE蛋白組裝成反式SNARE復合物[20]。當干擾小RNA治療或藥物抑制急性消耗STX17時可抑制自噬通量,而慢性缺乏STX17則無明顯作用[15]。在哺乳動物中,YKT6定位于自噬體,并與SNAP29和Qa-SNARE STX7形成復合物,其作用可能與STX17-SNAP29-VAMP7/VAMP8復合物相同。
2.3溶酶體與自噬溶酶體循環 在長期的自噬過程中,持續的自噬體-溶酶體融合導致大量溶酶體被消耗[21]。除了溶酶體的生物發生外,細胞還通過自噬溶酶體再生(autophagic lysosome reformation,ALR)補充其溶酶體儲存數量,這是一個在長時間饑餓和溶酶體大量消耗的情況下從自噬溶酶體再生溶酶體的過程[22-23]。
ALR開始于mTORC1的重新激活。在長時間的持續自噬過程中,自噬溶酶體內的物質消化釋放出一系列必需的氨基酸和能量,這些氨基酸和能量重新激活mTORC1[24]。在ALR過程中,自噬溶酶體中管狀結構延伸,形成原溶酶體,然后成熟為溶酶體,以實現自噬循環過程[21]。磷酸化紫外線抵抗相關基因激活Ⅲ類磷脂酰肌醇-3-激酶/液泡分選蛋白34在自噬溶酶體上生成磷脂酰肌醇-3-磷酸鹽,其水平可決定小管化率[22]。磷脂酰肌醇-3-磷酸鹽參與spastizin和spatacsin的募集,spastizin和spatacsin是兩種功能未知的蛋白質,但據報道其是自噬溶酶體小管形成所必需[25]。管狀結構的形成首先需要mTORC1通過磷脂酰肌醇-4-磷酸5-激酶1型β在成熟的自噬溶酶體上催化合成磷脂酰肌醇-4,5-二磷酸,后者與網格蛋白、銜接蛋白2形成有助于膜變形的復合物[26]。然后這一出芽結構通過驅動蛋白家族成員5B的募集形成小管,驅動蛋白家族成員5B是一種結合磷脂酰肌醇-4,5-二磷酸的運動蛋白[27]。隨后在磷脂酰肌醇-4-磷酸5-激酶1型α的驅動下,磷脂酰肌醇-4,5-二磷酸在遠端切斷小管,使網格蛋白-動力蛋白復合物釋放原溶酶體[26]。腫瘤壞死因子-α誘導蛋白8樣蛋白2可以通過調節Ras相關的C3肉毒素底物1(Ras-related C3 botulinum toxin substrate 1,RAC1)-mTORC1軸影響自噬溶酶體再生,并推測腫瘤壞死因子-α誘導蛋白8樣蛋白2在ALR過程中可能通過減少磷脂酰肌醇-4,5-二磷酸在脂質雙層上的分布而直接破壞自身溶酶體小管的形成[28]。
3 溶酶體與自噬信號調控
自噬在真核細胞中扮演重要角色,在高等真核生物中,自噬參與多種過程,如細胞死亡、炎癥和免疫代謝等[29-30]。自噬的調節機制復雜,各種信號級聯和調節機制調節自噬活性,但調控自噬的主要信號主要有AMPK和mTORC1。
3.1溶酶體與自噬能量調控信號AMPK AMPK是一種由α催化亞基、調節性β和γ亞基組成的異三聚體蛋白,是細胞能量主要細胞感受器,可監測AMP/ATP的比值,在低能量水平下促進分解過程[31]。一般情況下,ATP結合的AMPK將3個亞基維持在一個非活動池中。但在饑餓、缺氧等應激狀況下,細胞能量不足,導致AMP/ATP的比值升高,高水平的AMP與ATP競爭結合AMPK γ調節亞基,從而釋放α催化亞基,使其作用于許多刺激分解代謝和抑制合成代謝過程的靶點[32]。而基于AMPK的途徑對缺氧和DNA損傷等應激的能量和感應發生在溶酶體表面。較低能量狀態下,軸抑制蛋白(axis inhibition protein,AXIN)在肝激酶基因B1(liver kinase B1,LKB1)、AMPK、Ragulator p18亞基和V-ATPases之間形成復合物,其中V-ATPases促進AXIN-Ragulator相互作用,AMPK β亞基的肉豆蔻酰化有助于AMPK定位于溶酶體膜[33-34]。這一過程最終使LKB1磷酸化AMPK α亞基的Thr172位點,釋放催化亞基,從而起到抑制合成代謝和促進分解代謝的作用[35]。
近年研究發現,AMPK調節中心是由溶酶體的糖酵解副產物和酶調節,糖酵解產物1,6-二磷酸果糖(fructose-1,6-biphosphate,FBP)在低水平的情況下能夠促進AMPK活化和隨后mTORC1的失活[33]。醛縮酶是一種丙酮酸激酶的激活劑,可能是FBP理想的傳感器,同時可作為一個監測器,在細胞能量狀態下降前感知到可用于分解代謝的葡萄糖水平下降,并以一種獨立于AMP/ADP的方式激活AMPK[32]。當醛縮酶與FBP結合時,醛縮酶定位于溶酶體,在溶酶體中與V-ATPases相互作用,破壞AXIN/LKB1與V-ATPases受體復合體的相互作用,從而促進mTORC1活化,抑制自噬。但在低糖條件下,FBP水平下降,醛縮酶與FBP結合減少,促進了AXIN/LKB1-Ragulator-V-ATPases復合物的組裝,該復合物促進AMPK磷酸化,激活自噬,并通過損害Ragulator和Rag GTP酶使mTORC1脫離溶酶體[33]。此外,AMPK也參與調節代謝,以應對其他應激反應。如抑癌蛋白p53能夠誘導Sestrins的表達,進而磷酸化AMPK的α亞基[36]。同時,AMPK還可通過促進去磷酸化和核易位激活轉錄因子EB,且不依賴于mTOR信號[37]。總之,溶酶體通過與AMPK結合促進分解代謝和應對應激反應,整合能量,見圖1。
3.2溶酶體與自噬氨基酸調控信號mTORC1 mTORC1的激活需要兩個主要步驟:首先mTOCRC1通過Rheb GTP酶定位到溶酶體,然后與GTP結合形式的Rheb GTP酶相互作用。Rag GTP酶作為mTORC1在溶酶體上的錨定點受Ragulator調控,Ragulator是由5個亞基[p18、p14、MP1、C7orf 59和乙型肝炎病毒X相互作用蛋白(hepatitis B X-interacting protein,HBXIP)]組成的蛋白質復合物[24]。Ragulator通過p18亞基的N端錨定在溶酶體上,該亞基具有肉豆蔻酰化和棕櫚化位點[38]。然后,p18和MP1-p14亞基將Rag GTP酶拴系在溶酶體上[39]。Rag家族的小GTP酶由兩個特殊的異二聚體對(RagA/RagB、RagC/RagD)組成[40]。當Rag GTP酶被激活時,RagA/RagB是GTP結合形式的,RagC/RagD是GDP結合形式的,而非活性Rag GTP酶具有相反的核苷酸狀態[24]。當特異性氨基酸刺激時,Ragulator作為Rag的鳥嘌呤核苷酸交換因子作用于RagA/RagB,后者表現為GTP結合形式[40]。此時,Rag GTP酶能夠結合和錨定mTORC1至溶酶體表面。
mTORC1定位溶酶體這一步驟還受特異性氨基酸,特別是亮氨酸、精氨酸、谷氨酸和甲硫氨酸的有效性控制[7,31]。溶酶體利用“內-外”機制和胞質機制來感知和響應與調節mTORC1活性機制相關的氨基酸水平。
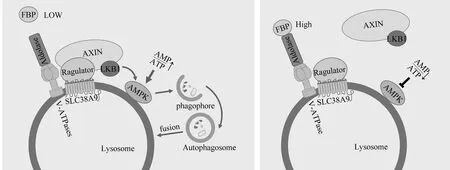
AMPK的激活 AMPK的抑制
內-外信號依賴于腔內氨基酸感應。首先,溶酶體精氨酸結合鈉偶聯氨基酸轉運體溶質載體家族38成員9(solute carrier family 38 member 9,SLC38A9)經過構象變化,使其可能與Ragulator復合物相互作用,從而激活mTORC1[41]。此時,精氨酸的結合允許SLC38A9作為鳥嘌呤核苷酸交換因子與RagA GTP酶相互作用并刺激GTP負載[42]。然后,RagA GTP酶從SLC38A9中釋放出來,與mTORC1結合。研究發現,溶酶體中高水平的精氨酸能刺激SLC38A9將腔內氨基酸如亮氨酸轉運至胞質中[43]。管腔內亮氨酸是溶酶體募集mTORC1的有效激活劑,其在溶酶體管腔內的儲存涉及多種機制。首先,隨著富含營養條件下亮氨酸濃度的增加,卵巢濾泡激素通過損害溶酶體質子協助氨基酸轉運蛋白1使溶酶體內存留的亮氨酸增加;相反,在饑餓條件下,質子協助氨基酸轉運蛋白1可促進溶酶體中亮氨酸的排出[44]。另一方面,胞質中的亮氨酸可以傳遞到溶酶體內并在溶酶體內聚集,其原因是溶酶體膜蛋白溶酶體相關跨膜蛋白4B保留了溶酶體上的亮氨酸轉運體L氨基酸轉運體1-細胞表面抗原4F2重鏈,然后通過遞入亮氨酸來交換非必需氨基酸[45]。高水平的腔內亮氨酸通過V-ATPases促進ATP水解,從而與Ragulator-Rag復合物相互作用并刺激其支持mTORC1招募至溶酶體[45-46]。無論何種機制,最終均通過刺激Ragulator和Rag GTP酶影響mTORC1定位。
細胞液中的精氨酸和亮氨酸也被細胞液中的Rag基因的間隙蛋白活化物1(GAP activity towards Rag 1,GATOR1)-GATOR2復合物所感知和調控,從而調節mTORC1向溶酶體的募集[47-48]。GATOR1復合物被一種新識別的蛋白復合物KICSTOR招募到溶酶體中,然后作為RagA/B GTP酶的GAP,與Ragulator復合物競爭,從而取代溶酶體中的mTORC1[47,49]。在氨基酸存在下,GATOR2復合物與GATOR1結合并損害GATOR1,引起RagA/B上的GTP負載并激活mTORC1,從而抑制自噬[47]。GATOR1-GATOR2輸出之間的平衡取決于多種細胞質蛋白復合物,包括精氨酸和亮氨酸及其他代謝物。首先,亮氨酸與Sestrins(一類高度保守的應激蛋白)結合以調節GATOR2,即高水平的亮氨酸增加了亮氨酸結合Sestrins的比例,從而抑制Sestrins,使其無法阻止GATOR2對GATOR1的損害[7]。相反,胞質亮氨酸水平降低會增加不含亮氨酸的Sestrins數量,這些Sestrins結合并阻斷GATOR2對GATOR1的損害,從而使GATOR1抑制GTP結合的RagA/B。另外,精氨酸能夠結合并阻斷另一種GATOR2抑制劑CASTOR1(cytosolic arginine sensor for mTORC1 subunit 1),因此,在高水平精氨酸下,CASTOR1被精氨酸結合并抑制,釋放GATOR2以損害GATOR1[7]。相反,在精氨酸水平較低的情況下,更多的CASTOR1可以自由阻斷GATOR2,釋放GATOR1來阻斷RagA/B介導的mTORC1的募集,見圖2。
4 以溶酶體為靶向的抗腫瘤治療
分解代謝亢進是腫瘤細胞的主要特征之一,也是腫瘤進展和轉移的主要原因,高合成率保證了腫瘤細胞的快速增殖,這在很大程度上取決于細胞成分的降解和再循環[50]。因此,溶酶體功能及功能障礙在腫瘤的發生發展中起重要作用。腫瘤細胞能夠在饑餓、應激條件下促進自噬,而自噬通過降解損傷的細胞器、異常聚集的蛋白質來產生營養物質及能量。溶酶體作為自噬底物最終的降解場所,代謝過程中的某些產物是腫瘤細胞增殖的物質基礎。針對癌癥中溶酶體的藥物主要有氯喹衍生物、V-ATPases抑制劑、酸性鞘磷脂酶抑制劑、組織蛋白酶抑制劑、熱激蛋白70抑制劑五大類,除羥基氯喹外,大多數藥物仍處于臨床前期實驗研究階段,并在許多臨床試驗中與其他抗癌治療方法相結合進行廣泛的試驗[51]。見表1。
除以上五大類抑制劑外,一種新型溶酶體自噬抑制劑ROC-325也在臨床前期研究中發揮出極大的潛力。ROC-325是一種含有羥基氯喹和硫蒽酮重要結構的二聚體小分子,其抗癌活性和自噬抑制能力均強于羥基氯喹,且能誘導LC3B斑點的形成、自噬體的積累、自噬通量阻斷等自噬抑制的所有標志性特征[59]。青蒿素是治療瘧原蟲引起的瘧疾的一線藥物。然而新的研究表明,青蒿素誘導的活性氧類導致急性髓系白血病溶酶體破裂,釋放的溶酶體酶激活促凋亡蛋白導致細胞死亡,表明青蒿素作為溶酶體靶向治療癌癥的潛在臨床用途[60]。

mTORC1的激活 mTORC1的抑制

表1 以癌癥溶酶體為靶向的治療藥物
目前,溶酶體特異性靶向藥物的數量較少,許多表明靶向溶酶體成分的藥物也被發現能夠與非溶酶體受體相互作用,從而降低了其療效和安全性[61]。如氯喹和羥基氯喹是靶向溶酶體的藥物,其可抑制溶酶體酸化,從而影響溶酶體的整體功能并削弱自噬蛋白的降解,但也對人體產生不可忽略的不良反應[61]。
5 小 結
溶酶體參與自噬過程的終末階段,清除受損物質并提供營養,從而維持細胞內穩態。這一過程需要溶酶體感知細胞內營養水平,協調底物降解和細胞代謝。研究表明,溶酶體是多種信號通路的交匯點,為細胞合成代謝和分解代謝信號提供平臺[7]。溶酶體對AMPK和mTORC1信號的調節影響自噬的進程,深入研究AMPK和mTORC1信號通路有助于豐富溶酶體代謝信號平臺信號分子網絡及明確其機制。腫瘤的發生發展與腫瘤代謝重構密切相關,研究溶酶體對代謝信號的調控,有助于進一步探索溶酶體信號在癌癥發生發展中作用的分子機制,促進靶向溶酶體的抗腫瘤治療及藥物研發。

