維生素D缺乏和基因多態性與自身免疫性甲狀腺疾病相關性研究進展
楊蕓瑞,甄東戶
(1.蘭州大學第一臨床醫學院,蘭州 730000; 2.蘭州大學第一醫院內分泌科,蘭州 730000)
維生素D在本質上屬于類固醇衍生物,其作為一種骨保護因子可以調節鈣磷穩態及骨代謝[1]。具有生物活性功能的1,25-二羥維生素D3[1,25-dihydroxy vitamin D3,1,25-(OH)2D3]通過與維生素D受體(vitamin D receptor,VDR)結合,誘導靶基因表達,而VDR廣泛存在于血管內皮細胞、免疫細胞、內分泌腺體等細胞器官中,其中免疫細胞也能合成與維生素D活化相關的1α-羥化酶,25-羥維生素D[25-hydroxy vitamin D,25-(OH)D]經羥化酶作用轉化為具有生物活性的1,25-(OH)2D,通過自分泌或旁分泌方式發揮其生物學功能,證實維生素D作為一種免疫調節劑參與多種自身免疫性疾病的發生[2]。目前也有研究證實,維生素D缺乏與多種自身免疫性疾病的發生有關,包括類風濕關節炎、系統性紅斑狼瘡、多發性硬化和1型糖尿病等[3]。自身免疫性甲狀腺疾病(autoimmune thyroid disease,AITD)是由于甲狀腺自身抗原暴露、免疫耐受紊亂而導致產生針對甲狀腺組織的自身抗體,通過抗原抗體反應及細胞免疫介導使甲狀腺組織受到破壞,進而引起甲狀腺功能紊亂的器官特異性自身免疫性疾病,其發病機制涉及環境、遺傳等多種因素,臨床常見的類型包括格雷夫斯病(Graves′ disease,GD)和橋本甲狀腺炎(Hashimoto thyroiditis,HT),成人發病率約為5%,且更傾向于女性[4]。目前,有關維生素D缺乏與AITD的關系尚未闡明。研究表明,維生素D缺乏可以導致AITD患病風險明顯升高,補充維生素D可以降低其發病率[5]。此外,VDR基因多態性可能通過基因調控改變VDR的結構與數量,進而影響VDR發揮生物學功能,表明VDR基因多態性與AITD遺傳易感性相關,如GD和HT患者VDR基因多態性等位基因分布頻率有顯著差異,且在不同種族之間也存在差異[6]。現就維生素D缺乏和基因多態性與AITD的相關性研究進展予以綜述。
1 維生素D的合成、代謝及作用
維生素D的主要來源有飲食和體內合成兩個途徑,如皮膚中的7-脫氫膽固醇經紫外線B作用會轉化為維生素D3。維生素D3的主要循環形式是在肝臟內被細胞色素P450家族27亞家族R成員1羥基化,合成25-(OH)D[25-(OH)D2或25-(OH)D3],生物活性較低。在血液中,維生素D需與其結合蛋白(GC基因編碼)結合而被轉運至腎臟,在腎臟由細胞色素P450家族27亞家族B成員1轉化為具有生物活性的代謝產物1,25-(OH)2D3[7-8]。1,25-(OH)2D3主要(85%~90%)與維生素D結合蛋白和白蛋白(10%~15%)結合運輸,僅有極少量以游離形式存在的維生素D發揮重要生理作用[9]。研究表明,維生素D通過與VDR結合而產生生物學效應,VDR是一種胞核受體,屬于類固醇/甲狀腺核受體家族,維生素D結合蛋白和羥化酶對維生素D的活性有重要調控作用[8]。1,25-(OH)2D3與VDR結合后,與類視黃醇X受體發生聚合反應,并與靶基因啟動子區維生素D反應元件結合,誘導或抑制靶基因的表達[10]。此外,維生素D還可通過與免疫細胞VDR結合,維持免疫細胞穩態平衡,從而參與自身免疫性疾病的發生發展。
2 AITD的發病機制
目前,關于AITD的發病機制尚未完全清楚。一般認為,環境因素和個體固有的基因遺傳易感性在AITD的發生發展中起關鍵作用。如病毒、射線、藥物和碘的攝入等外在環境因素通過干擾正常的甲狀腺代謝,或對甲狀腺細胞的直接破壞導致機體免疫調節機制紊亂,其中甲狀腺組織內淋巴細胞浸潤,漿細胞產生針對甲狀腺組織的自身抗體是AITD的特征性表現,可以導致GD的甲狀腺中毒癥狀以及HT的甲狀腺功能減退,說明甲狀腺微環境的改變和各種機制導致的機體免疫耐受降低與AITD的發病有密切聯系,其中T/B淋巴細胞免疫平衡紊亂導致甲狀腺組織細胞破壞起主要作用[11]。
2.1T/B淋巴細胞 T淋巴細胞的主要來源為胎兒肝臟和骨髓前體祖細胞,遷移至胸腺分化成熟。原始T細胞主要分化為CD8+和CD4+T細胞,CD4+T細胞在抗原刺激下分化為輔助性T細胞(helper T cell,Th細胞)和調節性T細胞(regulatory T cell,Treg細胞)等亞型[12]。其中,Th1細胞能夠分泌腫瘤壞死因子-α、γ干擾素、白細胞介素(interleukin,IL)-2等細胞因子,參與細胞免疫應答,介導炎癥和變態反應。Th2細胞主要分泌IL-5、IL-6、IL-10等細胞因子,促進B細胞的分化和抗體的生成,參與體液免疫應答過程[13]。Th1和Th2細胞分化方向受遺傳、抗原、細胞因子、激素、環境污染等多種因素的影響[14]。正常機體針對不同抗原及病原體會選擇相應的細胞免疫或體液免疫應答機制,兩者保持動態平衡,AITD患者由于免疫耐受遭到破壞,Th1或Th2細胞免疫反應亢進,兩者分泌不同細胞因子介導免疫反應,產生針對甲狀腺細胞的自身抗體,甲狀腺組織被破壞導致甲狀腺功能紊亂。見圖1。
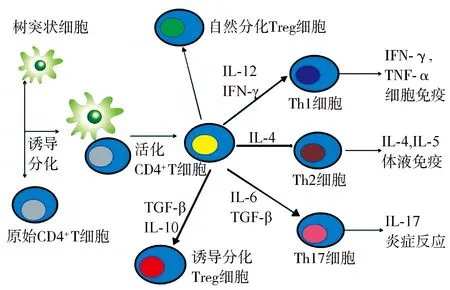
Treg細胞:調節性T細胞;IL:白細胞介素;IFN-γ:γ干擾素;TGF-β:轉化生長因子-β;TNF-α:腫瘤壞死因子-α
2.2AITD與免疫調節 HT的特征性表現為甲狀腺組織淋巴細胞彌漫性浸潤、甲狀腺過氧化物酶抗體(thyroid peroxidase antibody,TPO-Ab)和甲狀腺球蛋白抗體(thyroglobulin antibody,TGAb)產生,其中Th1細胞介導的免疫反應在HT的發病機制中占主導地位[15]。Th細胞功能的增強能夠誘導B細胞分化產生抗甲狀腺細胞抗體,抗體沉積于甲狀腺濾泡基膜,激活補體系統,從而引起細胞壞死。此外,活化的Th1細胞主要分泌IL-1β、IL-12、γ干擾素、腫瘤壞死因子-α等細胞因子,其中腫瘤壞死因子-α能夠誘導IL-1、IL-6細胞因子分泌,兩者與γ干擾素有協同作用,通過激活細胞毒性T細胞和巨噬細胞釋放顆粒酶和穿孔蛋白,而γ干擾素能夠促進甲狀腺濾泡淋巴細胞浸潤,引起甲狀腺組織破壞,導致甲狀腺功能低下[16-18]。有研究發現,Fas/Fas配體(Fas ligand,FasL)及B細胞淋巴瘤/白血病-2(B-cell lymphoma/leukemia-2,Bcl-2)細胞凋亡機制對AITD具有重要的調節作用,Fas/FasL是調控細胞凋亡相關基因表達的一對跨膜蛋白,而Bcl-2通過阻礙由Fas系統誘導的細胞凋亡途徑,從而抑制細胞凋亡[19]。另有研究發現,AITD患者的甲狀腺濾泡細胞及浸潤淋巴細胞均高表達Fas和FasL,其中浸潤淋巴細胞通過分泌細胞因子,誘導促凋亡蛋白Fas/FasL和抗凋亡分子Bcl-2表達失調,從而導致甲狀腺細胞凋亡[20]。
Th2細胞通過分泌細胞因子激活B淋巴細胞產生對促甲狀腺激素(thyroid stimulating hormone,TSH)受體高反應性的促甲狀腺激素受體抗體(thy-rotropin receptor antibody,TRAb),是GD引起甲狀腺功能亢進的主要發病機制。與HT相比,GD的發病機制主要表現為Th2細胞分泌的細胞因子(如IL-4、IL-5、IL-6)水平升高,從而進一步誘導B細胞分化成熟并合成TRAb,這一過程主要通過下調Fas/FasL或上調抗凋亡分子Bcl-2信號通路調節[21]。GD患者由于甲狀腺組織浸潤的Th2淋巴細胞分泌IL-4、IL-5等細胞因子,從而使Bcl-2抗凋亡分子表達增加,進而進一步阻止甲狀腺細胞凋亡[20]。對于GD,Th1/Th2細胞因子分泌水平不是恒定的,因此GD患者甲狀腺功能既可以表現為甲狀腺功能亢進,也可以表現為甲狀腺濾泡破壞導致甲狀腺功能減退。
3 維生素D缺乏和VDR基因多態性與AITD的關系
3.1維生素D通過免疫調節機制對AITD的影響 人體免疫系統的主要細胞均表達VDR,包括樹突狀細胞(dendritic cell,DC)、單核細胞、T/B淋巴細胞等,其主要靶細胞為DC[22]。DC作為免疫反應初始階段的啟動因素,是最強大的抗原呈遞細胞。1,25-(OH)2D3通過與胞內受體VDR結合調控基因表達,參與免疫調節過程,這也是維生素D參與AITD發病機制的細胞分子學基礎。維生素D可以增強先天性免疫反應,同時也可抑制適應性免疫應答體系,這種機制使機體免疫耐受增加,從而減少自身免疫性疾病的發生。Treg細胞在建立及維持機體的免疫耐受、抑制自身免疫性疾病的發生中扮演重要角色,其能夠調節免疫系統的正常運轉。體外研究發現,維生素D通過增強Treg細胞的功能,促進Th2細胞分化成熟,而抑制Th1細胞激活[23]。一方面1,25-(OH)2D3通過抑制B細胞向漿細胞增殖、分化,導致針對甲狀腺細胞的自身抗體分泌受抑,另一方面直接或間接地通過Th細胞途徑促進漿細胞凋亡[24],阻止補體活化介導的甲狀腺細胞死亡。外來抗原刺激DC活化,激活初級免疫應答反應,DC識別自身抗原并誘導T淋巴細胞產生免疫耐受,從而抑制可能損害宿主的自身免疫反應。1,25-(OH)2D3能夠抑制與DC分化成熟相關的細胞因子(IL-12和IL-23)的分泌,促使T細胞向Th2細胞表型分化;同時,1,25-(OH)2D3也可以促進DC介導的Treg細胞分泌IL-10,進而抑制Th1細胞活性,阻止細胞介導的細胞毒性甲狀腺組織破壞[25]。此外,1,25-(OH)2D3還可以通過阻止核因子κB的激活以及與核因子κB的共識序列結合,下調IL-8和IL-12細胞因子的分泌,導致DC的抗原呈遞和激活免疫應答功能減弱,從而使甲狀腺組織T細胞數量及活性下降[26-27]。見圖2。綜上可知,1,25-(OH)2D3通過多個途徑抑制反應性T淋巴細胞對自身抗原的攻擊,抑制異常免疫反應,減少促炎因子產生,調控細胞凋亡保護甲狀腺組織免受破壞。維生素D作為一種免疫調節劑參與調控AITD發病的多個環節,表現為內分泌-免疫系統相互交織的網絡結構,同時維生素D的合成分泌、運轉、VDR結構等多個方面影響其功能,尤其是VDR基因多態性成為學術研究熱點。
3.2VDR基因多態性與AITD的關系 維生素D與靶細胞VDR結合進而調控目的基因的表達,VDR功能異常可以影響維生素D的免疫調節和抗炎功能,與AITD的發病機制密切相關。VDR基因的遺傳變異會導致受體功能異常,已有研究報道VDR基因多態性與AITD的遺傳易感性顯著相關[28]。VDR基因位于第12號常染色體(q13~q14)。其多態性可能通過調節信使RNA的穩定性,從而影響基因的表達[29]。目前關于VDR基因多態性與AITD的研究,主要集中于FokI、TaqI、BsmI和ApaI 4個常見的單核苷酸多態性位點。Inoue等[30]對139例GD患者、116例HT患者和76例甲狀腺功能正常人群(對照組)進行研究發現,HT組VDRFokI多態性的CC基因型和C等位基因分布頻率顯著高于對照組,且與血清維生素D水平較低相關,因此推測VDRFokI多態性與HT易感性相關。同時該研究還發現,CC基因型GD患者的TRAb水平較CA+AA基因型高51%。以上研究提示,C等位基因可以通過調控TRAb的產生與GD的發病有關,提示VDR基因的遺傳差異可能參與了AITD的發生發展。另一項研究發現,與不攜帶B等位基因的患者相比,攜帶VDR B等位基因的患者VDR信使RNA水平明顯降低[31]。此外一項關于塞爾維亞人群的研究發現,FokI多態性與HT高發病風險顯著相關[32]。FokI多態性C等位基因與細胞因子IL-12的產生有關,IL-12可以誘導激活Th1細胞,通過細胞毒性T淋巴細胞和Th1細胞的相互作用,引起甲狀腺細胞被破壞[32-33]。一項Meta分析發現,BsmI和TaqI多態性與降低AITD發病風險顯著相關,而ApaI和FokI多態性與AITD發病風險無明顯相關性[34],這可能與VDR基因多態性影響維生素D代謝水平相關。一項薈萃分析發現,TaqI和FokI多態性僅與降低HT風險有關;基于種族的分層分析中,TaqI多態性在亞洲和非洲人群中與降低AITD風險相關,而在歐洲人群中無此相關性,FokI多態性僅在亞洲人群中與降低AITD風險相關[35]。值得注意的是,BsmI多態性與歐洲和非洲人群的AITD風險降低有關,而與亞洲人群的AITD風險增加有關,提示VDR基因多態性在種族、地域方面也存在差異。研究發現,漢族人群中APaI的A等位基因與中國漢族人群的GD有相關性[36]。可見,VDR基因多態性是AITD遺傳易感性的重要因素之一,且GD和HT患者VDR基因多態性等位基因的頻率分布有顯著差異。目前關于VDR基因多態性與AITD發病遺傳易感性的相關研究仍存在爭議,但能肯定的是VDR基因多態性可以增加AITD的遺傳易感性,這為AITD發病與基因遺傳標記提供了更多檢測手段,未來需要更多的循證醫學證據解釋兩者相關性。
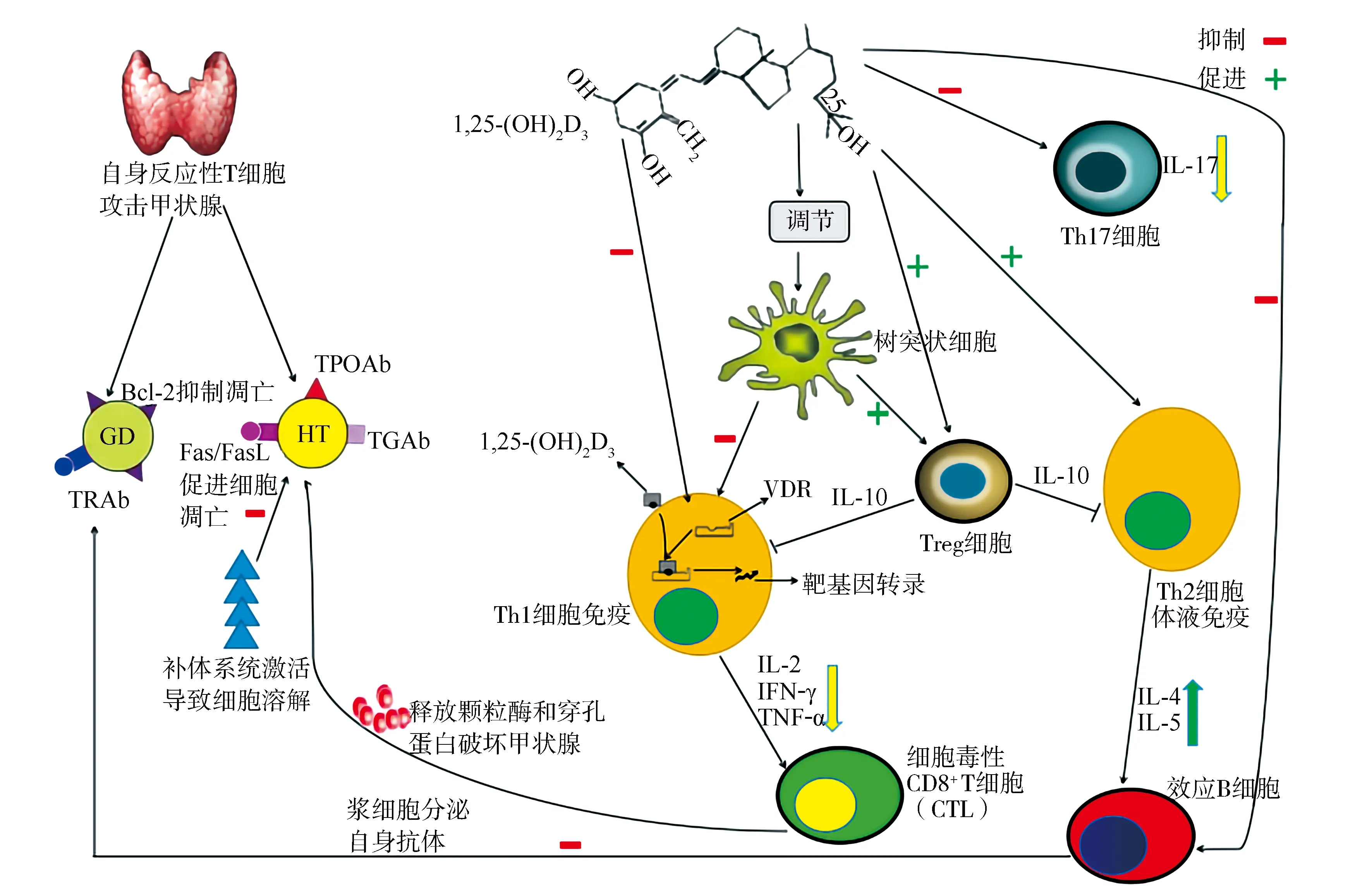
Bcl-2:B細胞淋巴瘤/白血病-2;TPOAb:甲狀腺過氧化物酶抗體;GD:格雷夫斯病;HT:橋本甲狀腺炎;TGAb:甲狀腺球蛋白抗體;TRAb:促甲狀腺激素受體抗體;FasL:Fas配體;1,25-(OH)2D3:1,25-二羥維生素D3;Th:輔助性T細胞;VDR:維生素D受體;IL:白細胞介素;IFN-γ:γ干擾素;TNF-α:腫瘤壞死因子-α;Treg細胞:調節性T細胞;CTL:細胞毒性T淋巴細胞;AITD:自身免疫性甲狀腺疾病
3.3維生素D缺乏與AITD的關系 目前,關于健康人群血清維生素D的最佳水平與多種因素有關尚未達成共識,維生素D缺乏的界值及分級水平尚無統一標準。血清25-(OH)D水平是評價維生素D是否缺乏的主要診斷依據,目前專家建議的判斷標準為血清25-(OH)D<50 nmol/L為缺乏,50~75 nmol/L為不足,75~250 nmol/L為正常[37]。Treg細胞具有可以調控機體外周免疫耐受、抑制炎癥因子分泌等重要生理功能,而體內1,25-(OH)2D3缺乏可以引起Treg細胞數量減少,免疫調節功能缺陷,兩者相互作用共同維持機體免疫系統正常運轉[38]。一項Meta分析表明,AITD患者的血清25-(OH)D水平較健康對照者明顯降低,且血清25-(OH)D缺乏的患者AITD的患病率較對照者升高約3倍,提示維生素D缺乏可能在AITD的病理過程中發揮重要作用;此外亞組分析顯示,與對照者相比,GD和HT患者合并25-(OH)D缺乏的風險分別升高約3.5倍和4倍,提示血清25-(OH)D水平較低與AITD發病相關[39]。
維生素D缺乏與AITD的高風險患病率之間是否存在因果關系,目前尚無定論。一項隨機對照試驗發現,與健康對照組相比,甲狀腺功能異常組患者的維生素D缺乏比例明顯升高,尤其是AITD患者,相對于GD患者,這一現象在HT患者中表現更為突出[40]。在AITD患者中,與維生素D>10 ng/mL患者相比,維生素D缺乏患者甲狀腺功能異常比例明顯升高;此外,維生素D缺乏患者體內普遍存在抗甲狀腺抗體,提示維生素D缺乏與抗甲狀腺抗體的存在和甲狀腺功能異常有關[40]。Ma等[41]的一項橫斷面病例對照研究發現,AITD患者的血清25-(OH)D水平低于非AITD對照者,且血清25-(OH)D水平每降低5 nmol/L,GD、HT發病風險分別升高1.55、1.62倍。該研究共納入168例老年受試者,其中維生素D缺乏人數約占70%,與正常25-(OH)D[25-(OH)D≥20 ng/mL]水平組相比,維生素D缺乏[25-(OH)D<20 ng/mL]組AITD的患病率明顯升高。此外,AITD患者25-(OH)D水平與游離三碘甲腺原氨酸和TPO-Ab水平顯著相關,尤其是25-(OH)D缺乏患者游離三碘甲腺原氨酸和TPO-Ab水平明顯升高,而與TGAb、游離甲狀腺素和TSH無相關性,表明維生素D水平一定程度上可以反映自身免疫性疾病的嚴重程度以及由此導致的甲狀腺功能減退[42]。一項關于補充維生素D對AITD影響的研究表明,維生素D替代治療后甲狀腺抗體滴度顯著降低,但甲狀腺功能與維生素D水平無明顯相關性,維生素D缺乏可能是TGAb和TPO-Ab陽性的潛在危險因素[43]。以上研究結果表明,維生素D缺乏是AITD患病的高風險因素,但維生素D水平與甲狀腺功能和甲狀腺抗體水平的相關性仍存在爭議,兩者之間的因果關系需進一步研究闡明。
4 小 結
維生素D的缺乏與AITD發生發展有重要聯系,但發病機制尚不完全清楚。一方面維生素D與免疫細胞VDR結合能夠發揮免疫調節作用,抑制自身免疫反應;另一方面,VDR基因多態性與AITD的遺傳易感性相關,這些基因多態性變化可能影響相關基因表達、RNA轉錄效率或蛋白質結構,提示維生素D在AITD的發展過程中扮演重要角色。未來,為進一步研究維生素D與AITD之間的相互關系和作用機制,以及補充維生素D是否可作為AITD的一種可行性治療手段,補充維生素D對AITD患者治療的預后及療效評估,需進行長期的追蹤研究以及高質量的循證醫學證據和更廣泛的前瞻性研究。

