五種琥珀酸脫氫酶抑制劑類殺菌劑與灰葡萄孢琥珀酸脫氫酶的結合模式及抗性機制分析
陶麗紅, 李佳俊, 夏美榮, 李 康, 范黎明,蘇發武, 吳文偉, 王凱博*,, 葉 敏*,
(1. 云南農業大學 云南生物資源保護與利用國家重點實驗室,昆明 650201;2. 云南省農業科學院 農業環境資源研究所,昆明 650201)
琥珀酸脫氫酶抑制劑 (succinate dehydrogenase inhibitor, SDHI) 類殺菌劑是殺菌劑抗性行動委員會 (FRAC) 2009 年劃分出來的一類作用機制和抗性機理相似的化合物[1]。該類殺菌劑通過抑制病原菌線粒體呼吸作用過程三羧酸循環中的琥珀酸脫氫酶 (succinate dehydrogenase, SDH)來阻礙能量代謝、抑制病原菌生長并導致其死亡,最終達到防治病害的目的[2]。現已成功開發的SDHI 類殺菌劑從化學結構上可分為11 類、包括23 個品種,主要用于防治大田作物、果蔬、花卉等的灰霉、赤霉、菌核、葉斑等多種病害[3]。例如:啶酰菌胺(boscalid) 是目前使用范圍最廣、用量最大的SDHI 品種,主要防治由子囊菌和半知菌引起的灰霉、白粉、菌核等病害[4];噻呋酰胺 (thifluzamide)具有良好的內吸傳導性,主要用于防治由擔子菌引起的病害,特別是對由立枯絲核菌Rhizoctonia solani引起的水稻紋枯病具有顯著的防治效果[5]。但由于SDHI 類殺菌劑作用靶點單一,其抗性問題日益凸顯,甚至出現了多重抗性[6-8]。據報道,瓜果產區灰葡萄孢Botrytis cinerea對啶酰菌胺和吡噻菌胺 (penthiopyrad) 的抗性頻率高達90%以上[9-10]。目前,FRAC 將該類殺菌劑劃歸為中等至高抗性風險。
目前對SDHI 類殺菌劑抗性問題的研究主要從分子生物學層面出發。基因測序表明,灰葡萄孢對啶酰菌胺、異丙噻菌胺 (isofetamid)、氟吡菌酰胺 (fluopyram)、氟唑菌酰胺 (fluxapyroxad)和吡噻菌胺產生抗性是由于其琥珀酸脫氫酶鐵硫蛋白亞基 (Ip, sdhB) B-H272Y、B-H272R、B-H272L、B-P225F、B-P225L、B-P225T和B-N230I 等位基因發生了點突變[7,9-12],西瓜蔓枯病菌Didymella bryoniae對啶酰菌胺和氟吡菌酰胺產生抗性,也是由于B-H272R和B-H272Y 基因發生了突變[6];而小麥赤霉病的病原菌禾谷鐮刀菌Fusarium graminearum對氟唑菌酰羥胺 (pydiflumetofen) 產生抗性,則是由于細胞色素結合蛋白亞基 (sdhC) C-R86H、CR86C 和C-A83V 發生了基因突變[13]。然而,現有研究多采用分子生物學手段分析菌株的SDH 抗藥性突變位點,對SDHI 與SDH 結合模式研究的較少。殺菌劑與靶標蛋白的親和力、及結合特異性很大程度上能夠反映靶標生物對藥劑的敏感性[14],研究殺菌劑與作用靶標之間的結合模式,不僅能揭示殺菌劑的殺菌原理、抗性產生的機理,而且能夠指導高效殺菌劑新穎結構的合理設計及改造,從而減少殺菌劑的使用、確保作物高產優質、減少環境污染[15-18]。
隨著計算機科學的發展,使用同源建模預測未知蛋白質結構的技術越來越成熟,分子對接在藥物與靶標蛋白結合模式研究中也被廣泛應用[19-20]。同類蛋白結構之間普遍具有一定同源性,氨基酸序列同源度大于30%即可使用同源建模方法獲取未知蛋白的三維結構[21]。雖然目前植物病原真菌SDH 的三維結構尚未被鑒定,但鳥的SDH 與萎銹靈 (carboxin) 的復合晶體結構2FBW、鳥的SDH與草酰乙酸的復合晶體結構1YQ3 以及豬心SDH與苯甲酰胺的復合晶體結構4YTP 都已被測定,且琥珀酸脫氫酶黃素蛋白 (Fp,sdhA) 和sdhB 在不同物種間高度保守[22]。因此,可通過同源建模的方法構建植物病原菌的SDH 結構。
本研究擬以灰葡萄孢為模式病原微生物,通過同源建模方法構建其SDH 的三維模型,并通過分子對接分析SDHI 類殺菌劑與BcSDH 的結合模式。同時根據已報道的氨基酸殘基突變位點構建BcSDH 突變模型,并分析BcSDH 突變前后與SDHI類殺菌劑的親和力及結合模式的變化,探究氨基酸殘基突變引起的SDHI 類殺菌劑抗藥性產生的機制以及SDHI 類殺菌劑之間的交互抗性機制,另外,對已報道的突變最多的sdhB 進行保守性預測,分析其突變類型。旨在為研究灰葡萄孢對SDHI類殺菌劑抗藥性機制提供理論支撐,并為新結構SDHI 類殺菌劑分子的合理設計提供理論指導。
1 材料與方法
1.1 計算機軟件及在線工具
1.1.1 軟件 分子對接軟件:AutoDock Vina-1.1.2。
突變體構建軟件:UCSF Chimera-1.11.2。
圖形操作化軟件:PyMol-2.1.0 Open-Source。
1.1.2 網站和工具 蛋白序列數據庫:NCBI (https://www.ncbi.nlm.nih.gov/)。
蛋白結構數據庫:RCSB PDB (https://www.rcsb.org/)。
同源建模工具:SWISS-MODEL (https://swissmodel.expasy.org/)。
模型評價工具:SAVES v6.0 (https://servicesn.mbi.ucla.edu/SAVES/)。
結合模式分析工具:PLIP (https://projects.biotec.tu-dresden.de/plip-web/plip)。
保守性分析工具:MEME (https://meme-suite.org/meme/)。
1.2 試驗方法
1.2.1 同源建模與模型評價 從NCBI 網站獲取灰葡萄孢的SDH 蛋白序列信息,選定同株菌的4 個亞基分別為sdhA (GenBank: ALJ75671.1)、sdhB (GenBank: ALK82288.1)、sdhC (GenBank:ALJ75678.1)和sdhD (GenBank: ALJ75685.1),用BLAST 工具檢索同源度最高、模型最合理的蛋白。在RCSB PDB 蛋白結構數據庫檢索并下載最優蛋白的3D 模型,將4 個亞基氨基酸序列作為一個整體,以最優蛋白模型為模板,用SWISS 在線建模工具同源構建BcSDH 的3D 模型。然后將建好的模型在線提交SAVES 服務器,利用PROCHECK工具對所建模型進行評價,評價結果以Ramachandran Plot 展現,根據最優區域、合理區域、可接受區域和不合理區域的百分比評價所建模型的合理性[23]。
1.2.2 殺菌劑與蛋白結合的活性口袋分析 根據已知的2 F B W 蛋白晶體結構中配體萎銹靈(carboxin, SDHI 類殺菌劑) 周圍5 ? (1 ? = 0.1 nm)內的氨基酸殘基B-P169、B-S170、B-W172、BW173、B-H216、B-I218、C-I27、C-W32、CM36、C-S39、C-I40、C-R43、D-D57 和D-Y58 的活性口袋初步推測BcSDH 的活性口袋由B-P225、B-S226、B-W228、B-W229、B-H272、B-I274、C-L72、C-P77、C-W81、C-S84、C-G85、C-R88、D-D143 和D-Y144 氨基酸殘基構成,結合最優蛋白模型使用AutoDockTools 工具調校分子對接參數[24],得到活性口袋的位置和參數分別為center_x = 14.576,center_y = 16.048,center_z = 8.299;size_x = 1 6.862,size_y = 14.419,size_z = 16.357;exhaustiveness = 8, num_modes = 9,energy_range = 3。
1.2.3 分子對接及結合模式分析 分子對接在HP-PC 上運行,處理器為Intel Core i5-1035G1 CPU 3.6GHz。對接步驟為:先構建化合物庫,在PubChem 下載異丙噻菌胺、氟吡菌酰胺、氟唑菌酰胺、吡噻菌胺和啶酰菌胺這5 種SDHI 類殺菌劑的三維結構,保存為sdf 格式,然后采用Open Babel 工具轉換為pdbqt 格式[25]。使用AutoDock-Tools 軟件對同源構建的BcSDH 蛋白進行去水、加氫、刪除不合理的雜原子及能量最小化等結構優化,根據1.2.2 節中優化的對接參數將SDHI 類殺菌劑與同源構建的BcSDH 進行對接[26],保留9 個對接構象,根據對接親和力打分排序,生成最優配體受體復合物。再將復合物上傳至PLIP 網站分析殺菌劑與BcSDH 之間的結合模式[27],使用PyMol軟件進行可視化處理。
根據文獻報道的突變位點[7,9-12],利用UCSF Chimera 工具[28]將灰葡萄孢sdhB 的B-H272 (組氨酸,His,H) 分別突變為亮氨酸 (Leu,L)、精氨酸(Arg,R) 和酪氨酸 (Tyr,Y),將B-P225 (脯氨酸,Pro,P) 分別突變為苯丙氨酸 (Phe,F)、亮氨酸和蘇氨酸 (Thr,T);構建B-H272L、BH272R、B-H272Y、B-P225F、B-P225L 及BP225T 突變體,依舊使用1.2.2 節的對接參數和1.2.3 節的方法進行分子對接和結合模式分析,比較靶標突變前后受體與配體之間的親和力及結合模式變化。
1.2.4 基因序列保守性分析 在NCBI 中使用BLAST 工具查詢BcSDH 易發生突變的sdhB 相關同源蛋白,得到100 條與灰葡萄孢sdhB 同源的蛋白氨基酸序列,將這100 條sdhB 氨基酸序列對齊后上傳至MEME[29]在線工具進行保守性分析,獲得Motif 圖。
2 結果與分析
2.1 同源建模構建的BcSDH 模型及評價
灰葡萄孢琥珀酸脫氫酶BcSDH 與2FBW 蛋白序列比對結果如圖1 所示,sdhA 和sdhB 高度保守,與2FBW 的同源度分別為72.39 %和72.22 %;兩種嵌膜蛋白sdhC 和sdhD 與2FBW 的同源度分別達37.60 % 和30.30 %,4 個亞基蛋白序列與2FBW 的整體同源度為64.54 %,符合建模標準。對構建的3D 蛋白模型進行PROCHECK 評價結果如圖2 Ramachandran Plot 所示,共有1 063 個N-Gly和N-Pro 氨基酸殘基參與建模,其中:826 個分布在最優區域,占總數的90.17 %;83 個分布在合理區,占總數的9.06 %;6 個分布在可接受區域;占總數的0.66 %;1 個分布在不合理區域,占總數的0.11 %。總體99.89 %氨基酸在蛋白晶體結構中的位置符合要求,說明同源構建的BcSDH 蛋白3D 結構模型合理,同時符合立體化學phi、psi二面角分布,具有良好的穩定性和立體化學性。
如圖3 所示,將同源構建的BcSDH 與模板蛋白2FBW 進行疊合,二者的均方根差RMSD 值為0.099,說明所建模型與模板蛋白在結構水平上具有很高的相似度。
2.2 SDHI 與BcSDH 的結合模式分析
5 種殺菌劑與BcSDH 分子對接后選擇最優構象周圍5 ?以內的氨基酸,確定活性口袋由B、C、D 亞基共同構成 (表1),參與形成口袋的氨基酸分別為sdhB 的P225、S226、W228、W229、R270、H272、I274,sdhC 的L72、W81、I82、S84、G85、L86、N87、R88、I89、C92、H153 和sdhD 的R98、G136、S139、C140、D143、Y144。參與形成疏水作用的氨基酸分別為sdhB的P225、W229、H272、I274 和sdhC 的L72、W81、I82、L86、R88、I89;參與形成氫鍵的氨基酸為sdhB 的W229,sdhC 的W81、N87、R88和sdhD 的Y144;參與形成鹵鍵的氨基酸分別為sdhC 的G85 和sdhD 的D143;參與形成π-π 堆積作用的氨基酸為 sdhC 的W81;參與形成π-陽離子相互作用的氨基酸為sdhC 的R88。初步推斷這些相互作用力能夠將殺菌劑牢固地結合在BcSDH蛋白大分子中,在發揮藥效方面起著至關重要的作用。sdhB 的S226、W228、R270,sdhC 的S84、C92 和sdhD 的R98、G136、S139、C140 雖然在活性口袋內,卻不參與形成相互作用力,表明這些氨基酸可能對殺菌劑發揮藥效的貢獻不大。值得注意的是,文獻報道的BcSDH 抗性突變位點有P225、N230 和H272[7,9,11],由分子對接和結合模式分析可知,P225 和H272 在活性口袋內參與形成相互作用力,這兩個氨基酸發生突變可能對殺菌劑與BcSDH 蛋白大分子的親和力和結合模式造成影響;而N230 既不在活性口袋內,也不參與形成相互作用力,推測該氨基酸發生突變與否對親和力和結合模式影響不大,該氨基酸突變可能不直接影響灰葡萄孢對SDHI 類殺菌劑的敏感性。

表1 SDHI 類殺菌劑與BcSDH 分子對接及結合模式分析Table 1 Molecular docking and binding modes analysis of SDHI fungicides with BcSDH
2.3 主要抗性突變位點分析
由表2 數據看出,異丙噻菌胺、氟吡菌酰胺、氟唑菌酰胺、吡噻菌胺和啶酰菌胺與野生型BcSDH 的親和力分別為 ?30.514、?37.620、?35.112、?31.350和 ?33.440 kJ/mol。整體而言,靶標突變對氟吡菌酰胺和吡噻菌胺與BcSDH 的親和力影響最大,對異丙噻菌胺的影響次之,對氟唑菌酰胺和啶酰菌胺的影響最小。P225F 和H272R 突變后,5 種殺菌劑與BcSDH 的親和力明顯下降;P225L 突變,造成異丙噻菌胺、氟吡菌酰胺和吡噻菌胺3 種殺菌劑與靶標蛋白的親和力下降;P225T、H272L 和H272Y 突變,只造成少數幾種殺菌劑與靶標蛋白的親和力下降;也有個別殺菌劑與靶標蛋白的親和力未下降反而略微上升。綜上所述:P225F 和H272R突變可能是灰葡萄孢對SDHI 類殺菌劑產生抗性的主要突變類型;P225L 突變可能與灰葡萄孢對部分SDHI 類殺菌劑的抗性相關;P225T、H272L 和H272Y 突變可能不是灰葡萄孢對SDHI類殺菌劑產生抗藥性的主要原因。因此,需進一步研究P225F、P225L和H272R 氨基酸殘基突變后殺菌劑與靶標蛋白的結合模式,才能進行初步的抗性機制分析。
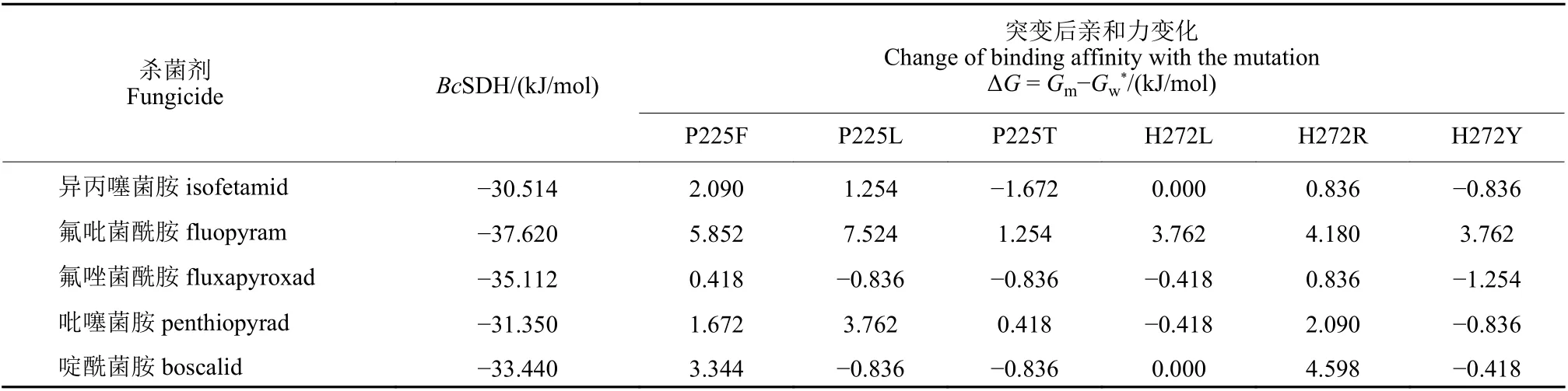
表2 殺菌劑與野生型和突變型的BcSDH 的對接親和力Table 2 Binding affinity between SDHI fungicides and wild-type or mutant-type BcSDH
2.4 BcSDH 突變的抗性機制分析
2.4.1 5 種殺菌劑與野生型和突變型BcSDH 的結合模式 由圖4 可以看出:BcSDH 的B-P225F、B-P225L 和B-H272R 氨基酸殘基突變后,異丙噻菌胺與突變型BcSDH 的結合模式和形成相互作用力的氨基酸均發生了變化。B-P225F 突變后,異丙噻菌胺不能進入活性口袋,形成的疏水作用、氫鍵、π-π 堆積作用和π-陽離子相互作用明顯減少,親和力下降 (表2),不與B-H272、B-I274、C-L72、C-I82、C-L86 和C-R88 形成氫鍵、疏水作用和π-陽離子相互作用,反而與B-F225 和DY 1 4 4 形成了疏水作用和π-π 堆積作用。BP225L 突變后,異丙噻菌胺胺部分裸露在活性腔外,不參與形成作用力,與酸部分形成相互作用力的氨基酸也發生了變化,能與B-L225 和DY144 形成疏水作用,不與C-L72、C-I82 和CL86 形成疏水作用。B-H272R 突變后,異丙噻菌胺胺部分構象變化較大,與灰葡萄孢sdhC 形成的相互作用力減少,異丙噻菌胺的噻吩環仍能與BL272 和B-I274形成疏水作用。
氟吡菌酰胺與野生型和突變型BcSDH 的結合模式如圖5 所示:氟吡菌酰胺的酰胺鍵主要與野生型BcSDH 形成氫鍵,氨基側吡啶環主要與P225和H272 形成疏水作用。B-P225F、B-P225L 和B-H272R 突變。在很大程度上改變了氟吡菌酰胺與靶標蛋白的結合模式,氟吡菌酰胺未能或只有部分進入活性腔,羰基側苯環主要參與疏水作用的形成,氨基側吡啶環則主要參與形成π-π 堆積作用或π-陽離子相互作用。B-P225F 突變后,氟吡菌酰胺與該突變蛋白的氨基酸殘基形成的相互作用力也發生了很大變化,酰胺鍵不再與CR88 形成氫鍵,吡啶環不再與B-P225 形成疏水作用;P225L 突變后氟吡菌酰胺苯環和吡啶環旋轉得基本與酰胺鍵平行,整個分子幾乎在一個平面上,形成的氫鍵和疏水作用也在減少;H272R 突變后氟吡菌酰胺酸和胺部分形成的相互作用力剛好與野生型BcSDH 的相反,酸部分主要參與形成疏水作用,胺部分吡啶環橫在活性腔口,與B-W229和D-Y144 能夠形成氫鍵。
由圖6 可以看出,氟唑菌酰胺的酰胺鍵也主要是與野生型BcSDH 形成氫鍵、聯苯環主要參與形成疏水作用、酸和胺末端的氟主要參與形成鹵鍵。B-P225F 突變很大程度上改變了氟唑菌酰胺與靶標蛋白的結合模式及構象,使結合位點整體向外移,吡唑環上的-CF3旋轉得與酰胺鍵平行,只有聯苯環參與形成極少的疏水作用,表明BP225F 氨基酸殘基突變存在極高的抗藥性風險。B-P225L 突變幾乎不改變氟唑菌酰胺與突變型BcSDH 的結合模式,除了D-D143 不再形成鹵鍵外,形成相互作用的氨基酸反而增多了,能夠與B-L225 形成疏水作用、與B-S226 形成鹵鍵。BH272R 突變使吡唑環略微發生了旋轉,羰基O 不再與C-W81 形成氫鍵、吡唑環氟不與D-D143 形成鹵鍵,聯苯環與B-P225 形成疏水作用。
吡噻菌胺與BcSDH 的結合模式如圖7 所示:與前3 種殺菌劑的結合模式相似,酰胺鍵也主要是參與形成氫鍵,雜環和碳鏈主要參與形成疏水作用,吡咯環末端氟參與形成鹵鍵。P225F 氨基酸殘基突變后,吡噻菌胺構象發生了折疊,使之卡在活性腔外,只有末端碳鏈與B-F225 和DY144 形成疏水作用。P225L 突變使得吡噻菌胺的噻吩環垂直于酰胺鍵,酰胺鍵、吡咯環、噻吩環和碳鏈均參與形成相互作用力,只是與之形成作用力的氨基酸殘基發生了一定變化。H272R 突變對吡噻菌胺的構象影響不大,但與C-W81 形成的疏水作用減少,不與B-I274、C-I89 形成疏水作用,這很可能降低吡噻菌胺在作用靶標中的穩定性。
啶酰菌胺與野生型和突變型BcSDH 的結合模式如圖8 所示,B-P225F 突變使啶酰菌胺在活性腔外構象發生了翻轉,導致結合位點和形成作用力的氨基酸殘基發生了改變,吡啶環能與C-W81形成氫鍵、與B-F225 形成π-π 堆積作用。B-P225L突變使啶酰菌胺位置略微發生了偏移,能夠與BL225 形成疏水作用、與C-R88 形成π-陽離子相互作用。B-H272R 突變使羧酸部分發生了旋轉,吡啶環與酰胺鍵幾乎在一個平面上,參與形成相互作用力的氨基酸殘基和形成的作用力都增加了,能與B-P225、B-W228、B-R272、B-I274 形成疏水作用,與C-R88 形成π-陽離子相互作用,與BW229、C-W81 形成π-π 堆積作用,只是鍵長大于5 ?;不再與C-I89、D-Y144 形成疏水作用和氫鍵,推測B-H272R 突變對啶酰菌胺與靶標蛋白的結合模式影響極大。
2.4.2BcSDH 突變的抗性機制分析 5 種殺菌劑在BcSDH 活性口袋的位置和構象如圖9 所示:以酰胺鍵為中心,殺菌劑的酸部分能夠插入野生型BcSDH 活性腔底、胺部分在活性腔口。B-P225F突變后,活性腔口變窄,殺菌劑酸部分不能進入活性腔,異丙噻菌胺則整個橫在腔口;B-P225L突變后,氟唑菌酰胺和啶酰菌胺仍能進入活性腔,亮氨酸突變為脯氨酸對這兩種殺菌劑與靶標蛋白的結合模式影響不大,但使異丙噻菌胺、氟吡菌酰胺和吡噻菌胺與靶標蛋白的結合模式發生了改變;B-H272R 突變后,精氨酸側鏈所占空間比組氨酸稍大,使得活性腔底變窄,進而使其與靶標蛋白的結合模式發生變化。因此,B-P225F 和B-H272R 突變在很大程度上改變著殺菌劑與靶標蛋白的結合模式,這兩個點突變可能是引起BcSDH對5 種殺菌劑產生抗性的主要原因,也可能是引起SDHI 類殺菌劑之間交互抗性的原因之一;BP225L 突變可能降低BcSDH 對異丙噻菌胺、氟吡菌酰胺和吡噻菌胺的敏感性,但該突變可能不是引起BcSDH 對SDHI 類殺菌劑產生抗性的主要原因,也不是引起SDHI 類殺菌劑之間交互抗性的主要原因。
2.5 灰葡萄孢sdhB 的保守性分析
由MEME 工具分析得到Motif 圖 (圖10),通過對比與灰葡萄孢sdhB 同源的100 條氨基酸序列,發現B-P225、B-S226、B-W228、B-W229、B-R270、B-H272 和B-I274 均位于保守區域。但本研究分子對接和結合模式分析表明:B-P225F、B-P225L 和B-H272R 氨基酸殘基突變會引起BcSDH 與SDHI 類殺菌劑的親和力下降、結合模式發生改變,說明保守序列并非不發生突變序列,在自然選擇壓下這種突變可能是隨機發生的,B-P225F、B-P225L 和B-H272R 氨基酸殘基突變可能為隨機突變。
3 討論
計算機模擬分子對接能快速準確地瞄準藥物與靶標間的相互作用[20,30]。本研究表明,SDHI 類殺菌劑與BcSDH 通過形成疏水作用、氫鍵、鹵鍵、π-π 堆積作用和π-陽離子相互作用而發揮藥效,所形成的化學鍵鍵長較短,一般為2~4 ?。其中酰胺鍵是SDHI 類殺菌劑的靈魂部分,大部分疏水作用和氫鍵的形成都有酰胺鍵的參與;羧酸和胺部分的咪唑、吡唑、吡啶等雜環也起著至關重要的作用,能夠與BcSDH 氨基酸殘基形成牢固的氫鍵、π-π 堆積作用、π-陽離子相互作用;苯環、聯苯環和碳鏈則大部分參與疏水作用、π-π 堆積作用和π-陽離子相互作用的形成;氟、氯等鹵素一般是參與形成鹵鍵來增加親脂性。對該類殺菌劑進行結構修飾與改造時酰胺鍵不可替代,胺部分可引入苯環、聯苯環、雜環或碳鏈來增加穩定性,酸部分則可引入雜環、鹵素及其他活性基團來增加親脂性[31]。SDHI 類殺菌劑與BcSDH 通過形成上述幾種分子間的相互作用力,使得配體與受體間形成穩固的連接,這與Zhu 等[32]的報道一致,但不同的研究者報道的參與形成作用力的氨基酸各有差異。本研究通過結合模式分析顯示,氟吡菌酰胺和氟唑菌酰胺能夠與B-W229、BH272、B-P225、B-I274、C-L72、C-W81 和C-R88形成疏水作用,與C-W81、C-N87、C-R88 和DY144 形成氫鍵,與C-G85 和D-143 形成鹵鍵,與Gao[14]報道的氟吡菌酰胺、氟唑菌酰胺能與BW229、D-Y143 形成氫鍵,與C-W80 形成π-π 堆積作用,與B-R270 形成鹵鍵略有差異。
對比野生型和突變型BcSDH 與5 種SDHI 的結合模式可知,B-P225F 和B-H272R 氨基酸殘基突變能夠引起異丙噻菌胺、氟吡菌酰胺、氟唑菌酰胺、吡噻菌胺和啶酰菌胺與靶標蛋白的親和力下降,結合模式發生改變,形成相互作用力的氨基酸發生極大變化,這兩個點突變可能是引起SDHI類殺菌劑之間交互抗性的原因之一。Hu 等[9]的研究也表明,B-P225F 突變會造成灰葡萄孢對氟吡菌酰胺、氟唑菌酰胺、吡噻菌胺和啶酰菌胺產生抗性。本課題組前期從田間采集的灰霉菌株中分離到了具有抗啶酰菌胺的B-P225F 突變的灰葡萄孢 (數據未發表);而2012 年Avenot 等[6]研究表明,西瓜蔓枯病菌Didymella bryoniaeB-H272Y、B-H272R 氨基酸殘基突變對啶酰菌胺具有非常高的抗性,對吡噻菌胺具有高度抗性,卻對氟吡菌酰胺敏感,可能是由于氟吡菌酰胺當時剛被登記不久 (2009 年被登記),并未得到廣泛應用,且不同病原微生物對SDHI 類殺菌劑的交互抗性機制可能存在差異。另外,本文預測的B-P225L 突變會造成異丙噻菌胺、氟吡菌酰胺和吡噻菌胺與靶標蛋白的親和力下降,可能降低BcSDH 對這3 種殺菌劑的敏感性,這與Lalève 等[33]報道的B-P225L突變會影響灰葡萄孢對SDHI 類殺菌劑的敏感性的研究結果一致。
本研究是基于分子對接手段,通過分析灰葡萄孢sdhB 氨基酸殘基突變前后與5 種SDHI 類殺菌劑的親和力及結合模式的變化,來闡釋灰葡萄孢對SDHI 類殺菌劑抗藥性產生的機制和SDHI 類殺菌劑之間的交互抗性機制。Autodock vina 軟件的打分函數只能粗略的評估結合能,對接打分的高低與配體和受體之間相互作用力多少可能不一致。如,異丙噻菌胺與BcSDH 的親和力 (?30.514 kJ/mol)較氟吡菌酰胺與BcSDH 的親和力 (?37.620 kJ/mol)弱,但異丙噻菌胺與BcSDH 形成的相互作用力卻比氟吡菌酰胺與BcSDH 形成的相互作用力多 (圖4、圖5),且本文只對已報道的sdhB 上可能與灰葡萄孢抗SDHI 類殺菌劑相關的突變位點進行了研究,未來可進一步對構成活性口袋的sdhC 和sdhD突變位點[34,35]進行研究,還可通過分子動力學模擬、隨機突變位點預測等方法[36-37],進一步分析灰葡萄孢對SDHI 類殺菌劑的抗性。然而,同源建模和分子對接方法僅是計算機模擬方法,無法100%模擬殺菌劑與蛋白之間最真實的結合方式。在今后研究中,可以使用冷凍電鏡或X-ray 衍射法解析BcSDH 與SDHI 類殺菌劑的復合晶體結構,精確地分析兩者之間的結合模式。此外,植物病原菌對殺菌劑產生抗性可能是靶標基因的點突變;也可能是在殺菌劑脅迫下的應激反應調控,通過RNA 干擾來抑制相關基因的表達,從而獲得暫時的、可逆的抗藥性[38];還可能由于堿基替換導致了氨基酸多態性而影響酶的內在敏感性和生物適應度[39];或是外排轉運蛋白基因的過表達、解毒作用、單核苷酸多態性 (SNPs) 等多種途徑單一或共同調控的結果[40]。本研究僅從靶標蛋白氨基酸殘基突變角度通過計算機模擬闡述了灰葡萄孢對SDHI 類殺菌劑抗性產生的機制,未來可進一步探索這些非靶點抗性在灰葡萄孢中發揮作用的效力和程度,將有助于更全面地剖析灰葡萄孢抗藥性產生的機制,進而更高效合理地指導該類病害的管理和抗藥性風險治理。
4 結論
本文通過同源建模構建了BcSDH 三維結構模型,并根據已報道的氨基酸殘基突變位點構建了BcSDH 的突變體模型,使用分子對接的方法分析了異丙噻菌胺、氟吡菌酰胺、氟唑菌酰胺、吡噻菌胺和啶酰菌胺5 種SDHI 類殺菌劑與野生型和突變型BcSDH 的結合模式,并使用MEME 工具預測保守性。結論如下:
1) 5 種殺菌劑與BcSDH 具有較強的親和力,酸部分能夠插入BcSDH 活性腔底、胺部分在活性腔口,殺菌劑能夠與BcSDH 形成牢固的疏水作用、氫鍵、鹵鍵、π-π 堆積和π-陽離子等相互作用。
2) B-P225F 和B-H272R 氨基酸殘基突變可能是引起BcSDH 對5 種殺菌劑產生抗性的主要原因,也可能是引起SDHI 類殺菌劑之間交互抗性的原因之一;B-P225L 氨基酸殘基突變可能降低BcSDH 對部分殺菌劑的敏感性,但可能不是引起BcSDH 對SDHI 類殺菌劑產生抗性的主要原因。
3) 灰葡萄孢的B-P225 和B-H272 位于sdhB的保守區域,B-P225F、B-H272R 和B-P225L 氨基酸殘基突變可能為隨機突變。
本研究是基于結構生物學,通過計算機模擬初步闡釋了BcSDH 對SDHI 類殺菌劑產生抗藥性的機制及SDHI 類殺菌劑之間產生交互抗性的機制,能夠為今后繼續研究灰葡萄孢對SDHI 類殺菌劑的抗藥性機制提供理論支撐,并為SDHI 類殺菌劑結構的合理設計、修飾與改造提供參考,避免產生交互抗性。

