痰濕型PCOS大鼠卵巢顆粒細胞線粒體功能及Nox1/p-Akt/Glut4信號通路變化的研究?
叢培瑋, 張麗娜, 陳文娜, 尚 冰, 吳兆利
(1.遼寧中醫藥大學教學實驗中心, 沈陽 110847;2.遼寧中醫藥大學醫學檢驗學院, 沈陽 110847;3.遼寧中醫藥大學醫史文獻研究院, 沈陽 110847;4.遼寧中醫藥大學針灸推拿學院, 沈陽 110847)
現代中醫認為,痰濕阻絡可誘發機體糖脂代謝異常,也是痰濕型多囊卵巢綜合征(polycystic ovary syndrome, PCOS)患者胰島素抵抗發生的重要原因之一[1]。卵巢顆粒細胞(granulosa cells, GCs)是卵泡的重要組成細胞,GCs通過縫隙連接和旁分泌因子為卵泡卵母細胞的發育和成熟提供能量支持[2]。線粒體是細胞的“動力工廠”,在卵泡發育周期過程中,GCs線粒體通過合成大量腺嘌呤核苷三磷酸(adenine triphosphate, ATP)為卵泡發育成熟提供能量[3,4]。過量脂沉積誘發的氧化應激會損傷GCs線粒體氧化功能,由此引發機體糖脂代謝異常,是影響排卵前卵母細胞質量的重要原因。本研究在前期實驗基礎上,從痰濕型PCOS大鼠GCs線粒體功能及煙酰胺腺嘌呤二核苷酸磷酸氧化酶1(NADPH oxidase1, Nox1)/磷酸化蛋白激酶B(phosphorylated protein kinase B, p-Akt)/葡萄糖轉運蛋白4(glucose transporter protein 4, Glut4)信號通路變化兩方面,探討痰濕型PCOS卵泡發育異常和閉鎖的可能發生機制,豐富“痰濕不孕”的科學內涵。本研究已通過遼寧中醫藥大學動物實驗倫理委員會審核,批準號2019YS(DW)-035-01。
1 材料
1.1 動物
SPF級健康雌性SD大鼠42只,體質量85~105 g,4~5周齡,由遼寧中醫藥大學動物實驗中心提供,許可證號SCXK(遼)-2010-0001。實驗動物飼養于遼寧中醫藥大學SPF級動物中心,自由攝食與飲水,飼養環境溫度(20±2) ℃,濕度(50±5)%。
1.2 主要試劑與儀器
DMEM/F12培養基(貨號SH30023),HyClone公司;青鏈霉素(貨號P1400),北京索萊寶公司;10%胎牛血清(貨號SH30070),Bio-HyClone公司;孕馬血清促性腺激素(貨號P9970),天津正江科技有限公司;BCA蛋白測定試劑盒(貨號K20316),TransGen;ATP測定試劑盒(貨號201806),南京建成生物工程研究所;Nox1抗體(貨號ab131088)、p-Akt (ser473)抗體(貨號ab81283)、Glut4抗體(貨號ab654)、GAPDH抗體(貨號ab9485)Abcam公司。
JEM-1400透射電鏡(日本電子株式會社);電泳儀/酶標儀(Bio-Rad,042BR14173);Tanon5200化學發光成像系統(上海天能科技有限公司);轉膜儀(美國伯樂Bio-Rad小型Trans-Blot Turbo Transfer Systerm);ST16R高速冷凍離心機(美國熱電Thermo Sientific);LKB-1超薄切片機,瑞典LKB生物技術公司。
2 方法
2.1 動物分組及造模
大鼠適應性喂養1周,選取動情周期規律的22只大鼠隨機分為對照組10只和模型組12只,模型組給予高脂飼料連續喂養12周,第3周開始每日灌胃來曲唑溶液[1 mg/(kg·d)溶于0.5%CMC-Na溶液中],連續9周。高脂飼料由遼寧中醫藥大學動物實驗中心配送。對照組給予常規飼料喂養12周,第3周開始每日灌胃0.5% CMC-Na溶液,連續9周。造模結束后,選取動情周期延長的大鼠10只為痰濕型PCOS造模成功模型組大鼠。
2.2 動情周期檢測
通過觀察陰道脫落細胞涂片鑒定2組大鼠的發情周期。具體操作:用50μL的移液器吸取適量0.9%氯化鈉溶液,在大鼠陰道內來回抽吸3~5次。將吸出的液體滴到干凈的載玻片上,蘇木素染色后置于光學顯微鏡下觀察并記錄。于造模結束前10 d開始觀察2組大鼠動情間期,每日上午10∶00進行操作。
2.3 標本采集
造模結束后24 h禁食禁水,拉頸斷髓法處死2組大鼠,取卵巢組織PBS清洗,冰上去除表面包膜及周圍脂肪組織,每組隨機選取各2只大鼠的卵巢組織切成約1 mm3小塊,2.5%戊二醛固定以備電鏡檢測,其余卵巢組織用于GCs原代分離與培養。
2.4 GCs線粒體形態學觀察
固定24 h后的電鏡標本用PBS漂洗,1%鋨酸固定,乙醇、丙酮梯度脫水,環氧樹脂包埋聚合,切片機切片(50~60 nm),3%醋酸鈾-枸櫞酸鉛雙染,透射電鏡下觀察GCs線粒體并拍片。
2.5 GCs的分離與培養
分離與培養卵巢組織GCs,參照文獻的方法并加以改進[5,6]。將卵巢組織放入DMEM/ F12培養基中,37 ℃孵育15 min。解剖顯微鏡下用1 mL注射器針頭刺破卵泡輕輕拍打與擠壓,分別收集2組GCs分為對照組和模型組,40 μm一次性無菌細胞篩過濾,收集細胞懸液離心后棄上清,0.4%臺盼藍染色計數,鏡下未見藍染的為死細胞,制成1.0×106/L密度細胞懸液接種于35 mm培養皿中,置于37 ℃、5% CO2培養箱預培養。觀察鏡下大多數細胞貼壁后即可更換培養液。培養48 h后,0.1%胰酶消化制成單細胞懸液,PBS沖洗2~3次,4%多聚甲醛固定15 min,HE染色可見細胞形態完整,呈多角形、核藍染,胞漿淡紅色并含有許多顆粒即為GCs,貼壁后待用。
2.6 ATP水平測定
ATP檢測采用比色法,將培養的對照組和模型組GCs各按5.0×107/L密度接種于96孔板中,應用酶標儀測定各孔吸光度值,根據公式:(測定OD-對照OD)/(標準OD-空白OD)×標準品濃度(1×103μmol/L)×樣本測定前稀釋倍數÷待測樣本濃度(g/L),計算各孔ATP濃度(μmol/g),按照說明書操作。
2.7 活性氧(reactive oxygen species, ROS)水平測定
2組細胞分別用不含血清培養液以1∶1000體積比加載DCFH-DA探針,終濃度為10 μmol/L,按細胞濃度2×104/孔、100 μl/孔接種至96孔板中,37 ℃5% CO2環境孵育24 h,吸除孔內培養液,加入100 μL DCFH-DA工作液,37 ℃、5%CO2中避光孵育30 min,無血清培養基清洗1遍,化學發光免疫分析儀在激發波長488 nm、發射波長525 nm處測定DCFH,經 ROS氧化后的DCF綠色熒光強度,即代表ROS含量的相對吸光度值。
2.8 Nox1、p-Akt、Glut4蛋白表達
采用Western blot法,在培養的對照組和模型組GCs中加入RIPA細胞裂解液提取蛋白。BCA法進行蛋白濃度測定,以50 μg總蛋白上樣量計算加樣體積行SDS-PAGE凝膠電泳。電泳后轉膜,根據Marker提示分子量切膜,左上角標記。室溫下5%脫脂奶粉、TBST封閉液封閉2 h,分別按照1∶1000、1∶1000、1∶1000、1∶2000比例稀釋Nox1、p-Akt、Glut4和GAPDH一抗各4 mL,4 ℃搖床過夜;TBST洗膜,1∶2000比例稀釋HRP標記山羊抗兔二抗,室溫搖床孵育1 h,TBST洗膜,ECL發光液曝光顯影。應用 ImageJ軟件分析灰度值,利用目的蛋白/GAPDH的方法求得每例組織蛋白的相對表達量。
2.9 統計學方法
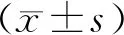
3 結果
3.1 大鼠動情周期比較圓的白細胞,少量角化上皮細胞和有核上皮細胞。與對照組比較,模型組大鼠動情間期顯著延長(P<0.01)。
圖1示,對照組可見規則動情周期平均4~5 d。模型組出現不規則動情周期,表現為間期延長,即動情間期連續超過3 d,鏡下可見大量小而

注:與對照組比較:bP<0.01;Control(對照組),Model(模型組)
3.2 GCs線粒體形態學變化比較
圖2示,對照組線粒體形態正常,嵴呈條狀及環狀型,模型組線粒體數量減少,出現明顯腫脹,嵴斷裂,線粒體呈空泡樣改變。

注:左圖為對照組透射電鏡下線粒體形態,右圖為模型組鏡下線粒體形態
3.3 GCs中ATP、ROS含量比較
圖3示,與對照組比較,模型組大鼠GCs-ATP含量顯著降低(P<0.01),ROS含量(DC熒光強度)顯著增高(P<0.01)。

注:與對照組比較:bP<0.01;Control(對照組),Model(模型組)
3.4 GCs中Nox1、p-Akt及Glut4蛋白表達比較
圖4示,與對照組比較,模型組大鼠GCs中Nox1蛋白表達顯著增高(P<0.05),p-Akt、Glut4蛋白表達顯著降低(P<0.01)。

注:與對照組比較:aP<0.05,bP<0.01;Control(對照組),Model(模型組);煙酰胺腺嘌呤二核苷酸磷酸氧化酶1(NADPH oxidase1, Nox1),磷酸化蛋白激酶B (phosphorylated protein kinase B, p-Akt),葡萄糖轉運蛋白4(glucose transporter protein 4, Glut4)
4 討論
卵泡閉鎖是排卵障礙的直接原因,而GCs損傷是引起卵泡發育異常和閉鎖的根本原因之一[7]。一方面GCs與卵泡膜細胞(theca cells)共同產生卵巢激素和分泌細胞因子,另一方面GCs通過復雜的細胞間連接機制介導著卵泡的生長、發育、閉鎖和排卵,GCs能量代謝穩定能促進卵泡發育,反之則會導致卵泡閉鎖,尤其是在卵泡發育的后期[8]。已有研究表明,高脂代謝產物導致GCs損傷是加劇不孕癥發生的直接風險因素[9-11]。
《傅青主女科·種子》言:“婦人有身體肥胖,痰涎甚多,不能受孕者,人以為氣虛之故,誰知是濕盛之故乎。”中醫認為,肥胖引發痰濕集聚,流注下焦,壅塞沖任胞宮,而致月經稀發不孕,這與現代PCOS患者以肥胖居多的臨床表型一致。現代中醫研究發現,長期痰濕阻絡誘發機體糖脂代謝異常,是PCOS患者體內出現胰島素抵抗的重要原因[1,12]。臨床調查發現,痰濕型PCOS是目前臨床高發的PCOS中醫證型[13,14]。本研究以痰濕型PCOS大鼠為實驗對象,探討GCs損傷引發PCOS糖脂代謝異常的可能發生機制。
線粒體是細胞的“動力工廠”,葡萄糖、脂肪酸、氨基酸等代謝產物最終都會進入線粒體的氧化呼吸鏈合成ATP,為細胞提供能量。在卵泡發育周期過程中需要大量能量參與,GCs線粒體功能正常對卵泡發育成熟及女性生育能力的維持至關重要[3,4]。長期高脂飲食導致的血脂異常會誘發低密度脂蛋白沉積,激發機體氧化應激,刺激Nox等生成大量ROS。尤其在低氧環境下,過量的ROS在超過機體自我清除能力范圍時會損傷線粒體氧化功能,包括線粒體脂肪酸氧化代謝率降低,丙酮酸氧化磷酸化水平下降等一系列糖脂終端代謝異常[15-17]。因此,高脂介導的ROS生成增多,氧化應激增強會損傷GCs線粒體功能,使ATP合成減少,引發能量供應不足和糖脂代謝紊亂,可能是影響卵泡發育成熟并導致卵泡閉鎖的重要原因。
Nox是細胞內非線粒體源ROS生成的主要酶體,胞內過氧化物酶系統中的Nox介導ROS產生的氧化應激越來越受到關注[18,19]。而PCOS大鼠卵巢GCs中Nox活性是否通過線粒體功能來影響卵泡發育和排卵尚不清楚。Nox1主要表達在結腸、血管平滑肌、前列腺及子宮、卵巢中,發揮宿主防御及血壓調節的作用[20-22]。課題組前期研究發現[23],低氧狀態下血管內皮細胞Nox1蛋白表達增高是激活細胞氧化應激水平的主要原因,而低氧環境是卵泡發育成熟的微環境。大量研究證實,PCOS卵巢中GCs在低氧狀態下出現嚴重的氧化應激。本次研究發現,與對照組比較模型組大鼠GCs中Nox1蛋白及ROS含量增高,ATP含量降低。由于ATP源于線粒體,因此本實驗進一步觀察了GCs線粒體形態學變化,結果顯示模型組線粒體數量明顯減少,出現腫脹、嵴斷裂、線粒體呈空泡樣改變,表明模型組大鼠線粒體損傷嚴重。
Akt是Nox1的下游信號,Nox1可通過抑制Akt磷酸化激活,參與組織氧化應激反應[24,25]。課題組前期研究證實[26],p-Akt/Glut4信號通路是肥胖型PCOS大鼠胰島素抵抗發生的關鍵通路。本次研究發現,與對照組比較模型組大鼠GCs中p-Akt、Glut4蛋白表達顯著降低。
綜上所述,本研究認為高脂誘導的Nox1高表達引發GCs氧化應激的發生,進而損傷了GCs線粒體糖脂代謝功能,這是導致痰濕型PCOS卵泡發育異常和閉鎖的可能機制之一。今后課題組將從Nox1與線粒體損傷的相關性展開深入研究。

