背俞指針療法對GERD大鼠胃起搏區MLCK及PMLC20表達水平的影響?
黃美禎, 譚金晶, 宋慶增, 劉禮劍, 韋金秀, 周曉玲, 黎麗群, 岑前麗, 李建鋒, 謝 勝△
(1.廣西中醫藥大學, 南寧 530001;2.廣西中醫藥大學第一附屬醫院, 南寧 530023;3.柳州市中醫院,廣西 柳州 545001)
胃食管反流病(gastroesophageal reflux disease,GERD)是指胃或十二指腸內容物反流入食管,從而引起反酸、燒心等與反流相關癥狀或并發癥的疾病[1]。GERD為多發性疾病,其全球總體發病率為13%并呈上升趨勢[2]。研究發現,GERD具有病程長、復發率高等特點,可增加肺癌、食管癌、冠心病等多種疾病的發病風險,嚴重影響患者的身心健康和生活質量[3]。因此,積極防治GERD對公共衛生事業具有重大意義。本團隊前期研究發現,背俞指針療法治療GERD療效確切,可顯著改善食管下括約肌壓力及胃電節律,明顯減少酸反流[4-6]。然而,該療法治療GERD作用的分子機制尚未完全明確。
食管、胃動力障礙是GERD的主要發病機制之一,而胃動力障礙與平滑肌結構、功能異常密切相關[7-9]。研究表明,胃平滑肌細胞內肌球蛋白輕鏈激酶(myosin light chain kinase,MLCK)通過使肌球蛋白調節性輕鏈(20kD Myosin light chain phosphorylation, MLC20)磷酸化,形成磷酸化肌球蛋白調節性輕鏈(phosphorylation 20kD Myosin light chain phosphorylation, PMLC20),從而活化肌球蛋白ATP酶,引起平滑肌的收縮,故MLCK- PMLC20信號通路在調控平滑肌細胞運動功能中起重要作用[10,11]。因此,本研究以GERD大鼠為研究對象,探討MLCK-PMLC20信號通路異常是否為GERD的發病機制,并觀察背俞指針療法對該信號通路的影響,明確該療法治療GERD的分子作用機制。本研究已通過廣西中醫藥大學實驗動物倫理委員會審查,倫理學批準號DW20180101-25。
1 材料與方法
1.1 動物
適齡清潔級SD大鼠124只,雌雄各半,體質量220~250 g,購于湖南斯萊克景達實驗動物有限公司,實驗動物許可證號SCXK(湘)2016-0002。飼養于廣西中醫藥大學第一附屬醫院動物實驗中心動物房,溫度20~25 ℃,相對濕度50%~65%。
1.2 主要試劑及儀器
熒光定量PCR試劑盒(貨號RR047A、RR820A)TaKaRa公司;MLCK(貨號bs-4705R)及PMLC2(貨號bs-19149R)抗體,北京博奧森公司;IgG免疫組化試劑盒(貨號SABC-POD),武漢博士德公司。
展烤片機TY-7FB(天津愛華);超速低溫離心機1730R(美國 Sigma 公司);光學顯微鏡Olympus-BH2(日本Olympus公司);顯微攝像儀 Olympus-C35AD-2(日本 Olympus 公司);病理切片機 LEICA RM2135(德國RM公司);分光光度計 722 型(四川儀表九廠);7000型熒光定量PCR儀(美國Applied Biosystems公司);紫外透射儀 ZF-90 (上海顧村電光儀器廠);紫外分光光度計 752型(上海精密科學儀器有限公司);圖像分析系統Image-Pro Express(日本 Olympus 公司)。
1.3 造模及分組方法
將購回的124只SD大鼠進行標記,采用隨機數字表法隨機抽取30只作為空白組(開腹后不手術即縫合,無反流對照組),其余94只SD大鼠建立GERD模型。大鼠購回后適應環境7 d,手術前禁食24 h。采用經食管支架植入術造模[12]:大鼠麻醉后備皮,碘伏消毒術區后開腹,將鋼圈 (直徑0.31 mm, 內徑3.5 mm, 長5~6 mm) 套在鞘芯上, 從口腔經食管送于賁門處, 先退出鞘芯再退出鞘, 用魚線 (0.4號, 0.10 mm)將鋼圈固定于賁門處, 腹腔內注入青霉素后關腹。空白組進入腹腔前的操作同模型組,開腹后使用0.9% NaCl溶液灌洗腹腔,縫合線逐層關腹。所有大鼠術后禁食24 h不禁水,4周后隨機抽取4只大鼠的食管標本進行病理檢測,明確造模成功后根據隨機數字表法隨機分為模型組、指針組及西藥組各30只。
1.4 干預方法
1.4.1 西藥組 西藥組參考《動物與人體的每公斤體質量劑量折算系數表》[13]計算出每只大鼠干預所需劑量。給予枸櫞酸莫沙必利分散片(成都康弘藥業集團股份有限公司,批號H20031110,1.56 mg/kg)每日均分灌胃3次,每次1 mL;蘭索拉唑腸溶片(汕頭經濟特區鮀濱制藥廠,批號H10980136,3.125 mg/kg)每日均分灌胃2次。空白組和模型組給予等量純水灌胃,各組均干預14 d。
1.4.2 背俞指針組 參照文獻選取大鼠雙側足太陽膀胱經肝俞、膽俞、脾俞、胃俞穴,于每天上午9~11點進行干預[14]。先將大鼠固定于俯臥位,左手罩住頭部,右手輕撫背部4 min。指針操作如下:不同穴位從上到下、相同穴位由左至右,對每個穴位進行相應點壓、按揉等手法操作,刺激量以大鼠無掙扎為度,頻率為120~160次/min,時間為3 min/穴,每只大鼠每天手法操作24 min,療程為2周。干預前對相關人員進行2周培訓,在電子天平儀上練習,力求達到按揉質量200~250 g、點壓質量300~350 g的標準。
1.5 標本采集
實驗周期結束大鼠禁食不禁水12 h后,采用放血法將麻醉(25%烏拉坦6 mL/kg腹腔注射)后大鼠處死,隨后進行食管組織及胃組織標本取材,于食道賁門上緣處取出食管組織約3 cm,于大鼠胃竇處(距幽門約0.5 cm)取10×10×5 mm3的平滑肌條,切取實驗所需的胃起搏區組織-80 ℃保存。
1.6 檢測指標
1.6.1 各組大鼠一般情況 觀察各組大鼠的精神狀態、反應、毛色、糞便、飲食、飲水量等,觀察各組大鼠存活率和手術造模傷口愈合情況。
1.6.2 光鏡下觀察食管中下段組織病理變化 各組均隨機抽取8只大鼠作為觀察樣本,將取出的食管組織經HE染色后在光鏡下觀察組織的鱗狀上皮、上皮細胞層、黏膜固有層的病理變化,并進行對比分析。
1.6.3 熒光定量PCR法檢測胃起搏區組織MLCK mRNA的表達情況 取出胃起搏區平滑肌組織,切取實驗所需量(30~50 mg),采用Trizol法提取總RNA,紫外-分光光度計測定所提取RNA濃度及含量,采用TaKaRa公司試劑盒行常規逆轉錄聚合酶鏈反應,逆轉錄所用的引物根據GenBank登錄的MLCK核苷酸序列設計引物,委托寶生物工程(大連)技術服務有限公司進行合成,上游引物5’-GTGGTGGTAGCGGAGAGAAG-3’,下游引物5’-CCTTGTGGCCAGTTCATCCT-3’,引物長度為144bp。反應條件:預變性(94 ℃,5 min);變性(95 ℃,30 s);退火(60 ℃,30 s),延伸(72 ℃,30 s),共進行40個循環的擴增,以上反應流程均參照TaKaRa公司試劑盒說明書進行。反應完成后采用SYBRGreenⅠ法進行擴增產物定量檢測,擴增反應于ABI 7000熒光定量PCR儀上進行,并采用2-ΔΔCT法比較各組MLCK mRNA表達水平的差異。
1.6.4 免疫組化法觀察胃起搏區組織MLCK及PMLC20的表達 切取大鼠胃起搏區(胃體中部距賁門1/3處)組織約1.0 cm3,石蠟切片4 μm,烤片后脫蠟至水,高壓抗原修復,依次滴加3%過氧化物酶阻斷液(室溫10 min)、5% BSA封閉液(室溫30 min)、一抗(1∶300,4 ℃過夜),二抗(37 ℃孵育30 min)及SABC(37 ℃孵育30 min),DAB顯色,蘇木素復染,脫水透明,中性樹膠封片。用已知陽性切片作陽性MLCK及PMLC20對照,用PBS代替一抗作陰性對照。每張切片隨機選取5個視野,采用image-Pro圖像分析系統,測定并計算出平均光密度值(mean optical density, MOD),用于各組MLCK及PMLC20表達水平的比較。
1.7 統計學方法
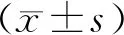
2 結果
2.1 各組大鼠一般情況
空白組大鼠反應敏捷,毛色光澤,糞便正常;模型組大鼠反應較遲鈍,毛色無光澤,糞質干硬,每日飲食、飲水量稍減少,可見少量反流物;指針組及西藥組大鼠反應較模型組敏捷,毛色較光澤,指針組大便正常,西藥組大便偏爛。各組大鼠均無死亡,造模組大鼠傷口愈合良好。
2.2 GERD大鼠干預后食管中下段組織病理變化
圖1示,各組食管黏膜組織病理變化,空白組食管黏膜組織形態正常,未見黏膜糜爛及潰瘍,黏膜上皮未見增生,固有層未見炎性細胞浸潤;模型組食管鱗狀上皮基底細胞中度增生,基底細胞層增厚,固有層乳頭延長,固有層內炎性細胞浸潤,以嗜酸性粒細胞為主,細胞間隙增寬;指針組食管黏膜結構基本恢復正常,鱗狀上皮修復完整,基底細胞呈單層排列,黏膜固有層未見明顯的乳頭增生及炎性細胞浸潤;西藥組食管黏膜結構基本恢復正常,黏膜固有層未見明顯的炎性細胞浸潤。

圖1 各組大鼠食管黏膜中下段組織鱗狀上皮、黏膜固有層、上皮細胞層病理變化比較(HE×200)
2.3 GERD大鼠干預后胃起搏區組織MLCK及PMLC20表達結果
剔除異常數據后,空白組、模型組、西藥組、模型組分別納入11、12、11、14個樣本分析MLCK mRNA表達水平。表1示,與空白組比較,模型組大鼠MLCK mRNA表達水平明顯降低(P<0.05);西藥組與模型組比較差異無統計學意義(P>0.05);指針組較模型組及西藥組明顯升高(P<0.05)。
圖2、3示,MLCK及PMLC20陽性表達細胞分布于胃起搏區組織內環外縱肌層間,呈棕黃色染色。表1示,與空白組比較,模型組MLCK及PMLC20的表達水平有所下降(P<0.05);與模型組比較,西藥組及指針組MLCK及PMLC20的表達水平有顯著上升(P<0.01);與西藥組比較,指針組的MLCK表達水平降低(P<0.05),而西藥組和指針組PMLC20表達水平差異無統計學意義(P>0.05)。

表1 MLCK mRNA、MLCK陽性產物及PMLC20陽性產物表達比較

圖2 各組大鼠胃起搏區組織肌球蛋白輕鏈激酶(Myosin Light Chain Kinase,MLCK)免疫組化陽性表達(200×)

圖3 各組大鼠胃起搏區組織磷酸化肌球蛋白調節性輕鏈(Phosphorylation 20kD Myosin light chain phosphorylation,PMLC20)免疫組化陽性表達(200×)
3 討論
目前國內大部分學者認為,GERD的基本病機為脾胃升降功能失常,胃氣上逆[15]。本團隊多年來致力于GERD的實踐與研究,認識到“脾胃氣機失衡是GERD發病的表象,而任督二脈經氣升降交會失衡是脾胃升降失衡GERD的病機本質”[16,17]。督脈為陽脈之海,與膀胱經交會于大椎等穴位及巔頂部,故膀胱經之經氣可通諸陽之會,調達一身之陽氣。背俞穴是五臟六腑之精氣輸注于膀胱經上的穴位。本團隊前期研究發現,在背俞穴處施予背俞指針療法可調節任督二脈經氣的交會,改善多個臟腑的功能,從而達到治療GERD的目的[4-6]。基于此,筆者團隊提出“以俞調樞”的觀點,構建了“以俞調樞”理論體系[16,17]。同時前期臨床研究表明,背俞指針療法可以促進胃腸收縮及蠕動,降低食管括約肌壓力和減少酸反流,治療GERD效果確切[4-6]。本次研究的病理結果顯示,與模型組比較,指針組食管黏膜結構基本恢復正常,食管組織炎癥消失,提示背俞指針療法可以改善GERD模型大鼠的食管黏膜病理改變,促進炎癥消退。這可能與此療法能調節任督二脈穴位的皮溫,調節二脈經氣的交會,進而改善脾胃之氣機升降功能有關[18]。
MLCK是一種廣泛表達的絲氨酸/蘇氨酸激酶[19]。MLCK使肌球蛋白調節性輕鏈磷酸化并控制骨骼肌、平滑肌和心肌的收縮[20]。胃排空障礙與胃平滑肌收縮密切相關。在調節平滑肌收縮機制中, MLCK可使 MLC20磷酸化,磷酸化后的MLC20為PMLC20,可以使肌球蛋白ATP酶活化,觸發肌動蛋白-肌球蛋白交叉橋接機制,引起平滑肌的收縮。在平滑肌的MLCK-PMLC20通路中,MLC20磷酸化水平在一定程度上決定著平滑肌收縮的功能。MLC20磷酸化的程度取決于MLCK活性,而MLCK mRNA是合成MLCK的模板[20]。本研究發現,模型組大鼠在胃起搏區的MLCK mRNA、MLCK及PMLC20蛋白表達水平均低于空白組大鼠,說明GERD大鼠胃動力障礙可能與MLCK及PMLC20表達量降低有關,且與其他胃動力障礙性疾病大鼠模型的胃平滑肌MLCK和PMLC20表達水平變化相一致[21-23]。
本次研究中,干預后指針組中MLCK mRNA水平較模型組升高,且MLCK及PMLC20陽性蛋白表達均高于模型組,說明背俞指針療法能上調GERD大鼠胃起搏區MLCK mRNA、MLCK及PMLC20陽性蛋白表達,從而達到治療GERD的目的。于上午脾經當令之巳時(9~11點)進行背俞指針療法,可激發膀胱經經氣, 從而使任督二脈經氣升降交會,以恢復脾胃之氣機升降,調暢五臟六腑臟腑樞機,恢復MLCK-PMLC20通路的“樞機”。結合病理結果說明,背俞指針療法治療GERD可能是通過上調胃起搏區MLCK mRNA、MLCK及PMLC20這一機制起作用。然而,西藥組的MLCK mRNA表達與模型組比較差異無統計學意義,其蛋白表達水平卻高于模型組,說明2組雖然以同等水平mRNA為模板合成的MLCK沒有增加,但是用藥后可能使合成MLCK的其他相關因子增加,或者使蛋白相較模型組分解減少,從而提高西藥組MLCK的表達,具體機制尚未明確。西藥組的MLCK蛋白表達水平高于指針組,但是最后2組間的PMLC20蛋白表達水平無明顯差異,可能與指針組還能通過其他途徑增加MLC20磷酸化有關,值得進一步探討。
綜上所述,GERD的發病可能與MLCK mRNA、MLCK、PMLC20蛋白表達水平下降有關。背俞指針療法可明顯改善GERD大鼠食管病理改變,其機制可能與上調MLCK mRNA、MLCK、PMLC20蛋白表達水平有關。然而目前尚有許多問題,如背俞指針療法是如何上調MLCK mRNA及其蛋白表達,其是否會通過除MLCK的其他通路影響MLC20磷酸化,均有待今后進一步的研究。

