一株鴨肝炎病毒的基因組序列及其VP1基因的多克隆抗體制備
楊世麗,常 巍,袁 夢,黃雅貞,陳仕龍,馬燕梅
[1. 福建農(nóng)林大學動物科學學院(蜂學學院),福建 福州 350002;2. 福建省農(nóng)業(yè)科學院畜牧獸醫(yī)研究所,福建 福州 350013]
0 引言
【研究意義】鴨病毒性肝炎(Duck viral hepatitis,DVH)是由鴨病毒性肝炎病毒(Duck hepatitis virus,DHV)引起的一種發(fā)病急、傳播快、病程短和死亡率高的急性傳染病[1-2]。DHV主要感染3周齡內(nèi)的雛鴨,以1周齡內(nèi)雛鴨最為易感[3]。病鴨的臨床癥狀主要表現(xiàn)為抽搐和角弓反張,典型的病理特征為肝臟腫大和瘀斑樣出血[4-5]。DHV的3個血清型在抗原上互不交叉,可分別引起I型、II型和III型DVH[6]。然而,DVH的變異株層出不窮,現(xiàn)有的相關研究并不充足,生產(chǎn)上存在較大的防治缺口,因此,臨床上開展DVH的深入研究,了解DVH的病原性特點和流行規(guī)律,并研究有效的防治技術,對減少DHV對鴨養(yǎng)殖業(yè)的影響十分必要。【前人研究進展】I型鴨肝炎病毒(Duck hepatitis virus type I,DHV-I)基因組為7700 nt的單股正鏈RNA,編碼一個約6750 nt的開放閱讀框(Open reading frame,ORF)和約626 nt的非編碼區(qū)(Untranslated region,UTR)5′UTR、3′UTR[7-8]。ORF區(qū)編碼多聚蛋白,多聚蛋白在翻譯過程中不斷被自身編碼的蛋白酶水解為結構蛋白P1和非結構蛋白P2、P3[9]。結構蛋白P1包括VP0、VP1和VP3,位于病毒核衣殼,可決定病毒的抗原性和血清型[7,10]。目前在世界各地發(fā)生和流行的主要是DHV-Ⅰ。黃均建于1963年首次報道了本病在中國的發(fā)生[11],王平等于1980年在北京首次分離得到DHV-I[12]。【本研究切入點】VP1蛋白基因編碼的主要抗原位點,對DHV的致病性、進化和毒力起至關重要的作用[13],而關于全長VP1蛋白的兔多抗制備和應用方面的研究相對較少。2015年福建某鴨場出現(xiàn)疑似鴨肝炎病死鴨,病死鴨出現(xiàn)頭部上仰、腳部后翻的角弓反張的癥狀,肝臟出現(xiàn)腫大且有密集出血點,膽囊出現(xiàn)腫大充血,脾臟和胰腺也出現(xiàn)明顯的腫大。其病原有待進一步分離鑒定。【擬解決的關鍵問題】本研究取病死鴨肝臟組織進行病毒分離鑒定,為確定該病毒的基因型進行了全基因測序,并利用pGEX-4T-1載體構建VP1的高效表達系統(tǒng),制備兔多克隆抗體,用Westernblotting檢測驗證其特異性,為補充DHV的基因庫及研究和控制DVH的發(fā)生和流行與I型DHV的臨床快速檢測提供參考依據(jù)。
1 材料與方法
1.1 病毒株、試驗動物、載體和菌株
試驗鴨取自福建某鴨場疑似鴨肝炎病死鴨,2015年采集并進行病毒分離,分離后的病毒于-80 ℃保存,進行后續(xù)試驗。非免疫櫻桃谷鴨的鴨胚及健康櫻桃谷雛鴨購自漳州昌龍農(nóng)牧有限公司和福州創(chuàng)新農(nóng)牧有限公司。H9N2、DHV-I型標準毒株和pGEX-4T-1為實驗室原有保存。感受態(tài)細胞E.coilDH5α和E.coilBL21(DE3)購自北京全式金生物技術有限公司。
1.2 工具酶及試劑
Trizol 購自碧云天生物技術研究所,膠回收試劑盒購自全式金生物公司,TRYPTONE、YEAST EXTRACT、Agar購自OXOID公司,核酸限制性內(nèi)切酶BamH I-HF和SalI-HF購自NEB公司,T4DNA連接酶、Pyrobest、Primer STAR高保真DNA聚合酶、Taq酶、Oligo(dT)18 Primer、Recombinant Dnase I、核酸Marker DL2000等購自TaKaRa公司,DNA純化回收、質(zhì)粒小提試劑盒購自TIANGEN公司。
1.3 病料的采集和處理
無菌采集0.05 g有明顯病癥的雛鴨肝臟,置于2 mL EP管中,加1 mL無菌雙抗生理鹽水和兩顆滅菌鋼珠,置于高容量組織研磨器70 Hz研磨80 s,制成勻漿后凍融3次。置于離心機4 ℃、3000 r·min-1離心30 min,吸取上清于1.5 mL EP管中,4 ℃、12000 r·min-1再離心30 min,取出上清液,用0.22 μm 濾膜過濾,濾液放入-80 ℃冰箱備用。
1.4 病毒分離
取20枚9~10日齡的非免疫櫻桃谷鴨胚,分2組,每組10枚,分別用0.2 mL病料和0.2 mL生理鹽水接種尿囊腔,接種后置于37 ℃恒溫箱中孵化,去除24 h內(nèi)死亡的鴨胚,收集24~120 h死亡鴨胚的尿囊液并觀察鴨胚胎的變化。收集的尿囊液進行連續(xù)傳代。觀察雛鴨致死率。
1.5 血凝試驗
分別采取鴨、雞、小鼠和兔的血液檢測病毒尿囊液血凝性,H9N2為陽性對照。血凝試驗參照文獻[14]的方法。
1.6 動物感染試驗
選擇非免疫櫻桃谷鴨胚孵化的1 d的櫻桃谷鴨20只,分為2組,每組10只。一組肌肉注射分離的病毒,每只0.5 mL,另一組肌肉注射生理鹽水,每只0.5 mL,分開飼養(yǎng),觀察發(fā)病情況。
1.7 病毒RT- PCR鑒定及基因序列測定
1.7.1 引物設計 參照 GenBank 上已發(fā)布的DHVI的基因組序列,根據(jù)保守序列區(qū)設計1對引物,擴增目的片段,預期長度為992 bp。F:5′-TCTGCC ATTTACATCAACCAC- 3′,R:5′-TGCCAACAAC TAAGATAGGTC- 3′,由上海英濰捷基貿(mào)易有限公司合成。
1.7.2 病毒RNA提取及反轉錄 取0.05 g病變肝臟,加入1 mL Trizol及兩顆鋼珠于2 mL EP管中,置于高通量組織研磨器70 Hz,研磨80 s。取出鋼珠,加入200 μL氯仿,振蕩15~20 s。4 ℃、12000 r·min-1離心12 min后,吸取上清液至1.5 mL EP管。加入200 μL異丙醇至EP管中,溫和顛倒數(shù)次后冰上靜置20 min,4 ℃、12000 r·min-1離 心10 min,去 除 上清。加75%乙醇(DEPC 配制)1 mL清洗沉淀,4 ℃、7500 r·min-1離心5 min,清洗兩次,去除乙醇后,晾干3~5 min,加30~50 μL DEPC水溶解提取物。
反轉錄采用50 μL體系,即先加入RNA 4 μg、Oligo(dT) 181 μL、DEPC水補至10 μL,反應條件為70 ℃ 5 min,后 加 入10 mmol·L-1dNTP 1.5 μL、5×buffer 10 μL、RRI 1 μL、M-MLV 1 μL、DEPC水26.5 μL,反應條件為42 ℃ 1 h,72 ℃ 15 min。
1.7.3 PCR擴增 以制備好的cDNA 1 μL,加入相應的上、下游引物各1 μL,ddH2O 32.5 μL,5×buffer 10 μL,dNTP(2.5 mmol·L-1) 4 μL,Primer STAR酶0.5 μL,反應體系50 μL。擴增條件為:95 ℃ 5 min,95 ℃ 30 s,Tm-5 ℃ 30 s,72 ℃ 1 kb·min-1,35個循環(huán),72 ℃ 10 min。取PCR產(chǎn)物10 μL,混勻后進行瓊脂糖凝膠電泳,使用凝膠成像儀觀察目的條帶。
1.7.4 全基因測序及同源性分析 將提取的分離病毒的RNA 委托生工生物工程(上海)股份有限公司進行全基因序列測序,將測序結果與GenBank中12株亞洲地區(qū)報道的已知DHV-I毒株進行比較分析。
1.8 重組質(zhì)粒pGEX-4T-1-VP1的構建
1.8.1 引物設計 參照Fujian2015株VP1蛋白基因序列設計引物,并在上游和下游引物分別引入BamH I和SalI酶切位點,預期擴增片段大小為714 bp。具體引物序列如下:F5′-CGCGGATCCATGGGT GATTCCAACCAGTTGGGGGATGATGAG- 3′,R:5′-ACGCGTCGACTCATTCAATTTCCAGATTGAG TTCAAATGCTAG- 3′,由北京擎科新業(yè)生物技術有限公司合成。
1.8.2 重組質(zhì)粒pGEX-4T-1-VP1的構建與鑒定 使用上述引物PCR擴增目的片段并純化回收,反應體系 為DNA 30 μL,BamH I 1 μL,SalI 1 μL,10×Buffer 5 μL,ddH2O 13 μL的體系,載體DNA≤ 2 μg,BamH I 1 μL,SalI 1 μL,10×Buffer 4 μL,ddH2O 加至40 μL的體系,用BamH I和SalI進行雙酶切,混勻后置37 ℃水浴1 h,目的DNA用DNA純化回收試劑盒進行純化。將雙酶切并純化后的目的片段和載體按照下述體系進行連接,輕輕混勻后在16 ℃金屬浴中連接12~16 h:目的片段8 μL,載體DNA 2 μL,T4 DNA Ligase 1 μL,10×T4 DNA Ligase Buffer 1.5 μL,ddH2O 2.5 μL。將連接產(chǎn)物轉化至感受態(tài)DH5α后搖菌培養(yǎng),菌液PCR驗證陽性的菌液提取質(zhì)粒后進行雙酶切鑒定,并送北京擎科新業(yè)生物技術有限公司進行測序。
1.9 重組蛋白誘導表達、SDS-PAGE電泳鑒定及Western-blotting檢測
空載體pGEX-4T-1和重組陽性質(zhì)粒pGEX-4T-1-VP1轉化至感受態(tài)BL21(DE3)中,涂板并37 ℃過夜。在含氨芐抗性的LB培養(yǎng)液中接種挑取的單菌落,37 ℃、200 r·min-1培養(yǎng)12 h。將菌液以1∶100的比例接于氨芐抗性的LB液體培養(yǎng)液中,37 ℃培養(yǎng)2~3 h至OD600nm值約0.5時加入終濃度為0.5 mmol·L-1的誘導劑異丙基硫代-B-D-半乳糖苷(IPTG)。4 ℃、8000 r·min-1離心3 min,收集菌體沉淀,用PBS重懸,加入2×loading buffer,煮沸5 min,分別取20 μL樣品進行SDS-PAGE電泳觀察是否有目的條帶,并進行Western-blotting檢測。
1.10 重組蛋白抗血清的制備
將重組質(zhì)粒pGEX-4T-1-VP1經(jīng)誘導表達后得到重組蛋白GST-VP1,分別進行SDS-PAGE電泳后,切下對應大小位置的目的條帶,用于免疫兔子,多克隆抗體的制備由北京金牧陽實驗動物養(yǎng)殖有限責任公司協(xié)助完成。
2 結果與分析
2.1 病毒分離
注射病料濾液的鴨胚,9枚死亡,1枚活力很微弱。注射生理鹽水的鴨胚均存活,且發(fā)育正常。正常胚體無出血點(圖1-A),肝臟呈黃色,肝細胞排列規(guī)則有序,未見明顯異常(圖1-B);死亡的胚體全身充血,肝臟質(zhì)地脆、腫大及出血(圖1-C)。與正常肝細胞對比,病死鴨胚肝臟出現(xiàn)肝細胞腫大、變性,細胞結構紊亂;炎性細胞(淋巴細胞和中性粒細胞為主)散在浸潤(圖1-D)。該分離病毒在鴨胚連續(xù)傳6代后對雛鴨致死率約為70%。

圖1 鴨胚肝臟及其HE染色(×200)Fig. 1 Liver tissues with and without HE-staining from duck embryo
2.2 血凝試驗
分離病毒在鴨、雞、小鼠和兔4種血液中均未出現(xiàn)血凝現(xiàn)象,而陽性對照H9N2在鴨、雞血液中出現(xiàn)血凝現(xiàn)象(圖2),表明該分離病毒無血凝性。

圖2 分離病毒的血凝性檢測Fig. 2 Hemagglutination detection on isolated viruses
2.3 動物感染試驗
注射病料研磨液的雛鴨,48 h內(nèi)死亡率為100%,出現(xiàn)角弓反張,肝臟腫大、質(zhì)地脆、有明顯出血點等病理特征(圖3)。

圖3 動物感染及其剖檢特征Fig. 3 Infection and dissection on animals
2.4 RT-PCR 檢測
用設計的DHV-I的引物,對DHV-I標準株和Fujian2015通過RT-PCR進行目的片段擴增。Fujian2015的擴增片段經(jīng)測序后與NCBI上的DHV-I標準株進行序列對比,證實Fujian2015的擴增片段為DHV-I中的一段基因(圖4),根據(jù)此結果進行病毒的全基因測序。
圖4 DHV-I的PCR鑒定Fig. 4 PCR identification on DHV-I
2.5 DHV-I全基因測序及分析
全基因序列測序后獲得該病毒的基因全長為7654 bp,將擴增的病毒全基因序列與NCBI中的DHV序列比對,發(fā)現(xiàn)僅能與DHV-I型全基因組序列重合,不能與DHV-Ⅱ型和DHV-Ⅲ型重合,因此確定為I型DHV。將其與12株亞洲地區(qū)報道的已知DHV-I毒的進行核苷酸同源性分析,結果如圖5所示,該分離病毒核苷酸與毒株DQ226541.1有很高的同源性,高達99.4%。VP1氨基酸序列進化樹分析如圖6所示,該分離病毒VP1氨基酸序列與其他DHVI的VP1氨基酸序列比較,與毒株DQ226541.1和HQ232303.1親緣關系較近。運用SnapGene軟件將該病毒與12株已知DHV-Ⅰ型病毒的VP1氨基酸序列進行比對分析顯示,該毒株的VP1氨基酸序列有3個位點與其他大多數(shù)毒株具有一定差異性(表1)。

圖5 病毒全基因組序列同源性分析Fig. 5 Homology of genome-wide sequences of isolated virus
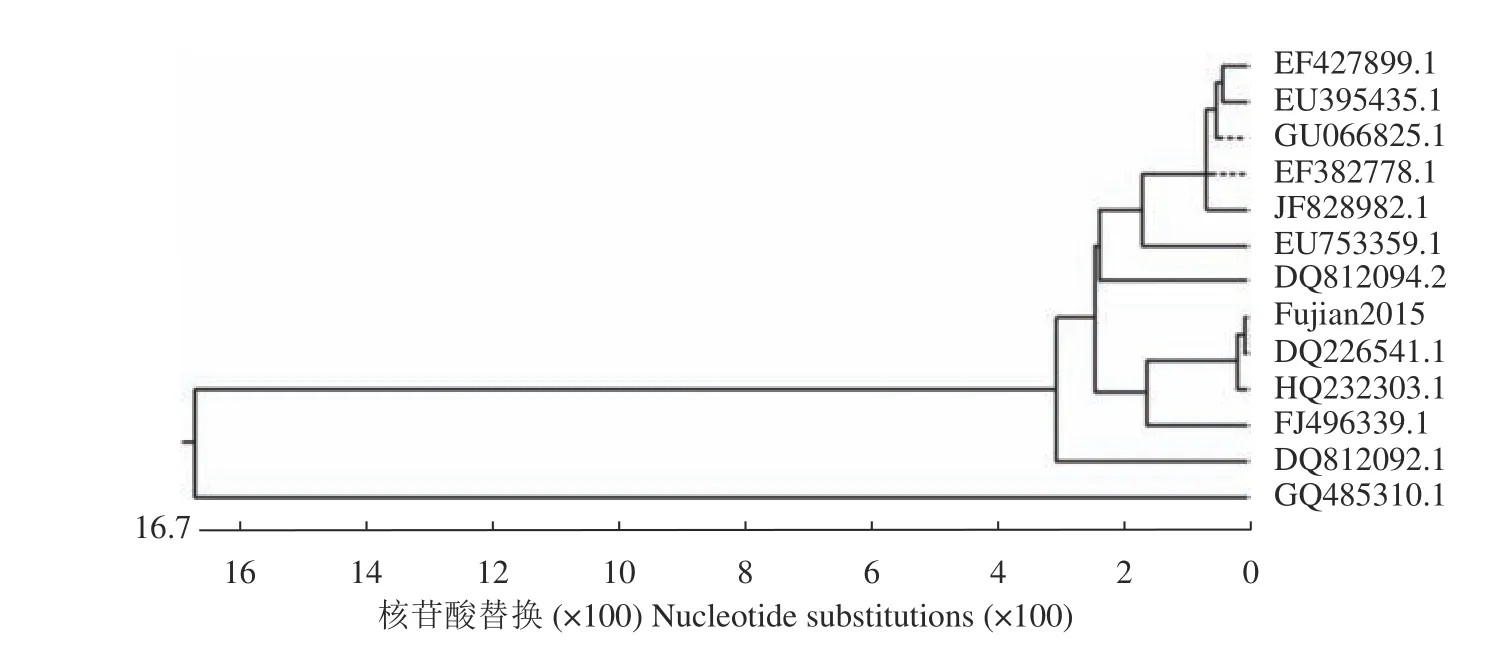
圖6 VP1氨基酸序列進化樹分析Fig. 6 VP1 amino acid sequence evolutionary trees

表1 分離的病毒與部分DHV毒株的VP1氨基酸序列比對Table 1 VP1 amino acid sequences of isolated and partial DHV viruses
2.6 VP1基因的克隆
用設計的特異性引物進行目的基因的擴增,并通過瓊脂糖凝膠電泳檢測。在圖7中,擴增片段約為700 bp(VP1基因為714 bp),與預期的片段相符。

圖7 VP1基因PCR擴增Fig. 7 PCR amplification of VP1
2.7 重組質(zhì)粒pGEX-4T-1-VP1的構建與酶切鑒定
使用限制性內(nèi)切酶BamH I和SalI對重組質(zhì)粒進行雙酶切,結果表明重組質(zhì)粒pGEX-4T-1-VP1構建成功。圖8為重組質(zhì)粒pGEX-4T-1-VP1的雙酶切鑒定結果,雙酶切后目的片段大小與預期相符(714 bp)。鑒定正確的重組質(zhì)粒送擎科公司測序。

圖8 重組質(zhì)粒pGEX-4T-1-VP1的酶切鑒定Fig. 8 Restriction digestion on recombinant plasmid pGEX-4T-1-VP1
2.8 重組蛋白GST-VP1的誘導表達
重組質(zhì)粒pGEX-4T-1-VP1表達產(chǎn)物即融合蛋白GST-VP1,是在37 ℃、0.5 mmol·L-1IPTG、180 r·min-1的條件下誘導6 h后獲得的。圖9中,用SDS-PAGE檢測相同條件下空載體pGEX-4T-1誘導前后的表達產(chǎn)物和重組質(zhì)粒pGEX-4T-1-VP1誘導前后的表達產(chǎn)物,結果顯示pGEX-4T-1-VP1誘導后的表達產(chǎn)物出現(xiàn)約52 kDa的條帶,與預期相符,融合蛋白GSTVP1誘導表達成功。

圖9 融合蛋白GST-VP1的SDS-PAGE分析Fig. 9 Fusion protein GST-VP1 by SDS-PAGE
2.9 重組蛋白的Western-blotting分析
將誘導后的空載體pGEX-4T-1和重組蛋白GSTVP1進行SDS-PAGE電泳后,轉移至NC膜上進行Western-blotting分析,結果(圖10)顯示融合蛋白GST-VP1可與抗GST標簽鼠單克隆抗體發(fā)生反應,特異性條帶大小約52 kDa,而誘導后的空載體pGEX-4T-1與抗GST標簽鼠單克隆抗體發(fā)生反應,特異性條帶大小約25 kDa,與預期相符。該結果再次驗證了融合蛋白GST-VP1表達正確。

圖10 融合蛋白GST-VP1的Western-blotting分析Fig. 10 Western-blotting on fusion protein GST-VP1
2.10 制備的VP0和VP1多抗血清的Western-blotting分析
用重組質(zhì)粒pGEX-4T-1-VP1的表達產(chǎn)物即融合蛋白GST-VP1作為抗原制備兔源多抗血清,將獲取的血清稀釋后作為一抗與感染鴨肝臟組織蛋白樣品和H9N2感染的A549細胞反應,結果表明,多抗血清不與H9N2感染的A549細胞反應,僅與DHV感染的鴨肝臟反應,特異性條帶大小約為26 kDa,用NP抗體與相同樣本反應,結果顯示NP蛋白可與H9N2感染的A549細胞反應(圖11),與預期相符,說明制備的VP1多抗血清可特異性識別感染鴨肝臟中DHV表面的VP1抗原。

圖11 VP1多抗血清的Western-blotting分析Fig. 11 Western-blotting on poly-antiserum against VP1
3 討論與結論
DVH在我國許多養(yǎng)鴨地區(qū)均有不同程度的發(fā)生和流行,一旦發(fā)病,傳播速度快,死亡率高,給我國養(yǎng)殖業(yè)造成巨大的經(jīng)濟損失[14]。近年來快速發(fā)展的鴨只養(yǎng)殖行業(yè),不斷增大的集約化密集養(yǎng)殖力度,DHV-I型暴發(fā)日齡的提前和疫情規(guī)模的增大等多種因素促使生產(chǎn)上急需有效的防治技術,因此了解DHV-I型的病原性特點和流行規(guī)律,研究相應有效的防治技術十分必要[15]。
由于DHV-I型結構蛋白P1位于暴露在外部環(huán)境的衣殼表面,易被宿主作為免疫應答靶向蛋白,而其VP1蛋白基因編碼了主要的抗原位點,在決定病毒抗原性中發(fā)揮重要作用,因此VP1蛋白基因是預防DVH的基因工程苗的重要基因之一[16]。VP1包含多個刺激B和T淋巴細胞誘導反應的中和抗原表位,并誘導體內(nèi)保護性抗體的產(chǎn)生,可用作檢測病毒感染的可靠指標。針對這一特性,可通過檢測抗VP1蛋白的血清抗體來監(jiān)測DHV-I的中和抗體水平[17]。
本試驗對一養(yǎng)殖場發(fā)生的疑似DVH的病鴨進行了病毒分離鑒定、全基因測序并分析了其血清型,為補充DHV的基因庫及研究DVH的流行規(guī)律提供一定的理論依據(jù)。目前針對DHV-I的檢測方法主要有RT-PCR、酶聯(lián)免疫吸附試驗和中和試驗。本研究使用的檢測方法為RT-PCR擴增基因序列,與酶聯(lián)免疫吸附試驗和中和試驗相比,本試驗采用的方法更加穩(wěn)定,而且可以確定毒株來源。本研究成功構建了重組質(zhì)粒pGEX- 4T-1-VP1,并建立了融合蛋白GST-VP1的高效表達體系。經(jīng)SDS-PAGE和Westernblotting檢測,表達的融合蛋白GST-VP1以包涵體的形式存在,蛋白分子量約為52 kDa。用該蛋白制備兔源多抗血清,Western-blotting檢測結果顯示VP1多抗血清能夠特異性地識別病毒的VP1蛋白,證實了VP1蛋白具有良好的抗原性,說明了VP1多抗血清可用于VP1蛋白表達的特異性檢測,可作為病原學診斷的有效補充,為鴨肝炎疫病的防控提供參考[18]。

