土壤不同消毒方式對百合根際真菌群落的影響
方少忠,郭文杰,鄭益平,張 潔,楊成龍,黃永旺,林智敏
(1. 福建省農業科學院生物技術研究所,福建 福州 350003;2. 福建省南平市延平區大橫鎮政府農技站,福建 南平 354200)
0 引言
【研究意義】根際微生物種類眾多,是連結植物根系與土壤的狹窄區域,是影響許多生物生長的活躍界面,也是地球上最復雜的生態系統之一[1]。根際的生物種類主要包括細菌、真菌、卵菌、線蟲、原生動物、藻類、病毒、古細菌和節肢動物[2-3]。根際生物主要分為兩個類群:其中一類與植物健康生長有關,主要是固氮菌、菌根真菌、促生菌、生防菌、真菌;另一類是不利于植物健康生長的根際生物,包括病原真菌、卵菌和細菌[4]。此外,土壤真菌在土壤養分循環與陸地生態系統中起著至關重要的作用[5]。一方面,植物的豐富度和植被蓋度直接影響了土壤真菌和真菌對土壤養分的吸收[6],另一方面土壤性狀,包括土壤理化性質、土壤營養成分和一些微量元素,有利于土壤以真菌為主的網狀結構形成,即土壤真菌群落[7]。單一栽培品種在農業生態系統中對真菌多樣性的影響是一個普遍現象[8-9],連續種植的百合容易引起土壤真菌病害的發生[10]。百合通常3年種植才收獲或常年種植切花,容易產生土傳病害。已經報道的百合真菌性病害有22種[11],主要是枯萎病、灰霉病、葉枯病、根腐病,其中枯萎病屬真菌性的土傳病害,由尖孢鐮刀菌和茄腐鐮刀菌侵染引起,對百合植株的危害十分嚴重,很大程度影響了百合切花的質量和產量[12]。因此通過土壤消毒方式,改變百合土壤真菌群落生態,從而防治百合真菌病害,具有重要意義。【前人研究進展】近年來,高通量測序技術已應用于土壤根際微生物的多樣性研究。研究學者以植物種質根際細菌群落的分布以確定核心微生物的組成,通過焦磷酸測序16S rRNA分析土壤根際和內生根室的細菌片段,獲得土壤不同類型的群落[13]。2010年Bates等[14]選取146份土壤樣本,篩選出一套通用的引物幾乎區分開所有的細菌和古生菌類群。1990年White等[15]通過PCR方法擴增真菌的ITS序列進行聚類分析。利用非化學手段處理作物土壤以降低真菌病害,已有相關報道。El-Gali等[16]對扁豆苗圃苗床土壤以熱水消毒,土壤的尖孢鐮刀菌、茄病鐮刀菌和腐霉的繁殖體大大減少;張春怡[17]等采用熏蒸材料土壤消毒結合微生物菌劑處理,高通量測序顯示能顯著降低根際真菌Ace、Chao和Shannon指數,茄子黃萎病得到有效防控;胡洪濤等[18]采用棉隆消毒土壤,對甘藍根腫病的防效達91.56%,高通量測序結果有15個屬的真菌豐度發生顯著改變。【本研究切入點】采用高通量測序技術,探討土壤不同消毒方式對百合根際真菌群落的影響,篩選出抑制百合有害真菌病原且提高有益真菌的方法,尚待深入研究。【擬解決的關鍵問題】本研究以福建南平延平百合基地根際土壤為研究對象,采用Illumina Miseq高通量測序技術對真菌V3~V5區和ITS1區片段進行測序,對根際土壤的真菌群落多樣性分析,結合田間棉隆、熱水和乙醇處理對應的效果,獲得有效解決百合連作問題的物理或化學途徑,并從分子水平揭示百合根際土壤真菌群落的多樣性和滋生特點,以期為百合根際土壤真菌的良性生態構建提供一定的理論參考。
1 材料與方法
1.1 試驗地概況
試驗位于福建省南平市延平區王臺鎮羅源村南平市興一春百合園藝有限公司百合基地,屬中亞熱帶海洋季風氣候,年均氣溫17.3 ℃,年降水量1669 mm。試驗地土壤類型為紅壤,0~10 cm土層的基本理化性質:pH 5.2,有機質15.3 g·kg-1,堿解氮66.1 mg·kg-1,速 效磷54.2 mg·kg-1,速效鉀269 mg·kg-1,全氮 800 mg·kg-1,全磷 450 mg·kg-1,全鉀 39.9 g·kg-1。
1.2 試驗設計
試驗地百合種球均經過夏季采收后(5~7月)長達2個月的傳統漫灌淹浸過程,排水晾干,于2019年12月11日開始種植(種植時間安排依據南平地區農戶每年百合種球切花種植時間)。選取常年種植百合品種木門(ConcaD’or)的地塊,設置4個處理:①棉隆處理(F、J、N),每塊小區取98%棉隆微粒劑150 g與土壤攪拌均勻,覆蓋不透氣的塑料膜,用開溝壓邊法(內側壓土)密封好四邊,塑料膜覆蓋半個月后,再掀膜透氣半個月后再種球;②熱水處理(D、H、L),每塊地灌入50 ℃熱水后薄膜覆蓋保持土壤溫度;③乙醇處理(E、I、M),每塊小區噴施2%乙醇10 kg,用塑料膜覆蓋半個月后,再掀膜透氣;④對照組CK(G、K、O)。試驗地四周設有保護行,每個處理3個小區,總共12塊小區,每塊小區1.2 m×3 m,隨機分布。種球圍徑14~16 cm,每個小區種植10行,每行9粒球,球間距15 cm,種植深度15 cm。
1.3 研究方法
1.3.1 樣本采集 樣本采集于2020年1月、3月和4月,在4個不同處理組中進行,按照五點取樣法,采集表層土壤(0~15 cm)共計1 kg左右,每個樣地設3個樣方。土壤取樣分為3個時期:1)幼苗期(D、E、F、G):百合植株長到10 cm左右進行一次取樣;2)現蕾期(H、I、J、K):百合植株開始現蕾時進行第二次取樣;3)成花期(L、M、N、O):百合花苞開始采摘時進行第三次取樣。土壤樣品過4目篩后分成2份,保存于4 ℃冰箱。
1.3.2 DNA提取和Illumina測序 土壤微生物總DNA采 用PowerSoil Kit (MoBio Laboratories Carlsbad,CA, USA)試劑盒提取, DNA用NanoDrop ND-1000分光光度計分析(Thermo,USA),質量濃度為20 ng·μL-1,質量合格的DNA儲存于-20 ℃用于后續分析。
1.3.3 序列分析和真菌鑒定 標準真菌ITS測序引物:上游引物ITS5F:5′-GGAAGTAAAAGTCGT AACAAGG-3′,下游引物ITS1R:5′-GCTGCGTTC TTCATCGATGC-3′。PCR擴增體系(25 μL):5×reaction buffer 5 μL,5×GC buffer 5 μL,dNTP(2.5 mmol·L-1) 2μL,ITS5F( 10μmol·L-1)1μL,ITS1R(10 μmol·L-1)1 μL,DNA Template 2 μL,ddH2O 8.75 μL,Q5? High-Fidelity DNA Polymerase 0.25 μL。反應程序:預變性98 ℃ 2 min;變性 98 ℃15 s,退火 55 ℃ 30 s,延伸 72 ℃ 30 s,25~30個循環;再延伸72 ℃ 5 min, 10 ℃保溫。擴增產物280 bp大小,PCR產物用VAHTSTM DNA磁珠純化(諾維贊,南京),并用Quant-iT PicoGreen dsDNA檢測試劑盒定量(Invitrogen,美國)對PCR產物在Microplate reader (BioTek,FLx800)上進行定量。
1.3.4 試驗上機流程 整個上機流程包括PCR的擴增、PCR產物的混樣、純化,文庫的構建和上機測序流程由上海派森諾生物科技股份有限公司完成。本試驗中,基于Illumina MiSeqPE250測序平臺,利用雙末端測序的方法對16S rDNA 高變區V3~V5區和ITS1區域進行測序。生物信息學分析依據QIIME22019.4。
1.4 數據處理與分析
在相似性 97%的水平上對 Tags 序列進行聚類(USEARCH,version 10.0),以測序所有序列數的0.005%作為閾值過濾 OTU,進行組間差異顯著性(LEfSe)分析,alpha 指數、Beta 多樣性分析[19]。
2 結果與分析
2.1 不同處理對百合幼苗期生長發育的影響
如圖1所示,通過棉隆、熱水和乙醇處理,對幼苗期百合的生長性狀觀察,與CK對照組(圖1d)相比,熱水處理(圖1c)植株生長農藝性狀較為一致,且株高最高,其次為乙醇(圖1b)和CK對照,而經棉隆處理(圖1a)的百合在生長的幼苗期生長緩慢,受到棉隆的抑制。

圖1 不同處理百合幼苗期田間生長性狀Fig. 1 Growth of Lilium seedlings after treatments
2.2 不同處理土壤真菌群落多樣性
如圖2所示,經過質量控制后,總共得到472440 條高質量序列(每個樣品23488~59592條序列)(圖2a), 410 個OTU(每個樣品 378~471個OTU),這些OTU歸屬于 13 個門,22 個綱,16個目,11個科,47個屬和85個種(圖2b)。
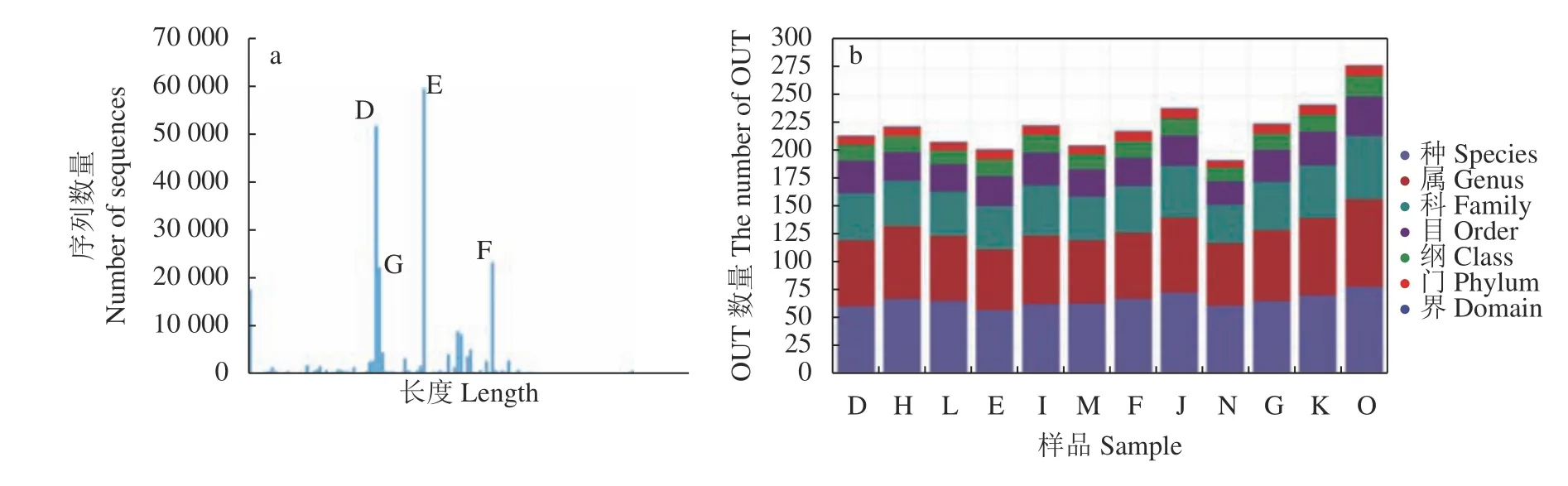
圖2 不同處理對百合真菌群落多樣性的影響Fig. 2 Effect of disinfection on fungal community diversity of Lilium rhizosphere soil
2.3 不同處理土壤真菌物種分類統計
由圖3可看出,各組樣品優勢菌屬主要分布在被孢霉門(Mortierellomycota)、子囊菌門(Ascomycota)、擔子菌門 (Basidiomycota) 、毛霉門(Mucoromycota)、絲足蟲類 (Cercozoa) 、壺菌門(Chytridiomycota)、Aphelidiomycota、羅茲菌門(Rozellomycota)、浮霉菌門(Blastocladiomycota)、蛙糞霉門 (Basidiobolomycota)和捕蟲霉門(Zoopagomycota)。其中子囊菌門相對豐度最高,其次是擔子菌門。4個處理組分別都是子囊菌門>擔子菌門>被孢霉門,其中熱水處理組在成花期時被孢霉門增至20.94%,變化幅度最大;棉隆組在現蕾期和成花期時擔子菌門下調幅度最大。
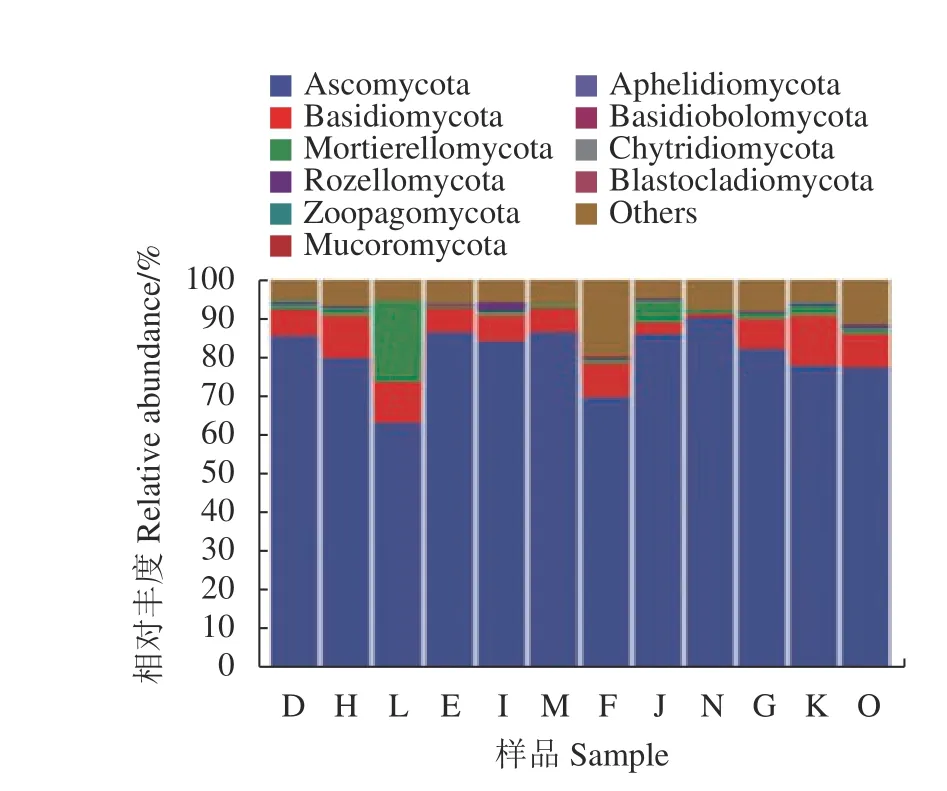
圖3 不同處理土壤真菌的相對豐度Fig. 3 Relative abundance of fungi genera in soils
2.4 不同處理土壤間有差異的真菌物種分析
從圖4縱向聚類結果看,不同處理在屬分類水平上主要是青霉菌屬(Penicillium)、籃狀菌屬(Talaromyces)、沙蜥屬(Saitozyma)、海洋真菌(Westerdykella)距離較近,枝長較短;緊密帚枝霉(Sarocladium)、球腔菌屬(Mycosphaerella)、核果褐腐病菌(Monilinia)、榛色鉤囊菌(Hamigera)距離較近,枝長較短;綠藻源真菌(Acremonium)、被孢霉菌(Mortierella)距離較近;酵母屬(Remersonia)、嗜熱真菌屬(Mycothermus)距離較近;微囊菌屬(Microascus)、金孢屬(Chrysosporium)、寄生屬(Hypomyces)距離較近;月狀彎孢霉(Curvularia)、鐮刀菌(Fusarium)、闊足柄孢殼菌(Zopfiella)、麹菌(Aspergillus)距離較近;說明這些菌群在各樣品中組成較相似。
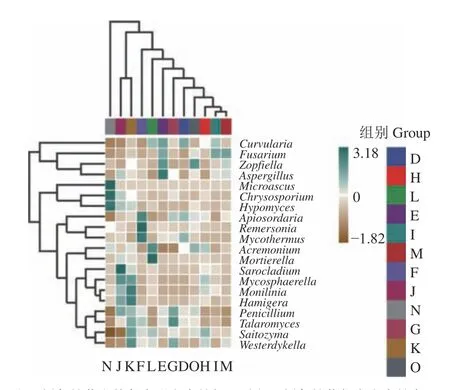
圖4 不同處理組真菌差異物種相對豐度熱圖Fig. 4 Heat map of fungi relative abundance in soils
根據 OTU 豐度進行聚類分析,評判百合不同發育時期在屬水平上群落結構的差異性和相似性。結果表明,3個發育階段的優勢菌群存在明顯差異。在百合幼苗期主要的優勢菌是熱鏈球菌屬(Mycothermus)、酵母屬(Remersonia)、曲霉屬(Aspergillus)和子囊菌(Zopfiella);現蕾期優勢菌是海洋真菌(Westerdykella)、鉤囊菌(Hamigera)、鏈核盤菌屬(Monilinia)和鑲刀菌屬(Fusarium);成花期優勢菌是被孢霉屬(Mortierella)、寄生菌屬(Hypomyces)、金孢子菌屬(Chrysosporium)和微囊菌屬(Microascus)。此外,3個不同處理組之間在3個百合發育階段的菌群變化也較為明顯,其中棉隆處理菌群變化較大,后期主要是引起寄生菌屬(Hypomyces)、金孢子菌屬(Chrysosporium)和微囊菌屬(Microascus)的增加,在百合生長期內主要病原菌鑲刀菌屬(Fusarium)豐度一直維持在低水平,而益生菌酵母屬(Remersonia)同時受到抑制,豐度不斷下降;熱水處理后期被孢霉屬(Mortierella)、酵母屬(Remersonia)增加;乙醇處理后期主要是引起曲霉屬(Aspergillus)和子囊菌(Zopfiella)減少;空白對照組后期主要是子囊菌(Zopfiella)增加。
根腐病菌和青霉菌屬是引起百合地下根腐和基腐病的2個主要病原菌。高通量測序結果如圖5所示,3種處理和對照組之間百合主要的2種病原菌根的發生規律是不同的,2種病原菌占全部真菌比例(百分比)存在明顯差異。乙醇在各個階段中這2種病原菌的百分比含量基本保持不變,而CK組是隨著生長發育過程,2種病原菌也同樣滋生生長,而熱水處理和棉隆處理組中2種病原菌隨著生長發育不斷減少,尤其在成花期時基本消失。
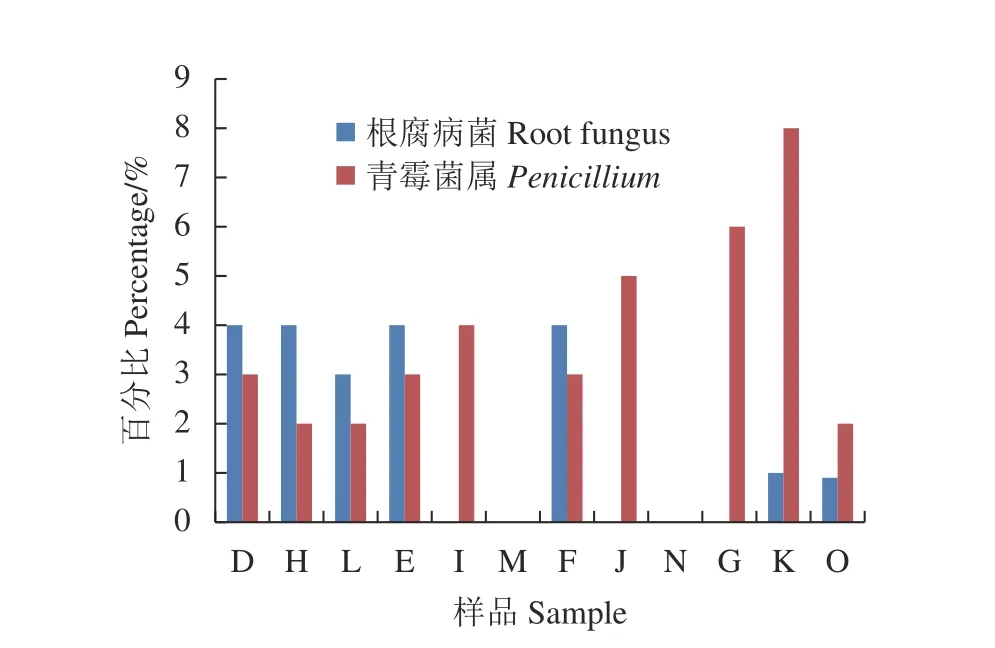
圖5 3個不同生長階段中2種主要病原菌的百分比變化Fig. 5 Changes on proportion of 2 major pathogens at 3 Lilium growth stages
2.5 基于OTUs的主坐標分析及樣品間的NMDS分析
由圖6可知,進一步基于樣本OTU水平的相異系數bray-curtis距離矩陣進行主坐標分析表明,熱水、乙醇和棉隆處理組真菌群落結構與CK差異顯著(P<0.01),第一主成分解釋了群落結構差異的53.2%,第二主成分解釋了群落結構差異的20.1%(圖6a);熱水處理組、乙醇處理組、棉隆處理組和CK組距離較遠,相似性低,差異程度大(圖6b);各處理均能顯著改變真菌群落結構。
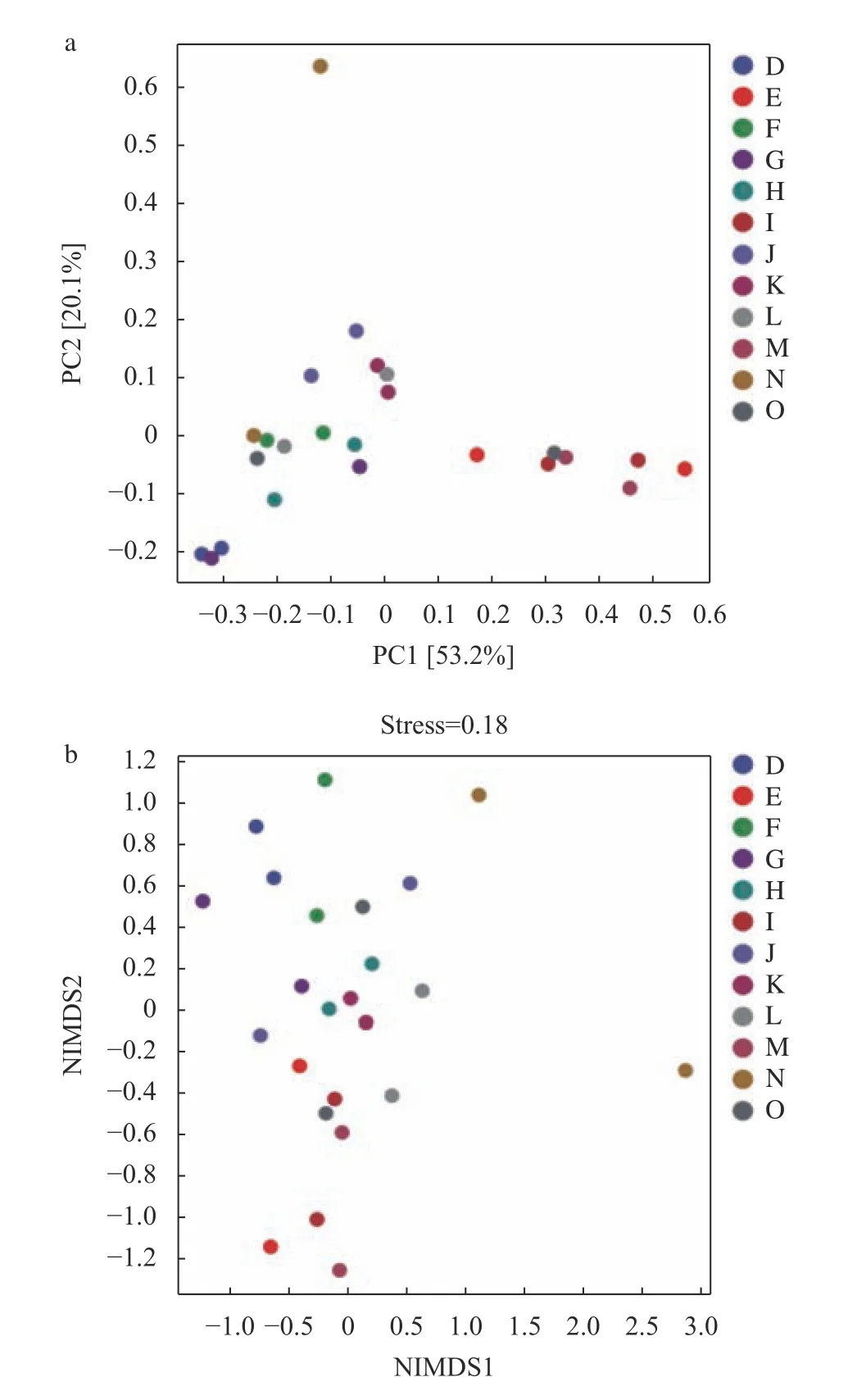
圖6 不同處理真菌菌群主坐標及NMDS分析Fig. 6 Principal coordinates and NMDS analyses on fungal community under different treatments
3 討論與結論
百合作為一種經濟價值很高的園藝植物,除了鮮花百合,還有食藥用百合。國內百合種植主產區分布于福建、廣東、云南、甘肅及江西等地,各地隨著常年重茬,百合病害發生不斷擴大,其中最為主要的是真菌性病害[20]。百合系列品種,不管是北方還是南方,通常種植在溫室大棚中,因多年連作,真菌病害相對嚴重,主要是絲核菌、疫霉菌和腐霉菌等[21];此外,通過系統調查研究表明,福建省百合真菌病害(12種)主要包括炭疽病、灰霉病、曲霉病、枯萎病等[22]。由于真菌病害在發病潛伏期和初期在地上部很難通過肉眼觀測分析,因此百合通常連作障礙克服方法包括:農業防治、化學防治和生物防治方法[23],例如:采取倒茬輪作、土壤改良、生防菌和土壤消毒等措施進行有效的防治研究。
研究表明,連作會影響設施栽培百合土壤中益生菌與致病菌群間的平衡關系,易形成連作障礙[24]。百合根際土壤微生物種類和數量因其不同的生長發育階段和品種的差異而改變[25]。本文中通過真菌物種分類分析表明,4個組別中土壤的優勢菌在不同生育期都發生變化,尤其是熱水處理在百合成花期被孢霉門提高至20.94%,此外,棉隆處理在現蕾期和成花期擔子菌門下調最為明顯;2種病原菌(根腐病菌和青霉菌屬)隨著生長發育過程,在成花期階段不發生。同時熱水處理對百合植株的田間農藝性狀表現最好,不僅生長速度一致,而且幼苗期生長快速,棉隆處理雖然后期對病原菌具有抑制作用,但幼苗期生長緩慢,后期完全恢復,說明棉隆的殘留致使前期植株生長受到一定抑制。雖然先前研究對百合重茬的藥效試驗結果也表明棉隆效果最佳[26],但建議利用棉隆進行克服連作障礙的處理,應該還要考慮棉隆殘留影響和中后期益生菌等配合使用為優。
土壤類型是影響真菌種群的重要因素之一,對土壤真菌物種豐度、Alpha多樣性、Beta多樣性均有顯著影響[27]。相比于傳統的微生物平板培養法和生物標記法等土壤微生物研究方法,高通量測序技術可以解決無法培養的土壤微生物菌群,覆蓋度更高,多樣性和豐富度更好[28]。通過土壤真菌群落多樣性分析表明,OUT數量、物種數目、真菌的多樣性和豐富度很高。總真菌群落存在差異,棉隆處理(F)最高,空白對照(G)次之,熱水處理與乙醇處理菌落數量差異不大。4個組別中子囊菌門相對豐度最高,是絕對的優勢菌群,其次是擔子菌門和被孢霉門。如熱水處理后期引起被孢菌屬增加,研究表明被孢霉菌株將可能顯著提高了土壤可溶性有機碳[29];其次,酵母屬可能對土壤修復起一定的作用[30],所以推測這些益生真菌滋生可能與熱水處理之間有一定的關聯。
本研究結果表明,通過對百合土壤的不同方法處理,各組土壤根際微生物發生了顯著變化,除棉隆處理外,熱水處理和乙醇處理相對空白對照總菌群數減少。在真菌群落組成中,土壤根際真菌主要以子囊菌門為主,熱水處理不僅降低了有害菌(根腐病菌和青霉菌屬),而且提高了有益菌被孢霉門和酵母屬,促進了百合在幼苗期的良好生長,從研究角度上看,它是解決百合連作障礙的一條有效物理防治方法。但考慮到熱水處理在南方地區的田間推廣難度大,可操作性差,因此,建議棉隆應充分解除殘留后,增施有益菌是最為有效快速解決連作障礙的方法。

