微桿菌XL1胞外多糖發酵條件優化及其活性研究*
吳 丹,張 巖,徐海洋,徐淋香,3**
(1.江蘇海洋大學,江蘇連云港 222005;2.江蘇省海洋生物資源與環境重點實驗室,江蘇連云港 222005;3.江蘇省海洋生物產業技術協同創新中心,江蘇連云港 222005)
0 引言
多糖是由十種或十種以上單糖通過糖苷鍵連接而成的聚合物,廣泛分布于自然界中,具有十分重要的地位。微生物胞外多糖是細菌、真菌和藻類分泌到細胞壁外,且在生命活動中發揮重要作用的天然大分子[1]。與動植物多糖相比,微生物胞外多糖不受地理位置、周圍環境的影響,可大規模工業化發酵,并具有成本低、易提取、無毒、安全性高等優點[2,3]。近年來,人們對微生物胞外多糖進行廣泛而深入的研究,探索胞外多糖的多種生物學功能,包括去除和吸收重金屬離子[4,5]、抗氧化[6,7]、抗腫瘤[8,9]、抗炎[10]、抑制黑色素形成[11]和益生元活性[12]等方面。目前,胞外多糖已在醫藥和食品工業中展現出巨大的應用潛力。在醫藥領域中,由LactobacillussakeiProbio 65[13]產生的胞外多糖可通過抑制酪氨酸酶活性來減少黑色素的生成,進而降低黑色素瘤的發生率[14,15];胞外多糖還可為抗腫瘤藥的制備提供支持,如膠紅酵母胞外多糖組分REPS2-A能有效抑制肝癌細胞的增殖,誘導肝癌細胞Hep G2凋亡[16]。在食品工業中,經黃單胞桿菌發酵生成的黃膠原是一種應用廣泛的胞外多糖,它可作為增稠劑、乳化劑、懸浮劑等添加在乳制品、飲料制品、調味品中,以提高食品穩定性及品質[17]。目前,有少數學者對微桿菌屬(Microbacteriusp.)胞外多糖進行研究,例如MicrobacteriumTL13產生的胞外多糖能夠吸附鉻、銅、鎳和鈷等重金屬離子,具有生物修復重金屬污染廢水和土壤的潛力[18];產自海洋MicrobacteriumFSW-25的胞外多糖具有比黃原膠更高的抗氧化活性,可作為一種潛在的抗氧化劑[19]。但相對而言,目前對微桿菌屬發酵產胞外多糖活性的研究仍然較少。
本研究采用來源于中國連云港水灣濕地的一株微桿菌XL1發酵產胞外多糖。首先通過單因素法優化產胞外多糖的培養基成分和發酵條件;然后,探究微桿菌XL1胞外多糖的吸濕保濕性能、抗氧化活性以及抑制酪酸酶活性。本研究旨在豐富微桿菌胞外多糖活性研究,為微桿菌XL1胞外多糖在化妝品和食品行業的應用提供理論依據,并為將來開展胞外多糖的結構表征、功能機制等研究奠定基礎。
1 材料與方法
1.1 材料
菌株:微桿菌XL1篩選于中國連云港水灣濕地。
試劑:FeSO47H2O、K2PO4、MgCl2、蔗糖、瓊脂粉、酵母提取物、氯仿、正丁醇、葡萄糖、果糖、麥芽糖、胰蛋白胨、尿素、硫酸銨、殼聚糖、甘油、透明質酸、碳酸鉀、無水乙醇、H2O2、FeCl2、EDTA、磷酸二氫鈉、磷酸氫二鈉購自上海國藥集團化學試劑有限公司,維生素C (Vc)、水楊酸、菲洛嗪、酪氨酸酶、左旋多巴、曲酸購自上海阿拉丁生化科技股份有限公司。
儀器:1510酶標儀(賽默飛世爾科技有限公司),SPX-150B-Z生化培養箱(上海博訊實業有限公司),M1282-0006恒溫振蕩器[艾本德(上海)國際貿易有限公司],JXN-26高速離心機(美國貝克曼庫爾特有限公司),101A-3數顯電熱鼓風干燥箱(上海卓爵儀器有限公司),HH-4智能數顯恒溫水浴鍋(鞏義市予華儀器有限責任公司)。
1.2 方法
1.2.1 種子液制備
將微桿菌XL1接種到固體培養基(FeSO47H2O 0.01 g/L、CaCl20.1 g/L、K2PO41 g/L、MgCl20.15 g/L、NaNO33 g/L、蔗糖20 g/L,瓊脂粉15 g/L,pH值為7.0)中,于30℃培養箱培養2 d,從固體培養基上挑取單菌落接種于種子培養基中(FeSO47H2O 0.01 g/L、CaCl20.1 g/L、K2PO41 g/L、MgCl20.15 g/L、酵母提取物3 g/L、蔗糖20 g/L,pH值為7.0)中,250 r/min,30℃培養24 h。
1.2.2 胞外多糖的制備與提取
將種子液以4%的接種量接種于發酵培養基(FeSO47H2O 0.01 g/L、CaCl20.1 g/L、K2PO41 g/L、MgCl20.15 g/L、酵母提取物3 g/L、蔗糖50 g/L,pH值為7.0)中,在250 r/min、30℃條件下發酵24 h。發酵液于8 000 r/min離心30 min去除菌體后,加入兩倍體積無水乙醇,4℃攪拌過夜,再通過8 000 r/min離心15 min得到胞外多糖,放入鼓風干燥箱中60℃干燥至恒重,稱其質量。
1.2.3 胞外多糖中間層蛋白的去除
采用Sevag法[20]對胞外多糖初步提純,將Sevag液(氯仿∶正丁醇,V∶V=4∶1)與3%胞外多糖水溶液以體積比1∶1混合,劇烈振蕩30 min后,8 000 r/min離心15 min,去除中間層蛋白,重復3-4遍。使用BCA蛋白測定試劑盒測定蛋白含量[21],蛋白標準曲線為y=1.128 9x+0.126,R2=0.998 1。對純化后的胞外多糖進行吸濕保濕、抗氧化和抑制酪氨酸酶活性實驗。
1.2.4 微桿菌XL1胞外多糖發酵的單因素實驗
(1)碳源種類
將種子液以4%的接種量接種到含有5%不同碳源(蔗糖、葡萄糖、果糖、麥芽糖)的發酵培養基中,其他成分不變,在轉速為250 r/min、溫度為30℃、pH值為7的條件下發酵24 h,進行3次生物學重復,按1.2.2節的方法制備定量胞外多糖。
(2)氮源種類
將種子液以4%的接種量接種到含有0.3%不同氮源(酵母提取物、胰蛋白胨、尿素、硝酸鈉、硫酸銨)的發酵培養基中,其他成分不變,在轉速為250 r/min、溫度為30℃、pH值為7的條件下發酵24 h,進行3次生物學重復,按1.2.2節的方法制備定量胞外多糖。
(3)碳源含量
將種子液以4%的接種量接種到不同蔗糖含量(5%、10%、15%、20%、25%)的發酵培養基中,其他成分不變,在轉速為250 r/min、溫度為30℃、pH值為7的條件下發酵24 h,進行3次生物學重復,按1.2.2節的方法制備定量胞外多糖。
(4)氮源含量
將種子液以4%的接種量接種到不同酵母提取物含量(0.1%、0.2%、0.3%、0.4%、0.5%)的發酵培養基中,其他成分不變,在轉速為250 r/min、溫度為30℃、pH值為7的條件下,發酵24 h,進行3次生物學重復,按1.2.2節的方法制備定量胞外多糖。
(5)發酵溫度
將種子液以4%的接種量接種到發酵培養基中,在轉速為250 r/min、不同發酵溫度(10,15,20,25,30℃)、pH值為7的條件下發酵24 h,進行3次生物學重復,按1.2.2節的方法制備定量胞外多糖。
(6)培養基初始pH
將種子液以4%的接種量接種到不同初始pH(6,7,8,9,10)的發酵培養基中,在轉速為250 r/min、溫度為20℃條件下,發酵24 h,進行3次生物學重復,按1.2.2節的方法制備定量胞外多糖。
(7)發酵時間
將種子液以4%的接種量接種到發酵培養基中,在轉速為250 r/min、發酵溫度為20℃、pH值為8的條件下,發酵不同時間(8,16,24,32,40 h),進行3次生物學重復,按1.2.2節的方法制備定量胞外多糖。
1.2.5 吸濕、保濕性能測定
(1)樣品預處理
將1.2.3節制得的胞外多糖研成粉末,與殼聚糖、甘油和透明質酸一同放入鼓風干燥箱中60℃烘干至恒重,備用。
(2)吸濕性試驗
分別稱取0.2 g胞外多糖、殼聚糖、甘油和透明質酸,每種物品各6份,其中3份樣品放入有飽和碳酸鉀溶液(相對濕度為43%)的密閉容器中,另外3份樣品放入有飽和硫酸銨溶液(相對濕度為81%)的密閉容器中,分別稱取0,1,2,4,8,16,24 h時的樣品重量。根據公式計算吸濕率:
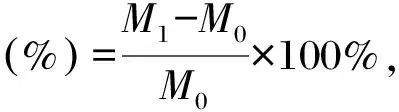
式中,M0為放入0 h樣品質量(g),M1為放入不同時間后樣品質量(g)。
(3)保濕性試驗
分別稱取0.2 g胞外多糖、殼聚糖、甘油和透明質酸,每種物品各3份,先放置于有去離子水溶液的密閉容器中24 h,然后將樣品放入有飽和碳酸鉀溶液的密閉容器中,分別稱取0,1,2,4,6,8 h時的樣品重量。根據公式計算保濕率:
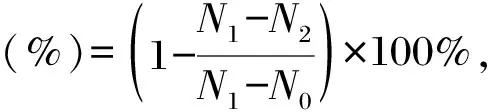
式中,N0為樣品最初質量(g),N1為放置在去離子水中24 h后樣品質量(g),N2為放置在飽和碳酸鉀溶液中不同時間的樣品質量(g)。
1.2.6 抗氧化活性測定
(1)清除DPPH自由基能力測定
取100 μL不同濃度(0,0.5,1,2,4,8,10 mg/mL)胞外多糖與100 μL 0.5 mmol/L 1,1-二苯基-2-三硝基苯肼(DPPH)溶液(無水乙醇配制)混勻,室溫避光反應30 min后,取100 μL反應液于96孔板中,在517 nm處測定吸光度值,平行測定3次[20],使用去離子水、Vc分別作為空白和陽性對照。根據公式計算DPPH清除率:
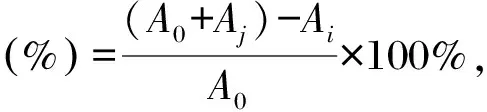
式中,A0為空白對照吸光度值,Ai為樣品溶液加DPPH溶液吸光度值,Aj為樣品溶液加無水乙醇吸光度值。
(2)清除羥基自由基能力的測定
測定方法參考文獻[22]。將9 mmol/L FeSO47H2O、9 mmol/L水楊酸(無水乙醇配制)、樣品溶液、8.8 mmol/L H2O2按體積比1∶1∶1∶1的比例混合,于37℃水浴15 min,取100 μL反應液于96孔板中,在510 nm處測定吸光度值,平行測定3次,使用去離子水、Vc分別作為空白和陽性對照。樣品溶液為不同濃度(0,0.5,1,2,4,8,10 mg/mL)的胞外多糖溶液。根據公式計算羥基自由基清除率:
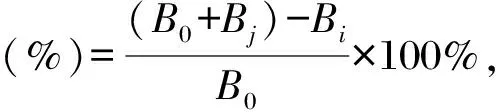
式中,B0為空白對照吸光度值,Bi為樣品吸光度值,Bj為去離子水代替H2O2溶液的吸光度值。
(3)鐵離子螯合能力測定
測定方法參考文獻[23]。向1 mL不同濃度(0.1,0.2,0.4,0.6,0.8,1.0 mg/mL)的胞外多糖溶液中加入0.1 mL 2 mmol/L的FeCl2溶液和0.2 mL 5 mmol/L的菲洛嗪試劑,室溫反應15 min后于562 nm處測定吸光度值,平行測定3次,使用去離子水、EDTA分別作為空白和陽性對照。根據公式計算螯合率:
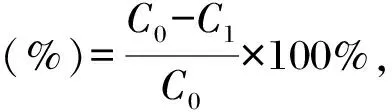
式中,C0為空白對照吸光度值,C1為樣品吸光度值。
1.2.7 酪氨酸酶抑制活性的測定
測定方法參考文獻[24]。取0.5 mL左旋多巴溶液(2 mmol/L)與0.4 mL磷酸鹽緩沖液(25 mmol/L,pH值為6.8)混合,加入不同濃度(0,2,4,6,8,10 mg/mL)的胞外多糖溶液,37℃孵育10 min后,加入0.05 mL酪氨酸酶液(500 U/mL),37℃孵育30 min后,于475 nm處記錄吸光值,平行測定3次,使用去離子水、曲酸分別作為空白和陽性對照。根據抑制率公式計算:
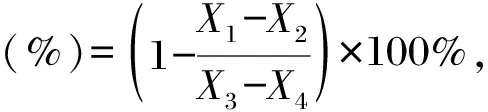
式中,X1為樣品吸光值,X2為樣品背景吸光值,X3為空白對照吸光值,X4為空白對照的背景吸光值。
1.3 數據處理
采用OriginPro 2018軟件進行數據處理和作圖。
2 結果與分析
2.1 多糖發酵的單因素實驗結果
不同發酵條件對微桿菌XL1胞外多糖產量的影響如圖1所示。從圖1a可以看出,幾種碳源中蔗糖對胞外多糖產量影響最為顯著,達到28 g/L,是以果糖(1.5 g/L)作為碳源的18倍,因此,蔗糖為最佳碳源。從圖1b可以看出,以酵母提取物、胰蛋白胨、尿素、硝酸鈉、硫酸銨為氮源的多糖產量分別為26,21.5,22.5,22,22 g/L,選擇產量最高的氮源,即酵母提取物為最佳氮源。接著分別優化了培養基中最佳碳氮源,即蔗糖和酵母提取物的最適添加量,分別為20%和0.3%(圖1c,d),蔗糖含量為20%時產量達到最高75 g/L。但此后隨蔗糖含量繼續增加,胞外多糖產量反而下降,這可能是由于培養基中蔗糖含量過高,導致菌體內外滲透壓失衡,其生長受到抑制。后續又優化了培養基的發酵溫度、初始pH以及發酵時間,微桿菌XL1在溫度為15-25℃(圖1e)時,多糖產量較高,其中在20℃條件下產量達到最高值80 g/L;該菌適合在中性偏堿的環境中大量產糖,在pH值為8 (圖1f)時達到最高,為91 g/L;發酵培養基中多糖產量隨發酵時間增加而增多(圖1g),在24 h達到最高值92 g/L,之后隨著發酵時間增加,多糖產量變化不大。因此,經過對發酵條件單因素優化后,得到最佳培養條件如下:蔗糖為碳源、酵母提取物為氮源、20%蔗糖、0.3%酵母提取物、溫度20℃、pH值為8.0、發酵時間24 h。
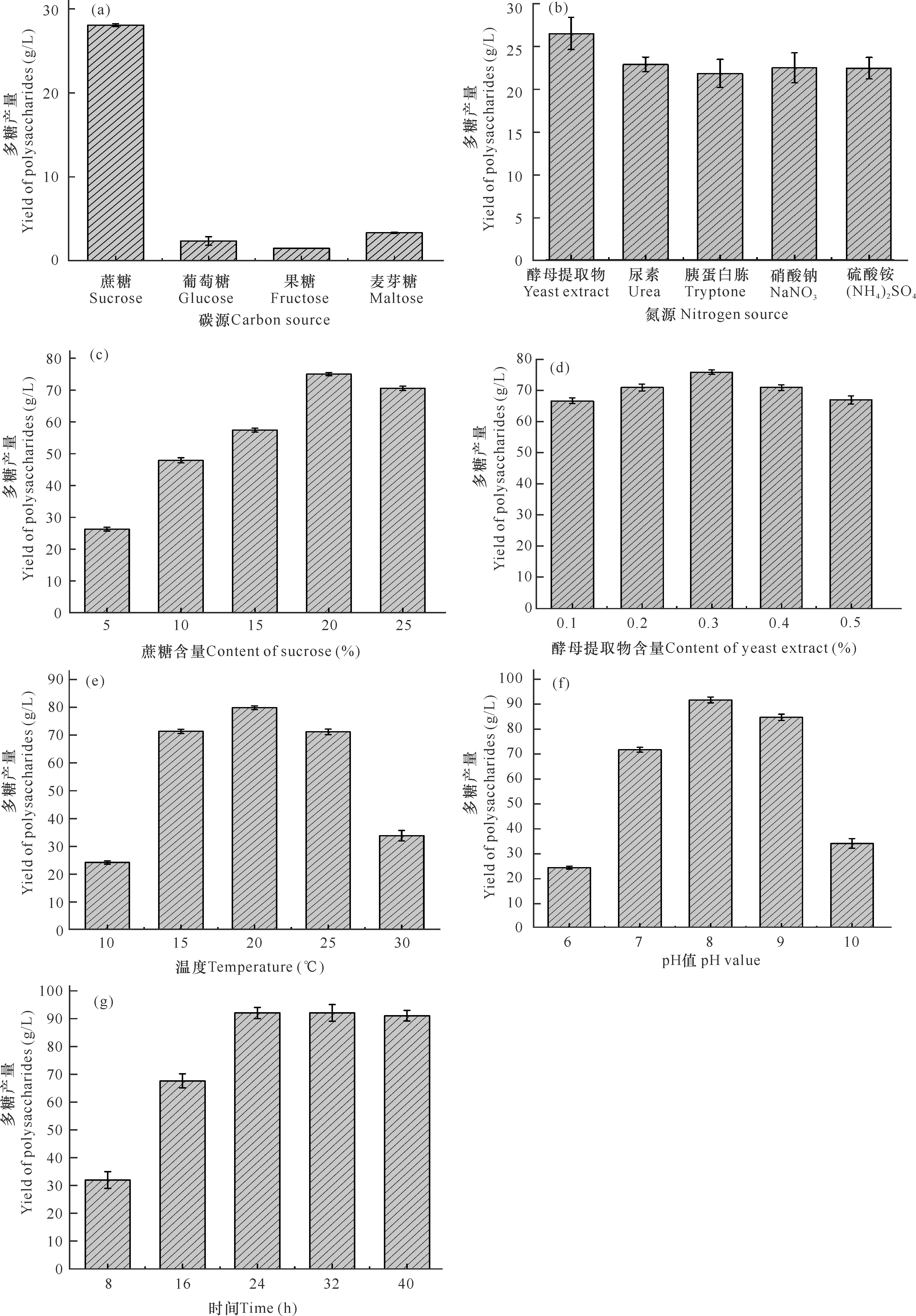
圖1 微桿菌XL1胞外多糖產量的單因素優化結果
2.2 吸濕保濕性能測定
在一定相對濕度(43%和81%)的密閉環境中,所有樣品的吸濕率都隨著時間增加而增大,但是,相對濕度越大,樣品在相同時間達到的吸濕率越高。在相對濕度為81%時,甘油吸濕率隨處理時間增加一直上升,并在24 h時達到73.16%,遠高于胞外多糖的25.38%;但此時胞外多糖的吸濕率比透明質酸、殼聚糖分別高出2.61%、10.18%(圖2a、b)。因此,雖然微桿菌XL1胞外多糖的吸濕性能比甘油差,但與透明質酸、甘油相比,仍具有良好的吸濕性能。
在保濕性能實驗中,利用相對濕度由高到低的變化,觀察樣品的保濕性能。在前2 h,胞外多糖、殼聚糖和透明質酸的保濕率均有一定幅度下降,其中,甘油的保濕率大幅度下降,失水速率遠超其他3種樣品;在2 h之后,各樣品的保濕率基本保持穩定(圖2c)。相比較而言,這4種樣品的保濕性能排序為殼聚糖>胞外多糖>透明質酸>甘油。因此,微桿菌XL1胞外多糖同樣具有較好的保濕性能,在化妝品行業具有廣泛的應用前景。
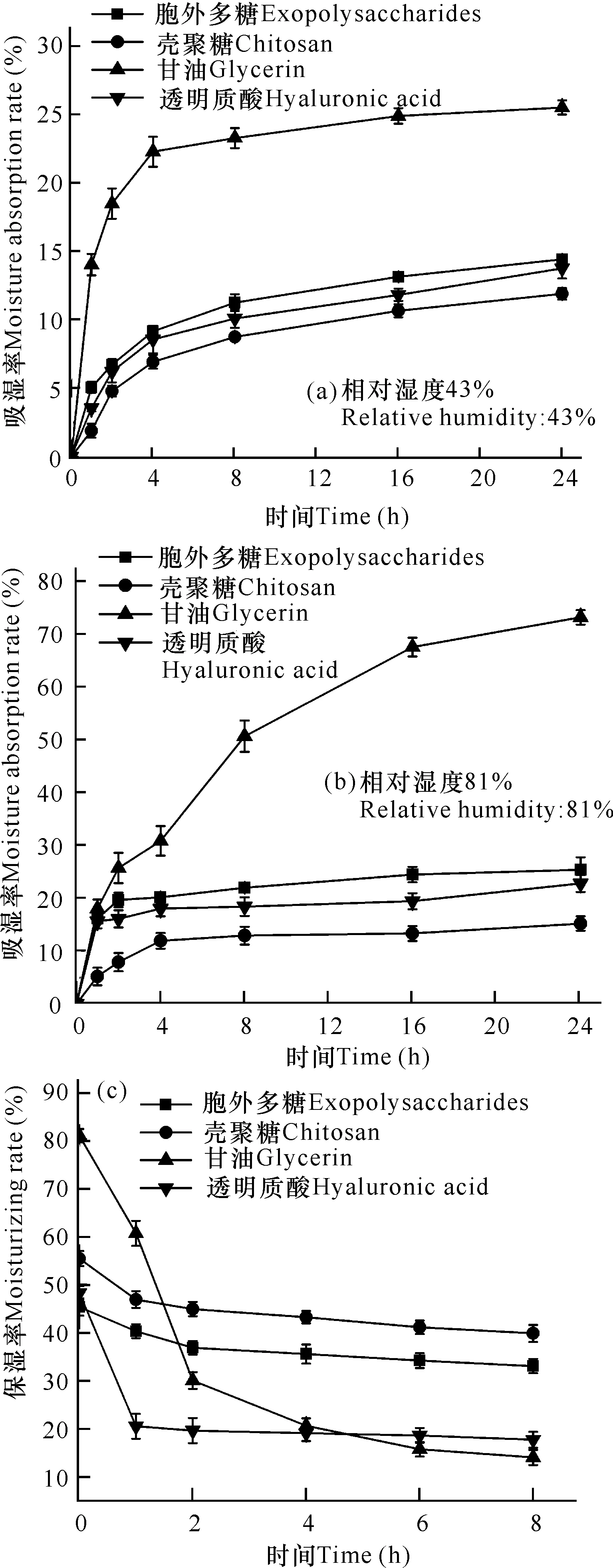
圖2 胞外多糖吸濕率(a、b)、保濕率(c)與時間變化曲線
2.3 抗氧化活性
2.3.1 DPPH自由基的清除能力
如圖3所示,在一定范圍內,隨著濃度增大,微桿菌XL1胞外多糖和Vc對DPPH自由基的清除率越高。其中,陽性對照Vc濃度為1 mg/mL時,清除率即可達到最大值96%,且在此后保持穩定。胞外多糖對DPPH自由基的清除作用在8 mg/mL時達到最大,清除率達到72%,其IC50值為1.2 mg/mL。因此,微桿菌XL1胞外多糖對DPPH自由基具有一定的清除效果。
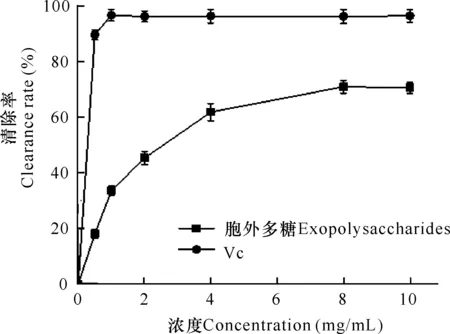
圖3 胞外多糖的DPPH自由基清除活性
2.3.2 羥基自由基的清除能力
如圖4所示,微桿菌XL1胞外多糖和Vc隨著濃度增大,對羥基自由基的清除率均呈現逐漸升高再趨于穩定的趨勢。陽性對照Vc濃度為1 mg/mL時,清除率即可達到最高值97%。胞外多糖在8 mg/mL時,對羥基自由基清除率達到最高,為93%,比Vc僅低5%,其IC50值為0.8 mg/mL。因此,微桿菌XL1胞外多糖對羥基自由基具有較好的清除效果。

圖4 胞外多糖的羥基自由基清除活性
2.3.3 鐵離子螯合能力
通過與EDTA比較,評價微桿菌XL1胞外多糖對鐵離子的螯合作用,結果發現陽性對照EDTA在0.1 mg/mL時,對鐵離子的螯合率達到最大值99%;胞外多糖在濃度為0.6 mg/mL時,對鐵離子的螯合率達到最大值96%,其IC50值為0.3 mg/mL比陽性對照EDTA僅低3%(圖5)。因此,微桿菌XL1胞外多糖對鐵離子具有較好的螯合作用。

圖5 胞外多糖的鐵離子螯合能力
2.4 酪氨酸酶活性的抑制效果
酪氨酸酶是黑色素形成的主要原因,研究其酶活性抑制具有重要意義。如圖6所示,曲酸和微桿菌XL1胞外多糖對酪氨酸酶的抑制率都具有劑量依賴關系,隨著濃度增加抑制速率變緩。陽性對照曲酸在10 mg/mL時,對酪氨酸酶抑制活性達到最大值80%;胞外多糖濃度為60 mg/mL時,酪氨酸酶抑制活性達到55%,胞外多糖的IC50值為14 mg/mL。雖然胞外多糖對酪氨酸酶活性的抑制性能與曲酸仍然有一定差距,但是胞外多糖作為純天然產物,具有安全、綠色無污染等優點。因此,微桿菌XL1胞外多糖在抑制黑色素形成方面仍具有應用潛力。

圖6 曲酸(a)和胞外多糖(b)的酪氨酸酶抑制活性
3 討論
微桿菌XL1胞外多糖發酵優化后產量達到92 g/L,是未優化前的2.3倍。比較而言,MicrobacteriumTL13多糖產量為36.25 g/L[18],MicrobacteriumFSW-25多糖產量為34.64 g/L[19],微桿菌XL1是一株高產胞外多糖的菌株。在優化發酵條件過程中,蔗糖及蔗糖添加量對胞外多糖產量的提升至關重要,以蔗糖作為碳源的產量是果糖的18倍。Han等[25]也是以蔗糖作為唯一碳源來優化微生物發酵產胞外多糖,使產量得到大幅度提升。后續的研究發現微生物在發酵過程中分泌出特定水解蔗糖合成果聚糖的蔗糖果糖酶[26]。因此,推測微桿菌XL1在發酵過程中分泌蔗糖果糖酶合成果聚糖,而且蔗糖含量越高酶活越高,故下一步可對發酵培養基中多糖合成酶及胞外多糖組分進行研究。
透明質酸吸濕保濕性能優良,被廣泛應用于化妝品、醫療美容中,而胞外多糖的吸濕保濕性能與透明質酸相似,在化妝品行業應用前景廣泛。微桿菌XL1胞外多糖具有較強的抗氧化活性,對羥基自由基的清除率和鐵離子的螯合率分別達到93%和96%,與Vc抗氧化效果幾乎一致,與MicrobacteriumFSW-25[19]胞外多糖相比具有更好的抗氧化效果,可作為抗氧化劑應用于食品行業中。目前國內對微生物胞外多糖的酪氨酸酶抑制活性研究較少,微桿菌XL1胞外多糖對酪氨酸酶的抑制率可達55%,雖然與EDTA的酪氨酸酶抑制效果有一定差距,但是微生物胞外多糖作為天然生物大分子,具有安全無毒、綠色環保等優點。此外,為滿足實際應用的需求,通過化學修飾可以改變多糖官能團,如硫酸化、羧甲基化、乙酰基化等方法,從而獲得具有更高或新的生物活性的多糖衍生物[27]。因此,后續實驗有望通過對微桿菌XL1胞外多糖進行化學修飾,增強其酪氨酸酶抑制活性。
4 結論
單因素法優化結果顯示:微桿菌XL1發酵產胞外多糖的最佳培養基成分為FeSO47H2O 0.01 g/L、CaCl20.1 g/L、K2PO41 g/L、MgCl20.15 g/L、酵母提取物3 g/L、蔗糖200 g/L,pH值8.0;最佳培養條件為接種量4%,20℃搖床培養24 h。微桿菌XL1胞外多糖產量最高可達92 g/L,該胞外多糖具有優良的吸濕保濕性能、抗氧化活性以及抑制酪氨酸酶活性,可作為一種天然活性物質在化妝品、食品行業進一步開發利用,并有望擴大規模進行工業化生產。