RNAi轉基因大豆品系‘B5C9123-5’的RPA可視化檢測技術
張 晨 雷 展 李 凱 李飛武 商 穎* 許文濤*
(1.昆明理工大學 農業與食品學院,昆明 650504;2.中國農業大學 食品科學與營養工程學院/北京食品營養與人類健康高精尖創新中心,北京 100083;3.農業農村部農業轉基因生物安全評價(食用)重點實驗室,北京 100083;4.吉林省農業科學院 農業質量標準與檢測技術研究所,長春 130033)
在真核生物中,RNA干擾(RNA interference, RNAi)是通過雙鏈RNA觸發內源性RNA誘導沉默復合物(RNA-induced silencing complex, RISC)抑制特定基因表達的一種生物機制。在精確抑制相關基因表達時,RNAi不會影響其他基因表達的特點使其成為一種很有前途的基因調控方法。在植物中,RNAi通過靶向關鍵基因為培育抗病、抗蟲的高產優良品種開辟了新的途徑。然而,新興技術的應用和發展往往會伴隨著很多爭議和關注。因此,為規范RNAi作物的田間監管,亟待開發新型RNAi作物的快速檢測方法。
由于分子特征的相似性,RNAi作物被納入轉基因作物管理體系中進行監管。現階段,針對轉基因作物的檢測手段主要分為兩大類,一類是蛋白質分析,另一類是特異性DNA檢測方法。通過檢測外源蛋白在不同作物或同一作物的不同組織中的表達,蛋白質分析可用于檢測多個特征,但蛋白質分析不具備特異性檢測轉基因品系的能力。外源插入片段的側翼序列是位于基因構建體和5′(或3′)側翼基因組DNA序列交界處的獨特序列。根據側翼序列建立的特異性DNA檢測方法,是對轉基因植物及其產品進行有效監督管理的一個重要依據。由于較高的靈敏度和特異性,聚合酶鏈式反應(Polymerase Chain Reaction, PCR)已經成為檢測轉基因作物的標準。然而,常規PCR需要繁瑣的樣品前處理,擁有專業設備的特定實驗室以及訓練有素的操作人員,這些要求極大地限制了PCR在快速、現場檢測方面的應用。近年來,恒溫擴增技術的發展為轉基因作物的快速檢測提供了新的契機,例如環介導等溫擴增(Loop-mediated isothermal amplification, LAMP)、重組酶聚合酶擴增(Recombinase polymerase amplification, RPA)和滾環擴增(Rolling circle amplification, RCA)等等。通過模擬體內DNA重組,在37~42 ℃恒溫條件下,應用RPA可在30 min內快速擴增DNA。RPA的恒溫、快速和高特異擴增靶標的特點使其特別適合開發快速、現場檢測技術。在RPA的基礎上,已經建立了許多新的快速核酸擴增檢測方法,例如RPA促進四甲基聯苯胺顯色用于快速篩選結核分枝桿菌,RPA與橫向流動試紙條偶聯用于快速鑒定羊肉摻假以及RPA與電活性物質結合用于快速檢測血清或血液中痕量DNA序列等。此外,RPA檢測可在現場使用便攜式檢測儀器實現靶標檢測,包括現場檢測和鑒定HIV-1種/亞種以及用于級聯擴增的無標記視覺生物傳感器檢測沙門氏菌等。
RNAi轉基因樣本是吉林省農業科學院采用農桿菌介導法將外源SMV
-NIb
基因RNAi片段導入栽培大豆品種‘沈農9號’,獲得的抗病轉基因大豆新品種‘B5C9123-5’。目前,基于RPA進行RNAi轉基因作物現場檢測的相關研究還鮮有報道。本研究在RNAi轉基因作物的測序基礎上,通過RPA特異性引物和可視化熒光染料SYBR Green Ⅰ,旨在開發RNAi轉基因作物的田間可視化鑒定,以期為RNAi轉基因植物的商業化應用提供參考。1 材料與方法
1.1 材料
廣譜抗花葉病毒轉基因大豆品種‘B5C9123-5’由吉林省農業科學院提供。轉基因玉米品種混合物(‘GA21’,‘MON89034’,‘MON88017’,‘MIR604’,‘MON87460’,‘MON87427’),轉基因棉花品種混合物(‘MON1445’,‘MON531’,‘MON15985’),轉基因水稻品種混合物(‘華占水稻’,‘隆兩優8387’,‘TT51-1’,‘科豐 6’),由本實驗室保存的。
1.2 方法
1
.2
.1
基因組DNA提取應用北京天根公司的植物基因組DNA提取試劑盒(自旋柱型)提取供試材料的DNA。采用瓊脂糖凝膠電泳和紫外分光光度計(美國Thermo Fisher Scientific公司的 Nanodrop 2 000)的方法,測定DNA提取的質量和效果。在進行RPA反應前,將DNA樣品保存在-20 ℃。
1
.2
.2
引物設計和篩選所有引物設計好后在Primer 5.0軟件中測試,以檢測序列中是否存在二聚體或特殊結構。在外源插入片段右邊界側翼序列設計引物進行RPA引物篩選,篩選設計上下游共10條引物,首先進行對應篩選,其次進行交叉序號篩選,最終確定最優引物。所用的特異性引物序列,由中國上海生工生物技術有限公司合成,見表1。
表1 轉基因大豆‘B5C9123-5’RPA引物序列
Table 1 Primer sequence of transgenic soybean ‘B5C9123-5’
引物名稱Primername序列(5′→3′)Sequence(5′→3′)9123-RPA-FP1CCACCACTCCCAATGACAACATTTTTTCGTAATAA9123-RPA-FP2TGAGCTTGGATCAGATTGTCGTTTCCCGCCTTCAG9123-RPA-FP3CAATGACAACATTTTTTCGTAATAACATTTGACGT9123-RPA-FP4ACAACATTTTTTCGTAATAACATTTGACGTTAATT9123-RPA-FP5ATTTTTTCGTAATAACATTTGACGTTAATTTGATA9123-RPA-RP1GCATCTTGAACGATAGCCTTTCCTTTATCGCAATG9123-RPA-RP2TACCACCTATGCCTATGCTGACAAAAAGTGGTTGT9123-RPA-RP3CGATAGCCTTTCCTTTATCGCAATGATGGCATTTG9123-RPA-RP4GCCTTTCCTTTATCGCAATGATGGCATTTGTAGGA9123-RPA-RP5TCCTTTATCGCAATGATGGCATTTGTAGGAGCCAC
1
.2
.3
RPA顯色分析為驗證RPA引物的有效性和優化RPA體系,對反應的基本條件進行了改進。使用英國Twist Dx公司的Twist Amp Basic kit 進行RPA擴增,每個反應體系為47.5 μL:29.5 μL復水緩沖液,2.4 μL正向和反向引物(10 μmol/L)和2 μL的DNA模板(100拷貝)。然后將反應混合物加入凍干管中,輕彈凍干管直到凍干粉末完全溶解。為引發反應,加入2.5 μL 280 mmol/L醋酸鎂(MgAc)。加入MgAc后立即開始RPA反應,在39 ℃的熱循環中孵育20 min。擴增產物用2%(w/v
)瓊脂糖凝膠電泳分析。RPA顯色反應體系中包含29.5 μL緩沖液,2.4 μL 的正向和反向引物(10 μmol/L)和2 μL的DNA模板(100拷貝),然后使用2.5 μL 280 mmol/L MgAc和雙蒸水將反應體系補足到46 μL,最后將SYBR Green Ⅰ染料點加在RPA管蓋。反應過程與RPA反應相同,反應完成后離心進行可視化和熒光分析,熒光數據使用日本島津公司的RF6000熒光分光光度計收集,激發波長為497 nm,發射波長為520 nm。
2 結果與分析
2.1 RPA引物篩選
由圖1可知,通過篩選得到特異性較好的引物對為9123-RPA-FD2/RP,特異性擴增片段大小為399 bp。由圖2 可知,該對引物只在轉基因大豆‘B5C9123-5’樣品中擴增出399 bp特異性片段,特異性良好。由圖3可知,通過對轉基因大豆‘B5C9123-5’ 樣品的DNA進行梯度稀釋(200.00、100.00、50.00、10.00、5.00、1.00、0.50和0.10 ng/μL)后進行擴增,結果表明該對引物的檢測靈敏度低至0.50 ng/μL。
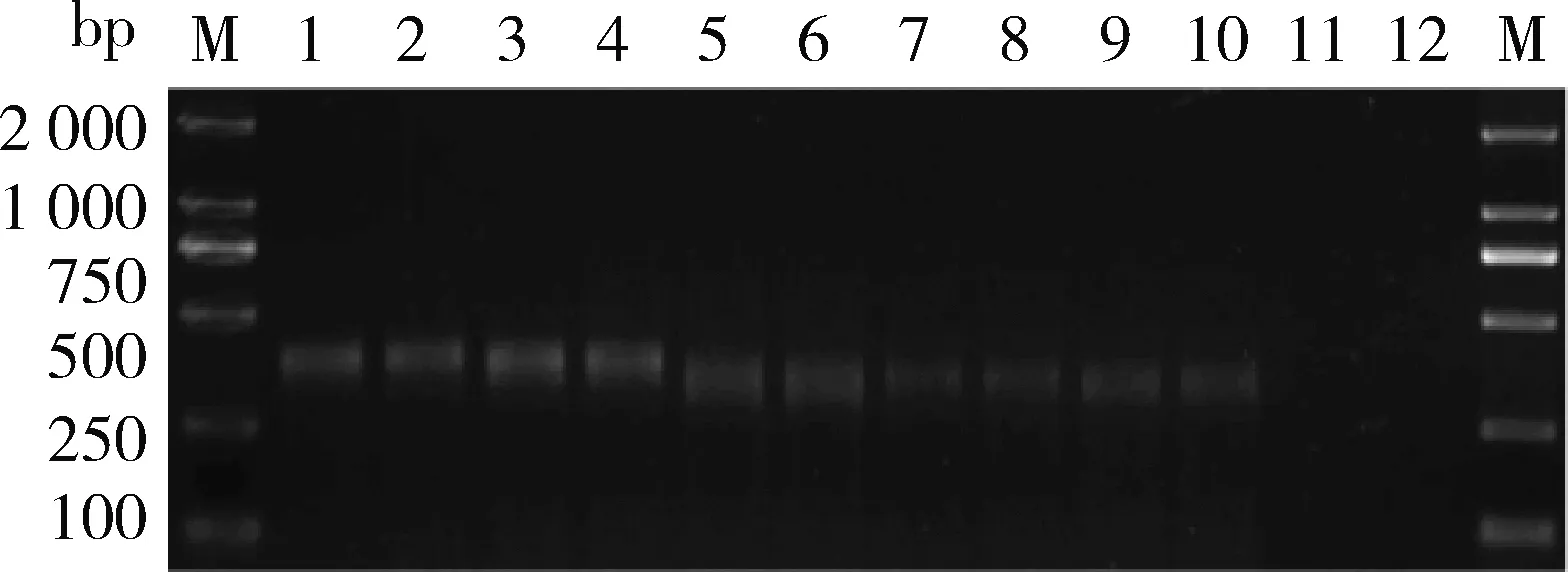
1~10,不同引物對;11~12,空白對照;M,2 000 bp DNA分子量標準
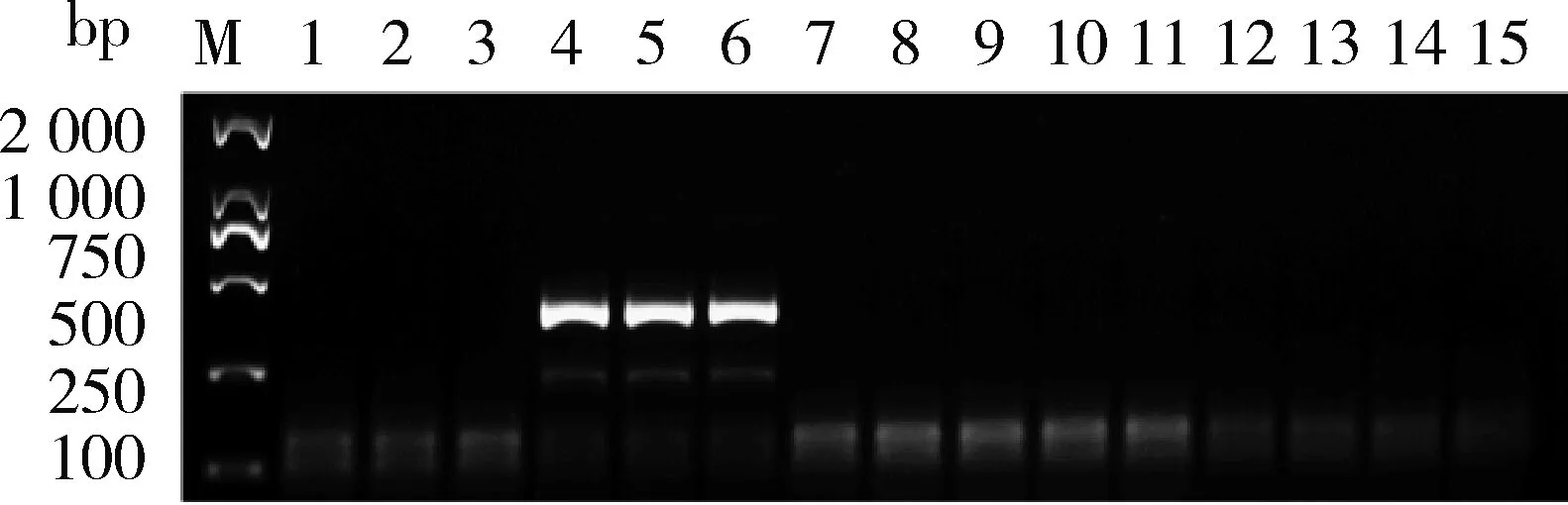
M,2 000 bp DNA分子量標準;4~6,RNAi大豆‘B5C9123-5’陽性樣本;7~9轉基因玉米,10 ng/μL;10~12轉基因棉花,10 ng/μL;13~15轉基因水稻,10 ng/μL。
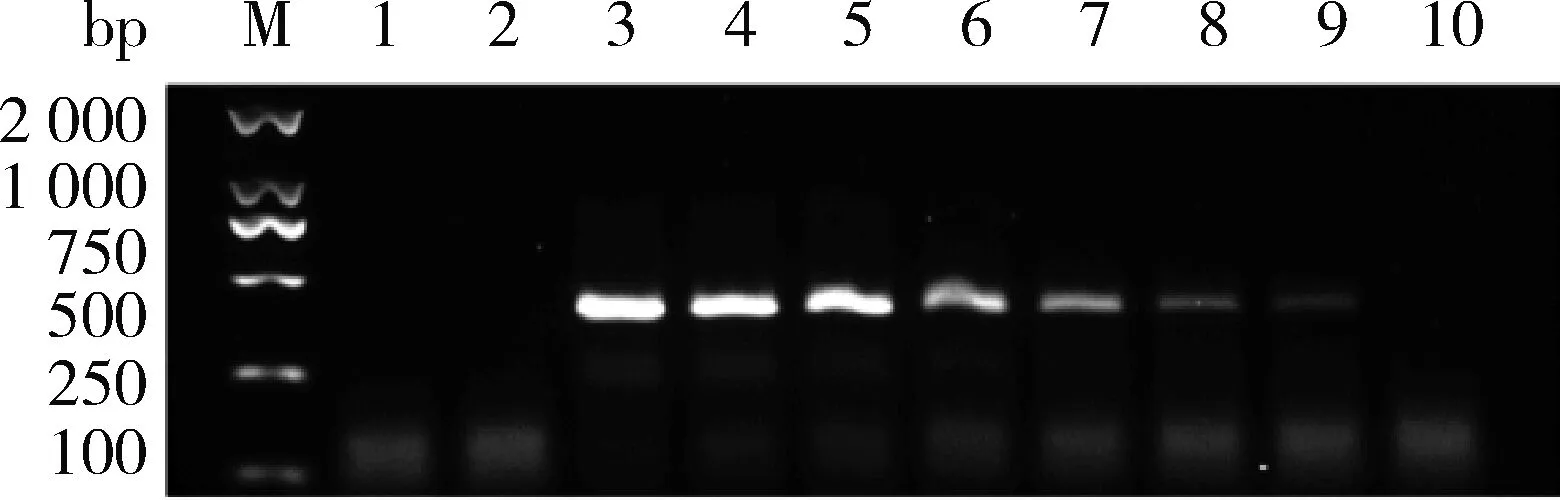
1和2分別是空白和陰性對照;3~10分別為RNAi大豆‘B5C9123-5’陽性樣本濃度200.00,100.00,50.00,10.00,5.00,1.00,0.50和0.10 ng/μL;M,2 000 bp DNA分子量標準。
2.2 可行性驗證
由圖4(a)和(b)可知,RPA完成后,陰性和陽性樣品溶液顏色具有明顯差別,熒光強度也反映陰性和陽性樣品之間的差異。此外,由圖4(c)和(d)可知,熒光數據以及電泳結果也證明陰性樣品和陽性樣品之間的差異。
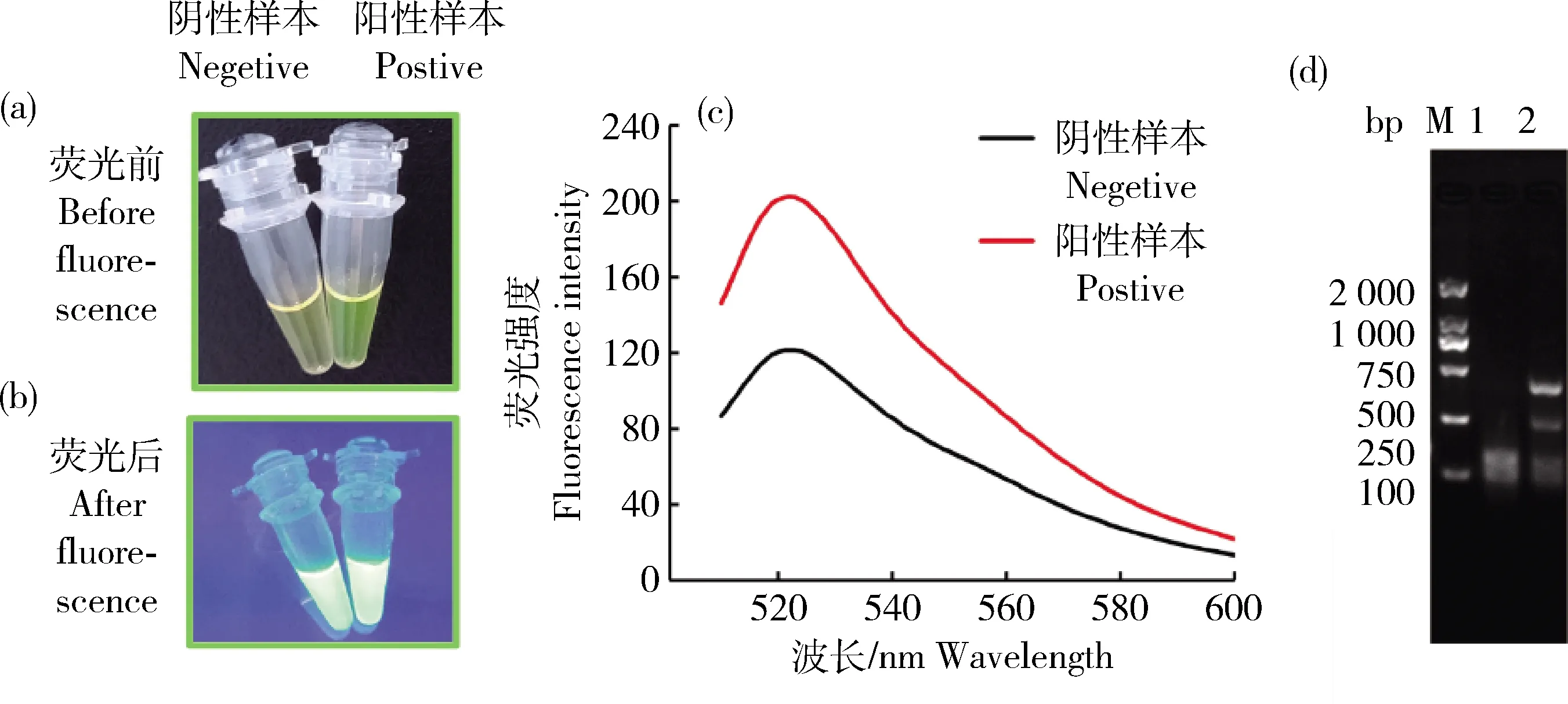
1,空白對照;2,陽性對照;M,DNA marker 2 000
2.3 參數優化
2
.3
.1
時間優化在RPA反應后5 min,開始觀察溶液的顏色變化。由圖5可知,在開始反應后的25 min內,隨著時間的延長,溶液顏色逐漸由黃色轉變為綠色。在反應到達15 min后,溶液顏色和熒光強度變化較小。熒光結果說明15 min RPA反應已經逐漸達到閾值,熒光強度隨反應時間再延長而減弱。因此,選擇15 min為RPA可視化分析的最佳檢測時間。
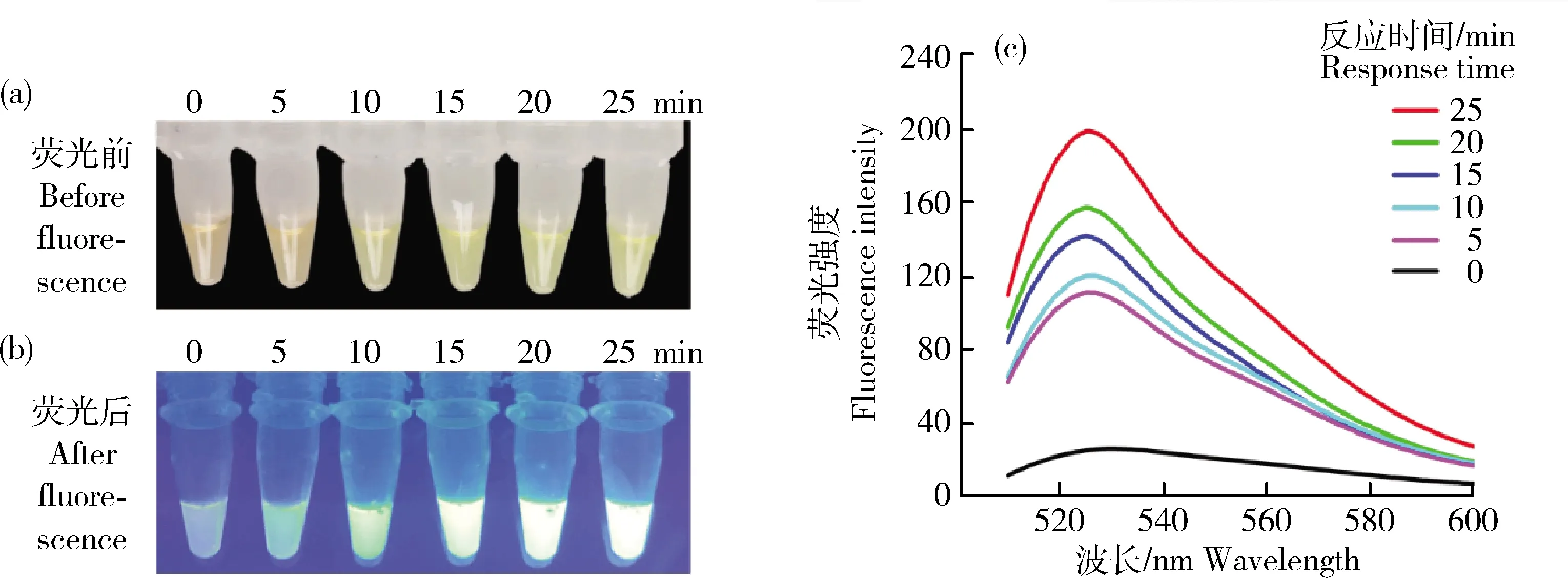
(a)0~25 min RPA可見光條件;(b)0~25 min RPA熒光條件;(c)不同時間段RPA可視化的熒光參數
2
.3
.2
溫度優化在31~51 ℃,對RPA可視化的反應溫度進行優化。由圖6可知,反應發生的15 min后,較低反應溫度下(31 ℃)以及較高溫度下(51 ℃),溶液顏色均為黃色,而反應溫度為39 ℃時溶液顏色呈現最佳的綠色。熒光試驗結果說明反應溫度為39 ℃時,熒光強度達到最高值。因此,RPA可視化分析的最佳反應溫度為39 ℃。
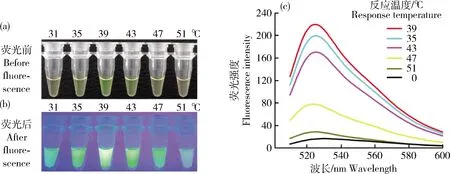
(a)31~51 ℃ RPA可見光;(b)31~51 ℃ RPA熒光;(c)不同溫度下RPA熒光強度
2.4 特異性測試
使用不同轉基因植物的混合DNA,評估優化后RPA可視化分析的特異性。結果顯示,僅有RNAi轉基因大豆樣品溶液的顏色發生變化。由圖7可知,溶液顏色由黃色轉變為綠色,其余樣品溶液顏色均未發生改變。由圖8可知,熒光結果有力地佐證了RPA可視化分析在RNAi轉基因大豆可視化檢測中的特異性。

a1~a3,非轉基因大豆;b1~b3,轉基因玉米;c1~c3,RNAi轉基因大豆‘B5C9123-5’;d1~d3,轉基因棉花;e1~e3,轉基因水稻;各種植物的DNA含量為50.0 ng/μL。
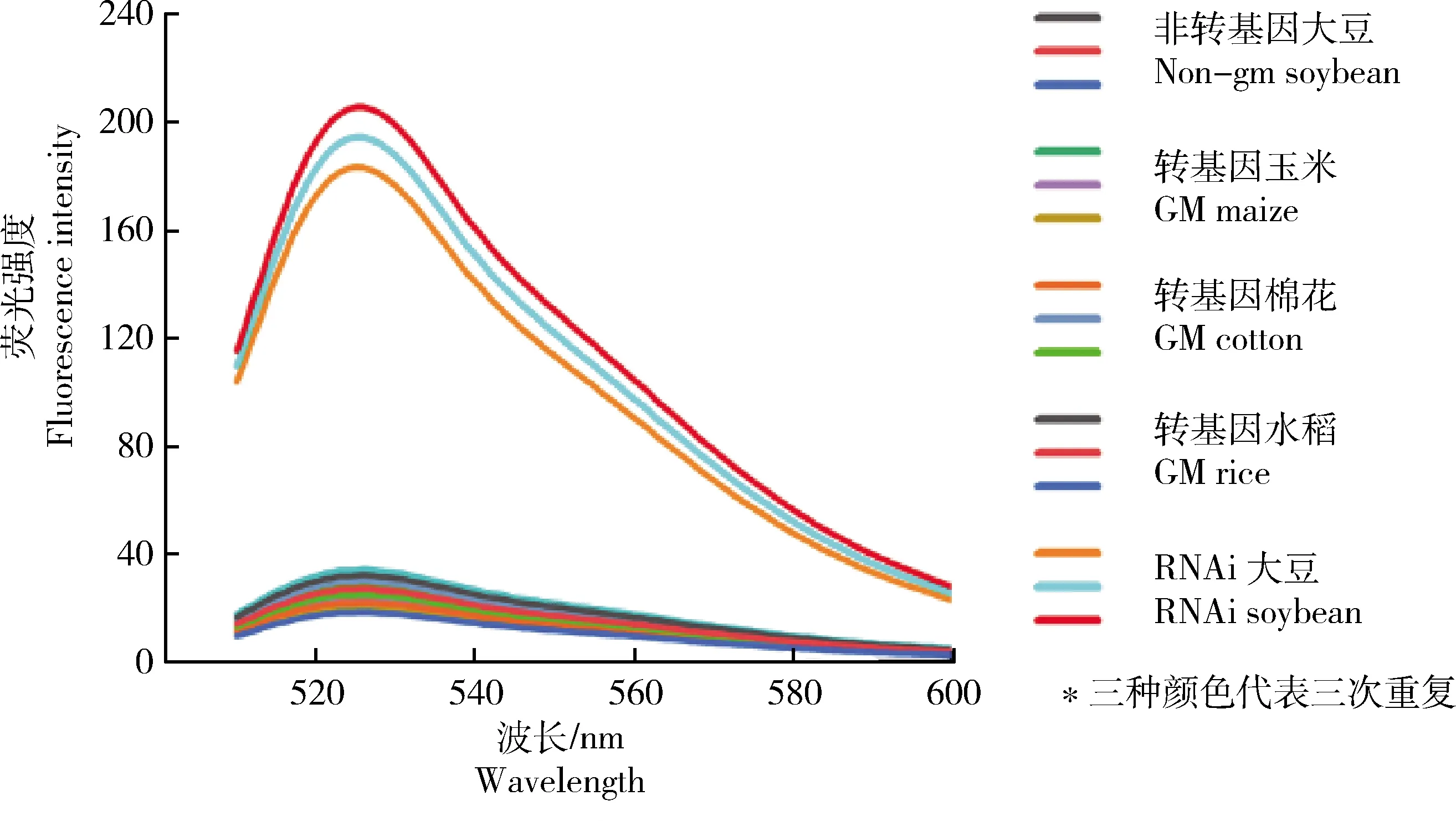
圖8 不同轉基因作物RPA可視化特異性熒光強度驗證
2.5 靈敏度測試
在優化后的試驗條件下,使用混有不同RNAi轉基因大豆成分(200.00、100.00、50.00、10.00、5.00、1.00、0.50和0.10 ng/μL)的大豆粉末,驗證RPA可視化分析的靈敏度。隨著RNAi轉基因大豆DNA的濃度逐漸降低,溶液顏色逐漸由綠色向黃色發生偏移。由圖9可知,RPA可視化分析的檢測限為1.00 ng/μL。熒光條件下,RPA可視化分析的檢測限為0.50 ng/μL。由圖10可知,熒光數據驗證了RPA可視化分析的靈敏度。
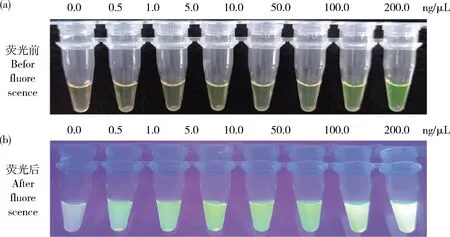
圖9 不同濃度RNAi轉基因大豆DNA的RPA可視化靈敏度結果
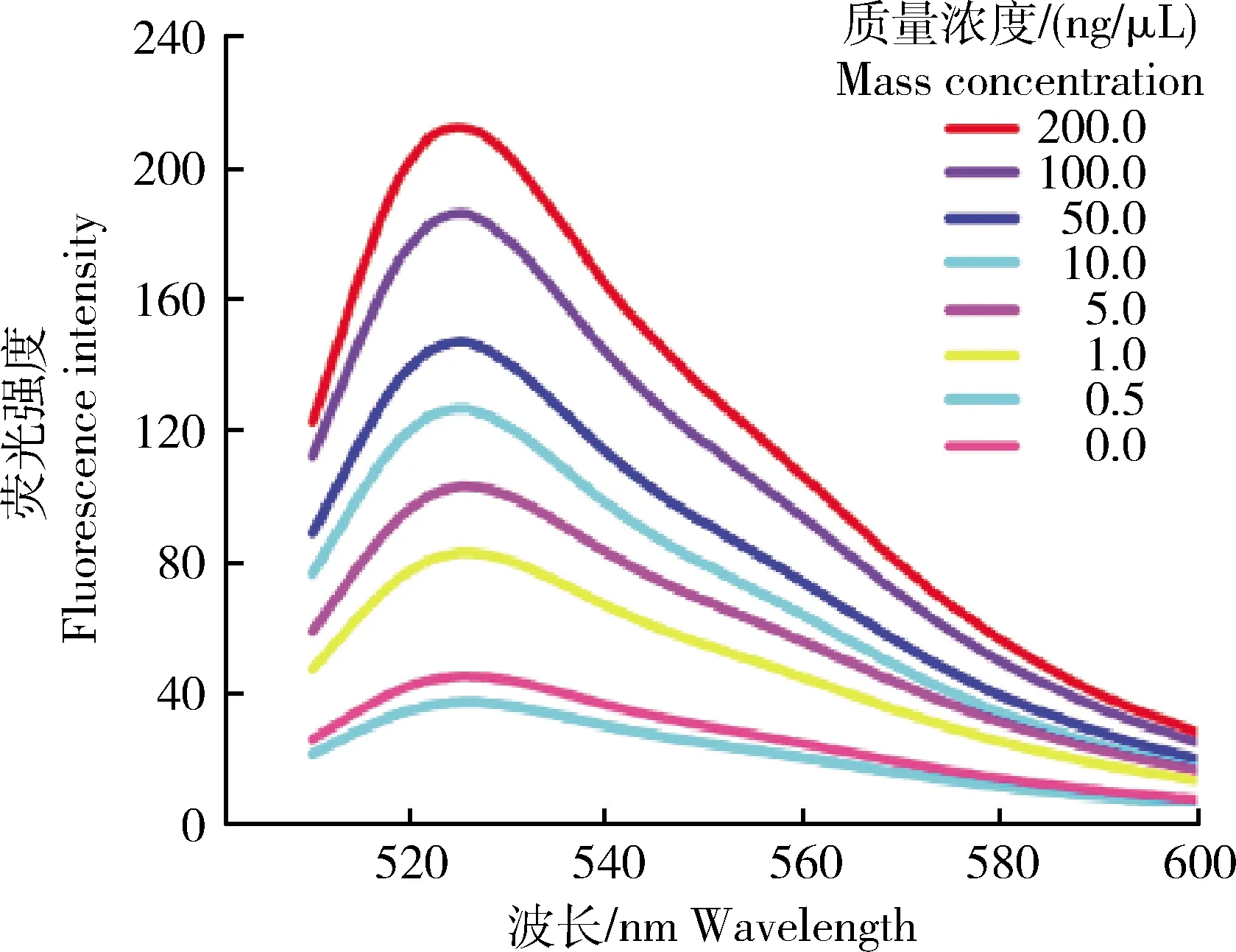
圖10 RNAi轉基因大豆RPA可視化驗證靈敏度熒光強度
3 討 論
自20世紀90年代中期,美國孟山都公司生產的第一種轉基因大豆在美國商品化生產以來,現代生物技術在大豆中得到了廣泛的商業化應用。然而,現代生物技術在農作物中的應用也帶來了對于食品安全、環境風險和倫理問題等的擔憂。
與PCR相比,重組酶聚合酶擴增(RPA)反應需要相對較長的引物與重組酶結合,這一過程會導致大量引物二聚體的產生。在可行性驗證過程中,大量引物二聚體導致空白對照出現較強的背景信號。本研究通過改進RPA反應的基本條件,實現了降低背景值及獲得最大顏色差異的目的。在進行時間優化時,觀察到RPA最快在5 min內就啟動反應。隨時間延長RPA反應擴增產物不斷增加并在15 min后達到閾值。在對溫度進行優化時,發現RPA在較大的溫度范圍內(35~43 ℃)發揮作用。以上結果均表明RPA反應體系的快速、高效以及對于開發新型現場檢測技術的潛在適用性。在進行靈敏度研究時,比色法的檢測限為1.00 ng/μL,而熒光條件下檢測限為0.50 ng/μL。這是因為黃色和綠色較為相近導致在進行低濃度樣品比色測定時陽性與陰性樣品的區分度差。為實現低濃度樣品的快速檢測,使用手持式熒光或采用混合染料對樣品進行測定可能是一個不錯的解決方案。在分子擴增檢測技術中,DNA提取和純化是其檢測過程中的關鍵點。雖然,市場上已經出現了針對多種不同材料的商業化DNA提取試劑盒,但是,提取過程中所需的渦旋、離心設備,多次的移液步驟和相對復雜的操作過程使其難以應用于現場檢測應用。最近,一些研究也報道了使用磁珠或不同類型的膜(氧化鋁,纖維素和二氧化硅等)捕獲和結合DNA,從而加快DNA提取過程,縮短DNA提取時間。雖然,這類技術提取的DNA質量可能會比商業化DNA提取試劑盒的提取效果差,但是,相對簡單的操作,不依賴其他設備優勢使其完全滿足現場檢測的要求。
除了RNAi轉基因作物以外,具有2種或2種以上轉基因性狀(堆疊)的轉基因作物的種植也在世界各地迅速增加。雖然所建立的RPA現場可視化分析已經取得了一些進展,但是多重RPA檢測技術仍然相對較為復雜。多重放大反應受多種因素的影響,包括擴增子長度、模板濃度和退火溫度等。然而,所有倍數放大的本質都是引物與靶標的特異性結合引起的。多引物的存在增加了反應體系的復雜性,并且不同引物的擴增效率不同。通用引物似乎是有效地解決這些問題的關鍵。通用引物可保證每個目標的均勻放大效率。目前,已經出現許多基于通用引物的檢測方法用于檢測多個目標,包括識別4種肉(牛、豬、馬和雞),區分食品樣本中3種不同細菌以及特異性檢測堆疊轉基因玉米(‘Bt11’和‘GA21’)等,但是在RPA體系中使用通用引物擴增多重靶標仍需要進一步探究。
4 結 論
綜上所述,基于SYBR Green Ⅰ染料,設計了1種轉基因大豆現場可視化RPA檢測方法。結果表明,該方法可在20 min內篩選出混有1.00 ng/μL RNAi轉基因大豆的混合樣品。該技術與快速DNA提取方法聯用,可極大簡化檢測過程,提高檢測效率。同時,使用便攜式恒溫加熱儀器來進行RPA反應,可降低檢測成本。

