基于生物信息學分析HLA-DMA 基因在LGG 中的表達和功能
李澤艷,王曉旋,來明名,馬雪艷
(大理大學基礎醫學院,云南 大理 671000)
低級別腦膠質瘤(low-grade glioma)是一組原發性腦腫瘤,起源于支持性膠質細胞。根據世界衛生組織(WHO)的標準,腦膠質瘤分為Ⅰ、Ⅱ、Ⅲ和Ⅳ級,并將Ⅱ和Ⅲ級統稱為低級別腦膠質瘤(LGG)[1,2]。早期研究表明[3],LGG 在病理學、分子特征和預后等方面具有高度個體特異性。低級別腦膠質瘤最常見于35~44 歲的年輕人,生長較為緩慢。然而,大多數低級別腦膠質瘤最終轉化為高級別膠質瘤,導致預后較差[4]。因此,篩選敏感、可靠的生物標志物對LGG 的早期診斷和預后評估至關重要。人類白細胞抗原Ⅱ類(human leukocyte antigen class Ⅱ,HLA-Ⅱ)分子主要與免疫系統疾病相關,除了參與經典的抗原抗體反應外,還廣泛參與調節各種細胞過程,包括增殖、成熟、凋亡、以及細胞因子、巨噬細胞、B 細胞和樹突狀細胞等生成過程[5,6]。此外據報道[7-9],HLA-Ⅱ類分子常高表達于腫瘤中,主要與腫瘤細胞逃避免疫監視形成腫瘤轉移浸潤相關。主要組織相容性抗原復合體ⅡDMα(majorhistocompatibility complex class II-DM alpha,HLA-DMA)屬于人類白細胞抗原(HLA)非經典Ⅱ類區,主要在抗原呈遞細胞(APC:B 淋巴細胞、樹突細胞、巨噬細胞)中表達,和其他HLA-Ⅱ類分子共同參與抗原的加工、提呈及其他免疫調節過程。因此猜測,HLA-DMA 可能和其他HLA-Ⅱ類分子一樣,高表達于腫瘤細胞中并和其他HLA -Ⅱ分子共同參與腫瘤細胞逃避免疫監視,形成腫瘤轉移浸潤。早期有研究表明HLADMA 多態性與腦膠質瘤遺傳易感性有關[10]。但目前關于HLA-DMA 在LGG 中的表達及功能尚未見相關報道。為此,本研究將通過生物信息學方法分析HLA-DMA 在LGG 中的表達,探討HLA-DMA 在LGG 中的預后價值,以及HLA-DMA 與共表達基因在LGG 中的生物學作用。進一步研究HLA-DMA 調控LGG 的可能機制,為LGG 的診斷、治療和預后提供新的思路。
1 資料與方法
1.1 數據來源 數據來源于基因表達譜數據動態分析(gene expression profiling interactive analysis,GEPIA)數據庫(http://gepia.cancer-pku.cn),癌基因組圖譜(The Cancer Genome Atlas,TCGA)數據庫(https://portal.gdc.cancer.gov/),基因共表達網絡(GeneCo -expreesionNetwork,Coexpedia)數 據 庫(http://www.coexpedia.org/)和FunRich 3.1.3 軟件。
1.2 GEPIA 數據庫 GEPIA 數據庫是由北京大學張澤民教授團隊開發的一種交互式網絡服務器,收錄TCGA 和GTEx 項目的9736 例腫瘤和8587 例正常樣本的RNA 測序表達數據。可在線分析基因在不同腫瘤類型中的表達情況以及正常組織與腫瘤組織mRNA 的表達情況。本次通過基因表達譜動態分析(GEPIA)對HLA-DMA 在各種類型腫瘤中的表達情況進行可視化并對HLA-DMA 在正常組織與LGG組織mRNA 的表達情況進行在線分析。
1.3 TCGA 數據庫 TCGA 數據庫設定數據過濾條件如下:“brain”“TCGA-LGG”“transcriptome profiling”“Gene Expression Quantification”及“HTSeq-FPKM”,下載LGG RNA-seq 數據及LGG 患者臨床資料數據和預后數據。應用perl 將下載文件中探針名字轉換為基因名字,使用R 軟件讀取轉換后文件,通過“limma”包提取“HLA-DMA”表達數據。去除數據集中臨床病理參數不完整及缺乏預后隨訪資料的樣本,僅保留同時包含臨床參數和生存數據的樣本,共納入510 例患者進行分析。
1.3.1 HLA-DMA 表達與臨床病理特征的關系 應用R(v3.5.3)軟件讀取TCGA-LGG 基因表達數據及臨床資料數據,進行Wilcoxon 秩和檢驗,分析HLADMA 表達與腫瘤分級和年齡之間的關系。
1.3.2 HLA-DMA 與LGG 患者生存預后的相關性采用R(v3.5.3)軟件讀取TCGA-LGG 基因表達數據及臨床資料數據,利用“survival”包根據HLA-DMA在LGG 中表達的中位數將患者分為高表達組和低表達組,并分析兩者的總體生存情況。同時運用“survminer”包繪制生存曲線,隨后對患者年齡、WHO 分級及HLA-DMA 表達水平進行單因素和多因素Cox 回歸分析,預測影響LGG 患者預后的獨立危險因素。
1.4 Coexpedia 數據庫 利用Coexpedia 數據庫在線分析HLA-DMA 基因在LGG 中的分子調控網絡,并獲取共表達基因。按照Score>2 對共表達基因進行預處理,共篩選出20 個共表達基因。
1.5 FunRich 3.1.3.軟件 利用FunRich 3.1.3.軟件對HLA-DMA 與Coexpedia 數據庫篩選出的20 個共表達基因的分子功能(molecular function,MF)、生物學過程(biological process,BP)、信號通路(biological pathway,BPA)進行分析,臨界值設定P<0.05。
1.6 GSEA 軟件 利用GSEA3.0 軟件分析HLA-DMA表達水平對各種生物通路基因集的作用。以HLADMA 高、低表達分組作為表型文件,按照GSEA 軟件默認參數,隨機組合1000 次進行富集分析。按錯誤發現率(false discovery rates,FDR)進行序排序,并將FDR<0.25 的基因集作為顯著富集基因集。
1.7 統計學方法 下載數據集后使用R(v3.5.3)軟件進行整理分析。HLA-DMA 在正常組織和LGG 組織中的表達差異采用t檢驗;臨床病理特征采用Wilcoxon 秩和檢驗進行分析;Log-rank 檢驗計算基因表達與LGG 患者生存的關系;單因素和多因素Cox 回歸模型用于分析HLA-DMA 在LGG 患者中的預后意義。P<0.05 表示差異具有統計學意義。
2 結果
2.1 HLA-DMA 在不同腫瘤類型中的表達情況 通過GEPIA 數據庫在線分析HLA-DMA 在不同腫瘤中的表達情況,并進行可視化分析。HLA-DMA 在彌漫性大B 細胞淋巴瘤(Lymphoid Neoplasm Diffuse Large B-cell Lymphoma,DLBC)、膽管癌(Cholangiocarcinoma,CHOL)、胰腺癌(Pancreatic adenocarcioma,PAAD)、多形性膠質瘤(Glioblastoma multiforme,GBM)、急性髓細胞樣白血病(Acute Myeloid LeukemiaL,AML)、低級別腦膠質瘤(Low-Grade Glioma,LGG)、睪丸癌(Testicular Germ Cell Tumors,TGC)等多種腫瘤中高表達,見圖1。
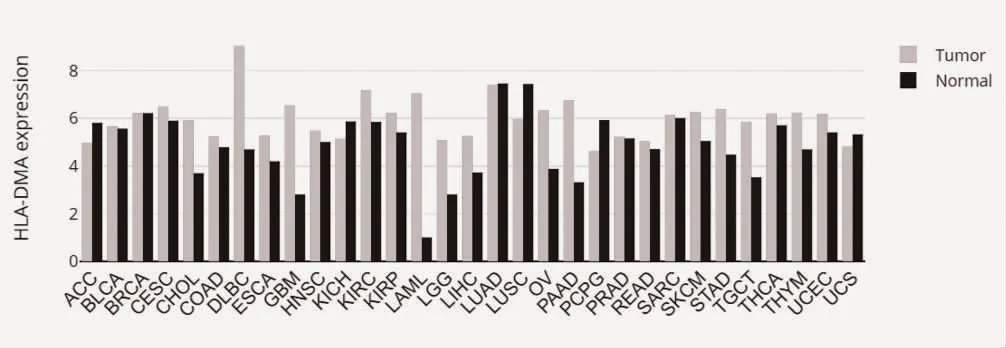
圖1 HLA-DMA 在各種腫瘤組織和正常組織中的表達
2.2 HLA-DMA 在低級別腦膠質瘤和正常腦組織中mRNA 的表達情況 使用GEPIA 數據庫對低級別腦膠質瘤組織(518 例)和正常組織(207 例)中HLADMA 的mRNA 表達水平進行分析,低級別腦膠質瘤組織中HLA-DMA 的表達高于正常組織,差異具有統計學意義(P<0.05),見圖2。
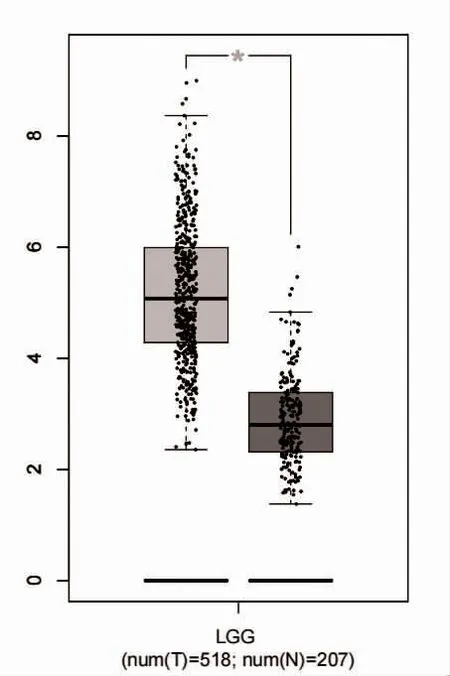
圖2 HLA-DMA 在低級別腦膠質瘤和正常腦組織中mRNA 的表達情況
2.3 HLA-DMA 表達與臨床病理特征的關系 TCGA數據集中共納入510 例臨床病理參數完整的病例資料,通過統計分析病例資料發現,WHO Ⅲ級的LGG中HLA-DMAmRNA 表達高于WHOⅡ級的LGG,差異具有統計學意義(P<0.05),見圖3A,HLA-DMA的表達與LGG 患者的腫瘤分級相關。另外,不同年齡患者的HLA-DMA 的表達比較,差異無統計學意義(P>0.05),見圖3B。
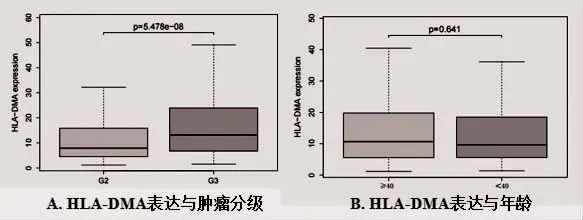
圖3 HLA-DMA 表達與臨床病理特征的關系
2.4 HLA-DMA 與LGG 患者生存預后的相關性 使用R 軟件的“survival”軟件包進行生存分析,采用“survminer”軟件包繪制生存曲線。可知,HLA-DMA表達量與低級別腦膠質瘤患者的總體生存率相關(P<0.05),高表達HLA-DMA 患者的總體生存率低于低表達組,見圖4。HLA-DMA 高表達組的低級別腦膠質瘤患者5 年生存率為57.7%,而低表達組為70.1%。進一步對影響LGG 患者預后的因素進行單因素和多因素Cox 分析,單因素Cox 分析結果顯示,患者年齡、腫瘤分級、和HLA-DMA 表達水平均可能影響LGG 患者的預后。并將上述臨床指標納入多因素回歸分析,結果顯示,患者年齡、腫瘤分級、HLA-DMA 高表達是影響LGG 患者預后的獨立危險因素(P<0.05),見表1。
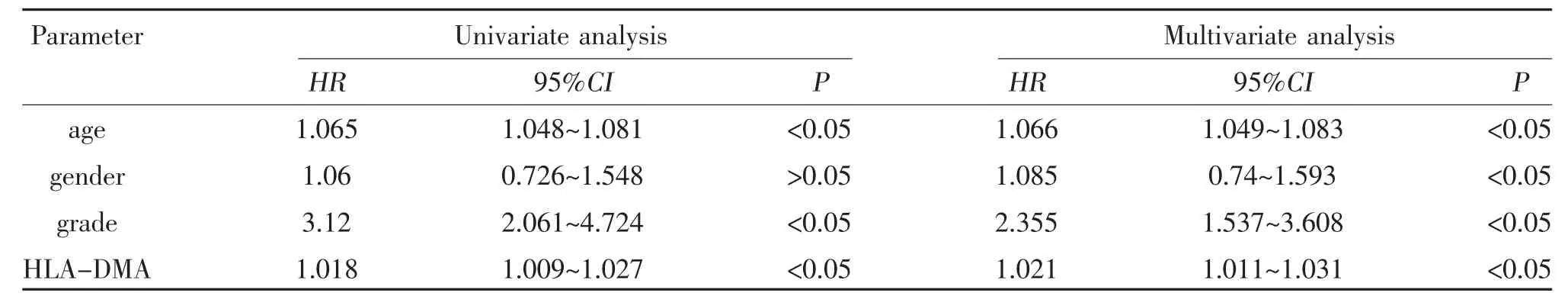
表1 LGG 預后影響因素的單因素、多因素Cox 回歸分析
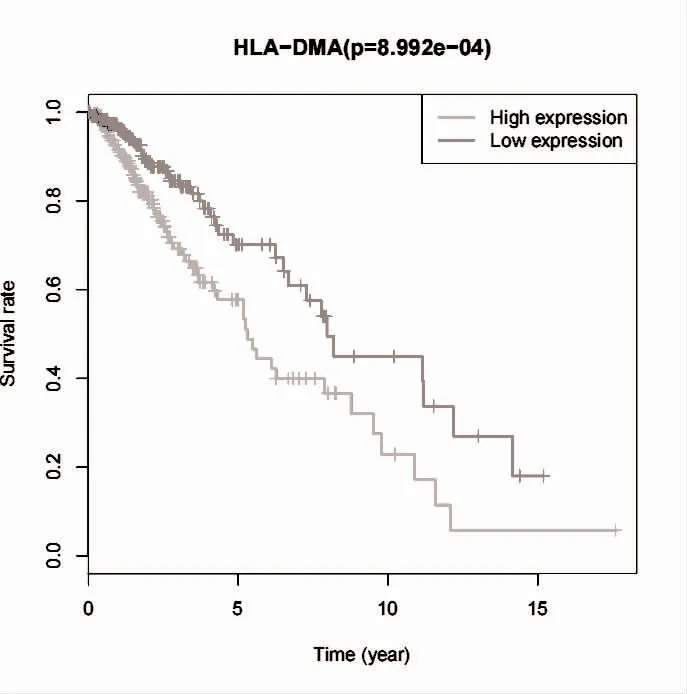
圖4 HLA-DMA 與LGG 患者生存預后的相關性
2.5 HLA-DMA 與共表達基因在LGG 中的分子調控網絡 利用Coexpedia 數據庫繪制HLA-DMA 與共表達基因在LGG 中的分子調控網絡圖,得到HLA-DMA 的共表達基因數為58 個,見圖5。其中score>2 的共表達基因有20 個:CD74、HLA-DPB1、HLA -DRA、TYROBP、ITGB2、HCLS1、HLA -DQB1、LAIR1、LAPTM5、C1QB、HLA -DMB、FCER1G、MYO1F、C1QA、HLA-DPA1、CD86、CD53、LY86、MS4A6A、RNASET2。
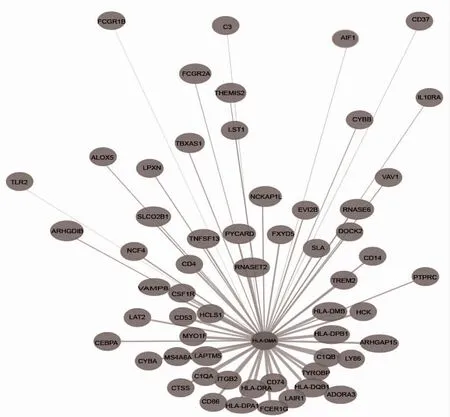
圖5 HLA-DMA 在LGG 中共表達基因的分子網絡
2.6 HLA-DMA 及其共表達基因的注釋與分析 為了解HLA-DMA 與共表達基因在LGG 中的生物學功能,采用Funrich 軟件進行基因注釋分析。結果顯示,分子功能方面,在MHC Ⅰ類受體活性、MHC Ⅱ類受體活性、受體活性、補體活性、T 細胞受體活性中起著重要作用,見表2 。生物學過程方面,12 個基因在免疫反應過程中發揮重要作用,基因占比57.1%(P<0.05),見表3。信號通路方面,主要參與免疫系統、補體系統、STAT4 介導的IL12 信號轉導、信號調節蛋白(SIRP)家族的相互作用、CXCR4 介導信號信號傳遞等多條信號通路,見表4。

表2 HLA-DMA 共表達基因的分子功能

表3 HLA-DMA 共表達基因的生物學過程
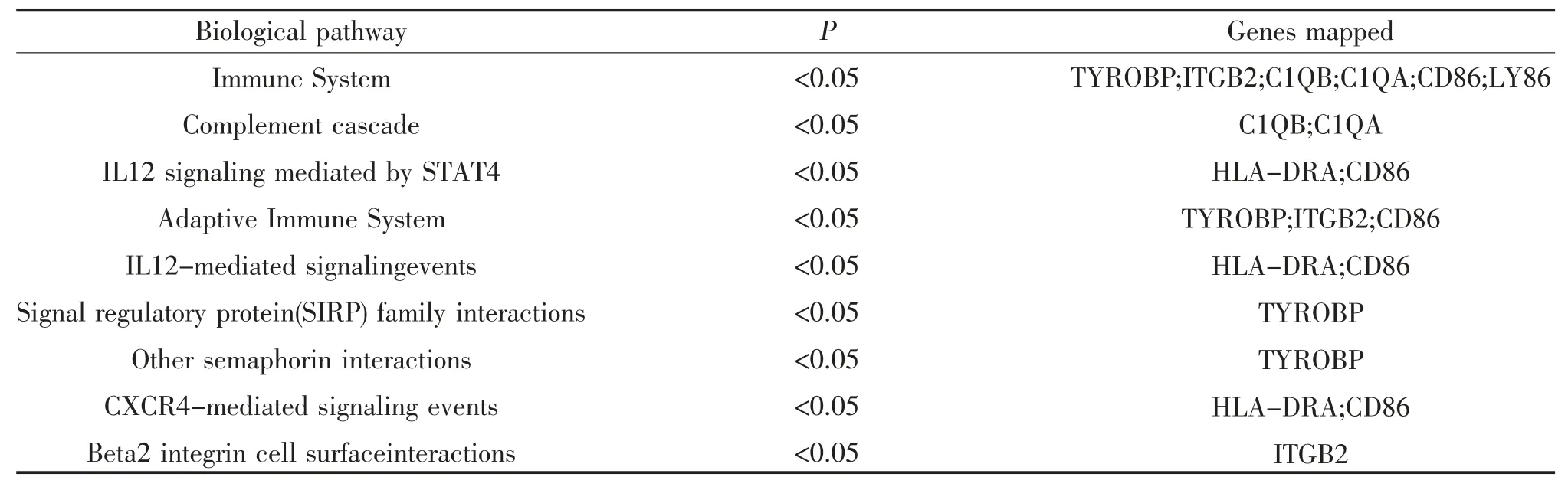
表4 HLA-DMA 共表達基因的信號通路
2.7 GSEA 分析HLA-DMA 相關富集基因集 為了進一步研究HLA-DMA 參與腫瘤調控的機制,利用TCGA 的GSEA 數據集分析HLA-DMA 高表達組所參與的信號通路。結果表明,LGG 中HLA-DMA 高表達組主要富集于JAK-STAT 信號通路、細胞外基(ECM)受體相互作用、NOD 樣受體、自然殺傷細胞介導的細胞毒性作用、細胞凋亡、B 細胞受體信號通路、TOLL 樣受體、蛋白酶體等信號通路,見圖6。
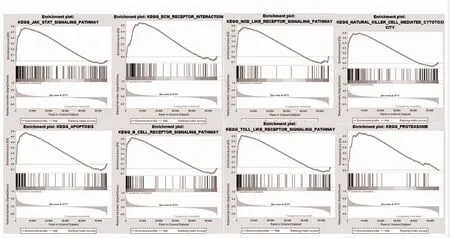
圖6 GSEA 分析HLA-DMA 相關富集基因集
3 討論
低級別膠質瘤是由中樞神經系統(CNS)中的膠質細胞(星形膠質細胞和少突膠質細胞)產生的一組異質性腫瘤,患病人群一般為年輕人,但與膠質母細胞瘤患者相比,其病程更為緩慢,對患者的生活質量影響甚微,所以一般不會對其進行針對性的治療[11-13]。近期有研究表明[14],LGG 是一種原發性腦腫瘤,由于其具有浸潤性,不能通過切除、化療、放療等方法完全根除,經常演變為更高級別的惡性腫瘤。因此篩選敏感、可靠的生物標志物對LGG 的早期診斷和預后評估至關重要。
本研究基于生物信息學方法分析了HLA-DMA在LGG 中的表達及功能。首先,本研究通過GEPIA在線數據庫分析HLA-DMA 在各種類型腫瘤組織中的表達差異,結果表明HLA-DMA 在彌漫性大B細胞淋巴瘤、膽管癌、胰腺癌、多形性膠質細胞瘤、急性髓細胞樣白血病、低級別腦膠質瘤、睪丸癌等腫瘤組織中高表達。其次,本研究應用TCGA 數據庫對HLA-DMA 的表達量與臨床病理特征、生存預后相關性進行了探究,結果顯示與Ⅱ級腫瘤相比,Ⅲ級腫瘤中HLA-DMA 表達上調。并且,高表達HLA-DMA的LGG 患者生存期低于低表達組。此外,單因素和多因素Cox 分析結果也表明HLA-DMA 的表達可作為LGG 患者預后的獨立危險因素。以上結果提示HLA-DMA 可能在LGG 發病過程中作為腫瘤促進因子發揮作用,同時可以作為預后指標預測LGG 患者的生存。
HLA-DMA 位于人類白細胞抗原非經典Ⅱ類區,常與各類自身免疫性疾病相關。有大量文獻表明HLA 類分子通過細胞免疫和體液免疫等免疫功能,清除腫瘤細胞[6]。本研究在GSEA 基因通路富集分析中發現除細胞凋亡信號通路外,B 細胞受體信號通路、NOD 樣受體、自然殺傷細胞介導的細胞毒性作用、TOLL 樣受體信號等與免疫調節相關的信號通路也富集于高表達HLA-DMA 表型中。此外,對HLA-DMA 基因及其共表達基因的生物學過程、分子功能和信號通路進行分析表明,HLA-DMA 與共表達基因主要參與免疫系統的調節等生物學過程。以上結果提示,調控腫瘤免疫反應相關信號通路可能是HLA-DMA 促進LGG 進展的重要機制之一。但HLA-DMA 在免疫調控中的具體作用,以及是否能夠作為LGG 治療靶點,有待進一步研究。
“凋亡”是指細胞程序性死亡[15,16]。當腫瘤發生時,凋亡通路通常會受到抑制,使腫瘤細胞的增殖和侵襲能力增強[17]。所以凋亡通路中的靶向蛋白通過上調促凋亡因子來調節腫瘤細胞的凋亡可能是治療腫瘤的一個較為前景的方向[18]。早期研究報道,在腦膠質瘤中,細胞的抗凋亡能力增強,從而導致治療效果不理想,因此凋亡抑制也是腦膠質瘤治療不理想的原因之[19,20]。本研究通過GSEA 基因通路富集分析發現,細胞凋亡通路在高表達HLA-DMA 表型中顯著富集,提示HLA-DMA 可能還通過調控細胞凋亡途徑來調控LGG 的發生和發展。
綜上所述,HLA-DMA 高表達與LGG 惡性進展密切相關,可能是一個可預測LGG 預后的獨立風險因素。同時,HLA-DMA 可能通過調節免疫,并參與細胞凋亡相關通路影響LGG 的發生、發展。

