紅景天苷衍生物對苯甲酰紅景天苷對MCAO大鼠的神經保護作用
聶婧雯,孫春曉,黃私迎,羅 銳,賴文芳,王穎崢,洪桂祝
(福建中醫藥大學藥學院,福建 福州 350122)
腦卒中是由于血液循環受阻而引起的疾病,約有75%的患者產生不同水平的殘疾,且極易復發。缺血性腦卒中是腦卒中的主要類型,約占87%[1]。組織型纖維蛋白溶酶原激活劑(tissue plasminogen activator,tPA)是臨床首選治療藥物,其治療時間窗窄(僅4.5 h左右),且只對3%~5%的腦卒中病人有治療效果[2]。因此,迫切需要研發更安全、更有效的藥物。
紅景天苷(salidroside,sal)見Fig 1,是中藥紅景天的主要有效成分及藥效物質基礎的標志物。課題組前期研究證明,紅景天苷具有抗炎、抗氧化、抗細胞凋亡的作用[3-5]。由于紅景天苷是多羥基化合物,極性大,水溶性極好,脂溶性差,作用于中樞神經系統時具有局限性。一方面,紅景天苷難以通過脂質膜,不易被腸胃吸收進入組織,亦難透過血腦屏障;另一方面,其在體內易被代謝,藥效降低,藥理活性減弱。一次給藥后,3 h后在血液和腦組織中幾乎檢測不到紅景天苷,其在血液中的半衰期約40 min[6-7]。

Fig 1 Salidroside
為改善紅景天苷的脂溶性、優化傳輸、提高在體內的穩定性,達到增強藥效的目的,課題組對紅景天苷進行了結構修飾,通過酯化紅景天苷分子中苷元上的酚羥基以及糖基上的醇羥基,接入不同的基團,合成了29個紅景天苷衍生物,并進行體外藥效篩選,優選出具有更好療效的衍生物對苯甲酰紅景天苷(pOBz,見Fig 2)[8]。課題組已就pOBz的結構及其應用申報國家發明專利(申請號:201710756613.1)[9]。pOBz對于在體內是否具有更好的改善腦卒中療效,本研究將進一步探討。

Fig 2 pOBz
1 材料
1.1 實驗動物SPF級健康♂SD大鼠72只,體質量(260±10)g,購自上海斯萊克實驗動物有限責任公司,生產許可證號:SCXK(滬)2014-0002,合格證號:2015000518015。于福建中醫藥大學實驗動物中心進行飼養,使用合格證:SYXK(閩)2014-0005,適應性喂養1周。本動物實驗均遵循動物實驗倫理要求。
1.2 實驗藥物與主要試劑對苯甲酰紅景天苷(福建中醫藥大學藥學院提供,純度≥99%,用含5% Tween-80的生理鹽水配制成10 g·L-1);紅景天苷(福建中醫藥大學藥學院提供,純度≥99%,用0.9%生理鹽水配制成10 g·L-1);NeuN抗體(Abcam,貨號:ab177487);β-actin抗體(Trans Gen Biotech,貨號:110813);Bax抗體(貨號:#2772),Bcl-2抗體(貨號:#2762),均購自CST;EGR1抗體(Santa Cruz Biotech,貨號:sc-110)。
1.3 實驗儀器凝膠成像分析系統(Bio-Rad公司,型號:ChemiDoc XRS+);7.0T小動物核磁共振成像儀(德國Broker公司,型號:Biospec70/20 USR);熒光倒置顯微鏡(Leica公司,型號:DMI8);石蠟切片機(Thermo公司,型號:HM325);紫外可見分光光度計(Thermo公司,型號:ND2000C);多功能酶標儀(TECAN公司,型號:Infinite M200 Pro);大鼠腦模具(瑞沃德公司,型號:68709);線栓(廣州佳靈,貨號:L3600)。
2 方法
2.1 分組及給藥
2.1.1不同劑量pOBz對MCAO大鼠的影響 30只健康成年♂SD大鼠,隨機分為Sham組、MCAO組、MCAO+pOBz低、中、高劑量組(25、50、100 mg·kg-1),每組6只。造模成功后,Sham組和MCAO組大鼠腹腔注射(ip)生理鹽水(10 mL·kg-1),對MCAO+pOBz給藥組分別ip 25、50、100 mg·kg-1pOBz,每天記錄體質量,連續給藥2 d后取材。
2.1.2pOBz和Sal對MCAO大鼠的影響 24只健康成年♂SD大鼠,隨機分為Sham組、MCAO組、MCAO+pOBz組和MCAO+Sal組,每組6只。Sham組和MCAO組大鼠ip生理鹽水(10 mL·kg-1),MCAO+pOBz組ip pOBz(50 mg·kg-1),MCAO+Sal組紅景天苷(50 mg·kg-1),給藥1 d后取材。
2.1.3pOBz對MCAO大鼠大腦皮層NeuN表達的影響 18只健康成年♂SD大鼠,隨機分為Sham組、MCAO組和MCAO+pOBz組,每組6只。Sham組和MCAO組大鼠ip生理鹽水(10 mL·kg-1),MCAO+pOBz組ip pOBz(50 mg·kg-1),連續給藥2 d后灌注固定取腦。
2.2 MCAO模型的制備大鼠禁食(不禁水)12 h后,2%戊巴比妥鈉(2 mL·kg-1)麻醉。分離頸總動脈、頸外動脈和頸內動脈,在頸總動脈剪一小口,插入線栓,結扎頸內動脈。阻塞2 h后拔線栓,實現再灌注。Sham組除不插入線栓外,其余操作同MCAO組。手術中維持大鼠體溫,術后自由攝食飲水。待大鼠清醒參考Zea-Longa 5級評分制[10]進行神經功能損傷評分,2~3分說明模型成功,可用于后續實驗。
2.3 取材麻醉大鼠后,使用采血針對腹主動脈放血,剪斷大鼠頸部,剪開頭部的皮膚,暴露頭骨并用線剪剪開,使用手術鉗翻開頭骨,使整個腦組織暴露,取出大腦并分離左右腦,迅速放入做好標記的凍存管中,移入液氮保存。
2.4 MRI檢測MCAO大鼠腦梗死體積將大鼠用異氟烷麻醉,俯臥位固定于動物床上,利用大鼠頭部表面線圈檢測,冠狀定位掃描,采用T2W1增強系列。成像參數:T2W1采用TSE序列,TE 33 ms,TR 2700 ms,24層,矩陣30 mm×30 mm,Rfov 60%,NSA 15,掃描5 min 50 s。
2.5 Western blot檢測蛋白表達提取總蛋白,測定蛋白濃度,經電泳分離總蛋白后,轉膜,5%BSA封閉,一抗4 ℃孵育過夜,各一抗稀釋倍數分別為NeuN(1 ∶3 000)、EGR1(1 ∶1 000)、Bcl-2(1 ∶1 000)及Bax(1 ∶1 000)。TBST洗3次,10 min/次,二抗室溫孵育2 h,TBST洗3次,10 min/次。檢測目標條帶并分析條帶的灰度值。
2.6 免疫熒光染色觀察NeuN的表達將固定24 h的腦組織進行切片、脫水、透化、石蠟包埋及制作組織片。之后脫蠟復水、熱抗原修復,5% BSA封閉2 h,一抗4 ℃孵育過夜,NeuN抗體稀釋倍數(1 ∶200)。次日復溫40 min,PBS搖洗3次,3 min/次。熒光二抗室溫避光孵育2 h,PBS避光搖洗3次,3 min/次。甩去PBS,DAPI染色8 min,PBS避光搖洗3次,每次3 min。采用抗淬滅劑封片,于熒光倒置顯微鏡觀察組織染色情況。

Fig 3 Effect of pOBz on cerebral infarction volume in rats

3 結果
3.1 不同劑量 pOBz對MCAO大鼠的影響
3.1.1pOBz對MCAO大鼠腦梗死體積的影響 同MCAO組比較,MCAO+pOBz中劑量組(50 mg·kg-1)和MCAO+pOBz高劑量組(100 mg·kg-1)的腦梗死體積明顯減少(P<0.01),且50 mg·kg-1pOBz的腦梗死體積改善優于100 mg·kg-1(P<0.05),見Fig 3,4。
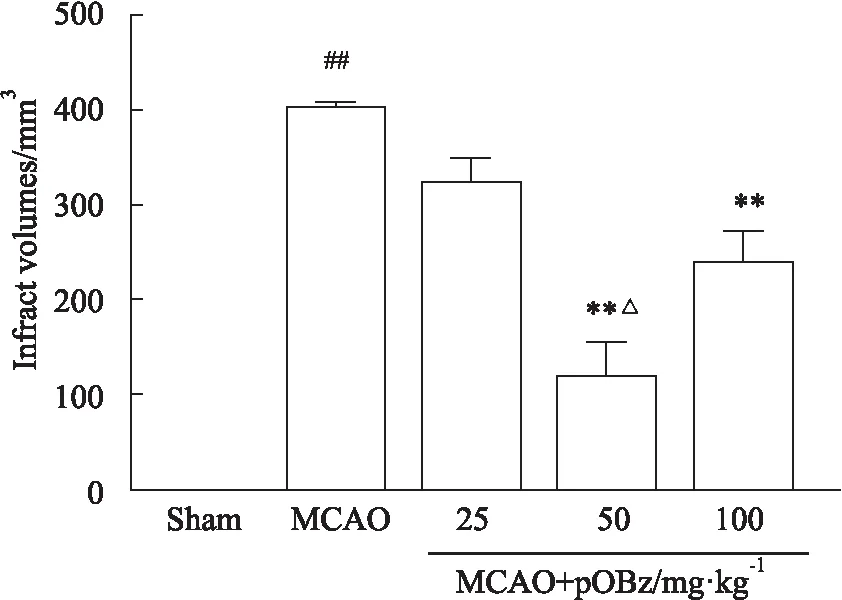
Fig 4 Effects of different doses of pOBz on volume of cerebral infarction in MCAO rats n=6)
3.1.2pOBz對MCAO大鼠神經功能損傷評分的影響 大鼠神經功能損傷評分在2-3分視為造模成功,pOBz給藥后,大鼠神經功能損傷評分呈下降趨勢,50 mg·kg-1pOBz給藥2 d后評分下降(P<0.05),見Fig 5。
3.1.3pOBz對MCAO大鼠體質量減輕的影響 造模后,大鼠的體質量減輕,同MCAO組比較,MCAO+pOBz中劑量組(50 mg·kg-1)(P<0.01)和MCAO+pOBz高劑量組(100 mg·kg-1)(P<0.05)的體質量減輕小于模型組,見Fig 6。

Fig 5 Effects of different doses of pOBz on neurological function damage score of MCAO rats n=6)

Fig 6 Effects of different doses of pOBz on body weight of MCAO rats n=6)
3.2 pOBz和Sal對MCAO大鼠的影響
3.2.1pOBz及Sal對MCAO大鼠NeuN蛋白表達的影響 與Sham組相比,MCAO組大鼠腦組織的NeuN表達減少(P<0.05),pOBz給藥組和Sal給藥組NeuN的表達升高,且pOBz給藥組升高的程度明顯高于Sal給藥組(P<0.05或P<0.01),見Fig 7。

Fig 7 Effects of pOBz and salidroside on NeuN
3.2.2pOBz及Sal對MCAO大鼠的EGR1蛋白表達的影響 與Sham組相比,MCAO大鼠腦組織的EGR1表達減少,pOBz給藥組表達升高,Sal給藥組無明顯變化(P<0.05或P<0.01),見Fig 8。
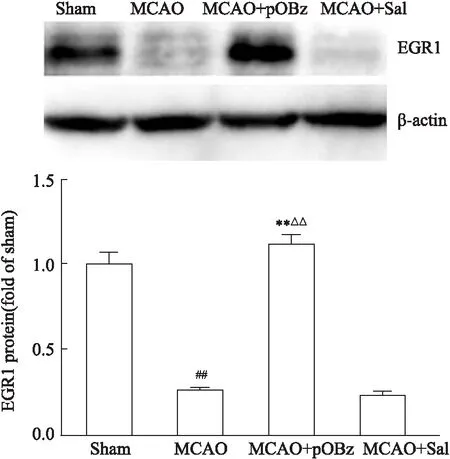
Fig 8 Effects of pOBz and salidroside on EGR1
3.2.3pOBz及Sal對MCAO大鼠的Bcl-2/Bax比值的影響 與Sham組相比,MCAO大鼠腦組織的Bcl-2/Bax比值降低,pOBz給藥組和Sal給藥組增加了Bcl-2/Bax的比值,升高的程度相同,見Fig 9。

Fig 9 Effects of pOBz and salidroside on Bcl-2/Bax
3.3 pOBz對MCAO大鼠大腦皮層NeuN表達的影響與Sham組相比,MCAO大鼠腦組織的NeuN表達減少,且形態上發生改變;pOBz給藥組(50 mg·kg-1)NeuN表達增加,形態上也得到很大程度的恢復,見Fig 10。

Fig 10 Effects of pOBz on NeuN immunofluorescence expression in MCAO rats (400×)
4 討論
本研究采用MCAO模型能夠較好地模擬腦缺血疾病。MRI結果確認了pOBz能夠改善48 h的MCAO大鼠腦梗死體積,并確定最佳給藥劑量是50 mg·kg-1。課題組前期TTC結果顯示pOBz給藥2 d能夠顯著改善MCAO大鼠的腦梗死體積,而Sal給藥2 d沒有改善梗死體積,到d 6 Sal才表現出改善梗死面積。劉俊杰[11]、謝秀利[12]等也報道連續給藥6 d后觀察到Sal改善腦梗死體積。
神經功能損傷評分結果顯示pOBz給藥后評分均呈下降趨勢,50 mg·kg-1pOBz給藥組大鼠的神經功能損傷評分得到顯著改善。課題組前期報道Sal給藥d 6可以觀察到神經功能損傷評分的改善[3],與腦梗死體積結果一致。同時本研究還觀察到,50和100 mg·kg-1pOBz給藥2 d可以顯著改善MCAO大鼠體質量的減少,這在Sal的研究中未見報道。臨床上腦卒中患者發病后機體大量蛋白質損失,加上進食減少,導致營養不良、體質量下降,使得患者預后較差,死亡率提高[13]。神經功能損傷的程度越高,體質量恢復能力就越差,Long等[14]研究表明,促進體質量的恢復可以改善神經功能缺損,二者相輔相成。pOBz給藥2 d可以改善體質量的降低,也反映了對神經缺損的改善,同時體質量的增加促進MCAO大鼠神經功能的改善,有益于疾病預后恢復。
不管是腦梗死還是神經功能損傷,其本質都是由于腦供血中斷導致的神經元損傷和神經功能喪失。目前已經發現Sal在MCAO模型中具有神經保護作用[3,12,15]。神經元核抗原(NeuN)是成熟神經元細胞的標記,MCAO大鼠NeuN減少,是神經元特異質基因的改變[16]。從免疫熒光染色結果中可見pOBz給藥2d對MCAO大鼠NeuN蛋白表達在形態和數量上都有明顯的改善。課題組前期研究顯示,Sal可以升高24h MCAO大鼠NeuN的表達[4],而本研究顯示pOBz誘導NeuN的升高程度優于Sal。EGR1是早期生長反應蛋白之一,缺血性腦卒中發生后關鍵差異表達的基因,其表達可以預防神經元損傷以及減輕腦卒中后的血栓形成和炎癥[4,17]。課題組前期發現,Sal在缺血后24 h不改善EGR1的表達,而48 h后能夠觀察到EGR1升高[3],本研究中pOBz在24 h時即可顯著升高MCAO大鼠EGR1的表達。這些結果提示pOBz在蛋白表達水平對腦缺血/再灌注大鼠的神經保護作用優于Sal。
線粒體在細胞凋亡過程中扮演重要角色。抗凋亡蛋白Bcl-2和促凋亡蛋白Bax蛋白同屬Bcl家族,對調節線粒體膜通透性、線粒體功能及Cyt-c釋放起至關重要的作用。缺血性腦卒中發生后,Bax在腦中表達增加,抑制Bax或表達Bcl-2可減輕缺血性損傷發揮腦保護作用[18]。與Lai等[4]報道Sal改善缺血后24 h MCAO大鼠中Bcl-2和Bax比值相吻合,研究發現紅景天苷與pOBz均能改善MCAO大鼠腦組織Bcl-2 /Bax的比值降低,并且pOBz的改善程度與Sal相當,分析可能的原因有:(1)患側半腦除了神經細胞,膠質細胞、內皮細胞也含有Bcl-2和Bax,檢測結果為患側半腦總蛋白結果,pOBz和Sal抑制神經細胞凋亡的結果并未檢測到;(2)線粒體凋亡相關的蛋白不只有Bcl-2和Bax,還有Bad、Bak、Bcl-xl、Mcl-1等其他指標,本研究中并未全部篩選檢測,pOBz表現出優于Sal的神經保護作用,也有可能是通過其他凋亡靶蛋白來抑制MCAO大鼠腦組織凋亡;(3)pOBz對MCAO大鼠的神經保護作用不僅通過改善線粒體誘導細胞凋亡途徑,還可能通過其它途徑,如通過對大腦炎癥的調控,改善腦內炎癥環境來增強對神經的保護作用。
綜上,pOBz給藥2 d可降低MCAO再灌注大鼠的腦梗死體積,改善體質量減輕,具有優于紅景天苷的神經保護作用,該研究為進一步研究pOBz對MCAO大鼠的神經保護作用打下堅實基礎。

