苯并芘脅迫對泥鰍外周血紅細胞及抗氧化酶活性的影響
楊娜,潘鵬濤,董旭,范培月,吳航利,王佳,雷忻*
苯并芘脅迫對泥鰍外周血紅細胞及抗氧化酶活性的影響
楊娜1,2,潘鵬濤1,2,董旭1,2,范培月1,2,吳航利1,2,王佳1,2,雷忻1,2*
1. 延安大學生命科學學院, 陜西 延安 716000 2. 延安市生態恢復重點實驗室, 陜西 延安 716000
為研究苯并芘對魚類外周血紅細胞及抗氧化酶系的影響,本文以泥鰍作為研究對象,將其暴露于0、5、10、15 μg/LBaP溶液中20 d,分別在5、10、15、20 d時取樣,采用血涂片微核測定法觀察紅細胞微核與核異常,采用鄰苯三酚自氧化法和鉬酸銨比色法分別檢測肝臟超氧化物歧化酶(Superoxide Dismutase, SOD)和過氧化氫酶(Catalase,CAT)活性。結果表明,隨著BaP濃度的升高和暴露時間的延長,泥鰍血紅細胞微核率顯著升高;隨著BaP濃度的升高,泥鰍SOD、CAT活性在20 d的暴露期內呈現出先升高后下降的趨勢。因此,BaP脅迫會對泥鰍產生一定的遺傳毒性和氧化毒性效應,且毒性作用具有時間-劑量效應。
苯并芘; 泥鰍; 血紅細胞; 抗氧化酶
苯并芘(Benzopyrene,BaP),作為一種典型的多環芳烴化合物(Polycyclic Aromatic Hydrocarbons,PAHs),廣泛分布于水生生態系統,以其強致癌、致畸、難降解的特性對水生生物產生毒害作用,造成環境污染、生物多樣性下降[1,2]。近年來大量研究顯示,淡水、海水水體及其沉積物中存在較高含量BaP,對生物體和周圍環境造成極大影響[3,4]。例如,何躍華等研究發現,BaP濃度升高可對海洋生物貽貝造成組織器官氧化損傷,導致細胞轉化和DNA鏈斷裂,且存在一定的劑量-效應關系[5];陳劍杰等通過檢測BaP脅迫下鯉魚肝、腎組織中抗氧化以及非特異性免疫能力發現,隨著苯并芘暴露濃度的升高,鯉魚肝臟、腎臟中SOD、CAT、GSH活性呈現出先上升后下降的趨勢,對鯉魚組織結構造成損傷[6]。隨著陜北地區能源化工基地建設和社會經濟發展,延河流域多環芳烴類化合物污染有加劇的趨勢,其對水生生物的生理生態毒性研究更為迫切。
魚類作為水體污染物通過食物鏈從自然環境向人體遷移的重要載體,是水生生態系統的重要組成部分,能直接或間接地反映水生生態系統的污染情況[7,8]。泥鰍(),隸屬鯉形目(Cypriniformes)、鰍科(Cobitidae)、泥鰍屬(),是一類小型硬骨淡水魚,在我國分布廣泛,且其鉆泥性強、易在實驗室條件下馴養、對污染物較為敏感,故適宜作為實驗材料[9,10]。本研究以泥鰍為實驗動物,檢測不同濃度梯度的BaP對泥鰍外周血紅細胞微核誘導作用以及肝臟超氧化物歧化酶(Superoxide dismutase,SOD)、過氧化氫酶活性(Catalase,CAT)的影響,為了解BaP對魚類的遺傳毒性和氧化毒性提供一定的理論依據。
1 材料與方法
1.1 實驗材料
實驗所用泥鰍平均體重在(10±2.3) g,平均體長在(10.5±2.1) cm。購自陜西省延安市水產動物養殖基地。在實驗室條件下馴養14 d,使用自然晾曬96 h的脫氯自來水,期間喂食少量面包碎屑。挑取體格強健活躍的泥鰍進行實驗,取樣的前一天停止投食。
1.2 暴露實驗
配制3組不同質量濃度苯并芘溶液:5(低濃度組)、10(中濃度組)、15(高濃度組)μg/L以及溶劑對照組。各濃度組設置3個生物學重復組,使用丙酮助溶,配制不同濃度梯度的BaP溶液,每只桶里放置12尾泥鰍。試驗期間,每間隔24 h更換1次藥物,以保證溶液吸收的氧氣含量、酸堿度、溫度和其它理化性質的穩定。換藥后隔天喂食少量飼料或者面包屑,取樣前一天不予喂食。實驗期間每天對泥鰍進行觀察,察看其體色和行為、能力變化,并及時將死亡個體撈出。
1.3 紅細胞微核測定
分別在BaP溶液中5 d、10 d、15 d和20 d時取出泥鰍,進行斷尾取血,制作血涂片,瑞氏-吉姆薩染液染色,用DM6B徠卡正置光學顯微鏡觀察并拍照,每張片子統計3000個外周血細胞。采集核異常、微核圖像并計算微核率。
1.4 肝臟抗氧化酶測定
分別取BaP溶液暴露5 d、10 d、15 d和20 d的泥鰍,快速處死,剖取肝臟,液氮研磨后按比例加入生理鹽水、離心取上清液,保存在4 ℃冰箱。
采用鄰苯三酚自氧化法測定SOD活性,用紫外分光光度計(UV-2600紫外分光光度計,日本津島)在波長320 nm下讀取OD值。鉬酸銨比色法測定CAT活性,用紫外分光光度計在波長405 nm下讀取OD值。
1.5 數據處理
實驗數據用Excel處理以平均數(MEAN)±標準差(SD)表示,采用SPSS20.0進行方差分析(主要是LSD最小顯著差數法和Duncun多重比較),根據分析結果用Origin繪圖。
2 結果與分析
2.1 BaP對泥鰍紅細胞微核與核異常的誘導
如圖1中a箭頭所示,正常紅細胞呈橢圓形,形狀規則,細胞核位于近中央位置。而在不同濃度BaP處理后,泥鰍血紅細胞出現核異常情況,如核不規則現象,即圖b箭頭所指,可見泥鰍血紅細胞核變形。圖c箭頭所指為核空泡現象,圖d所示為微核現象,即細胞核周圍細胞質會生出一個小小的橢圓形的核,一般為主核的1/5~1/20。圖e中箭頭分別指向染色質小顆粒現象。這些現象表明泥鰍在BaP脅迫下,血紅細胞核受到一定的毒害作用。
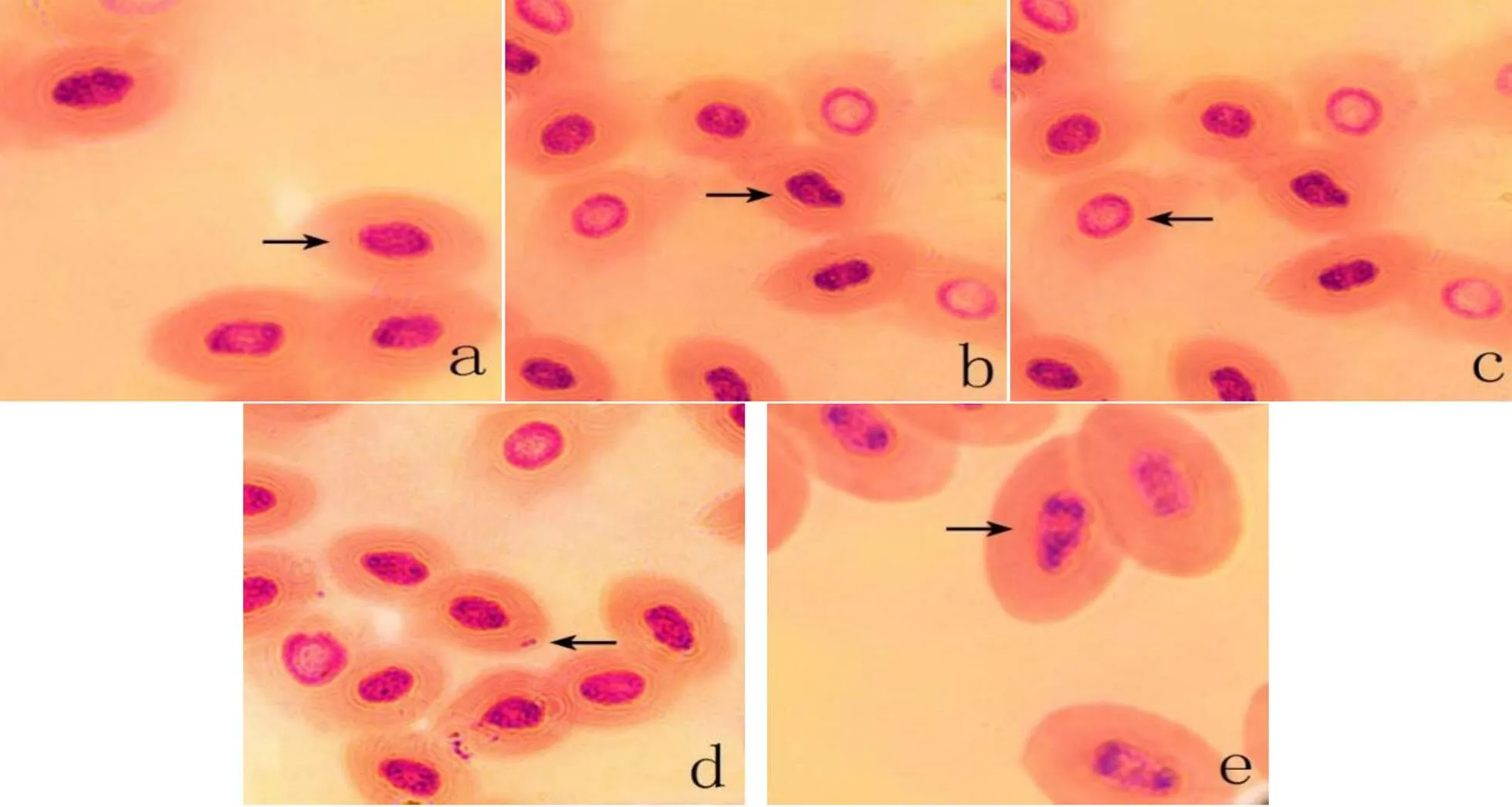
圖 1 BaP處理下泥鰍紅細胞微核與核異常
a.正常紅細胞(×100),b.核變形(×40),c.核空泡(×40),d.微核(×40),e.染色質小顆粒(×100)
a. Normal red blood cells(×100), b. Nuclear deformation(×40), c. Nuclear cavitation(×40), d. Micronuclei(×40), e. Chromatin granules(×100)
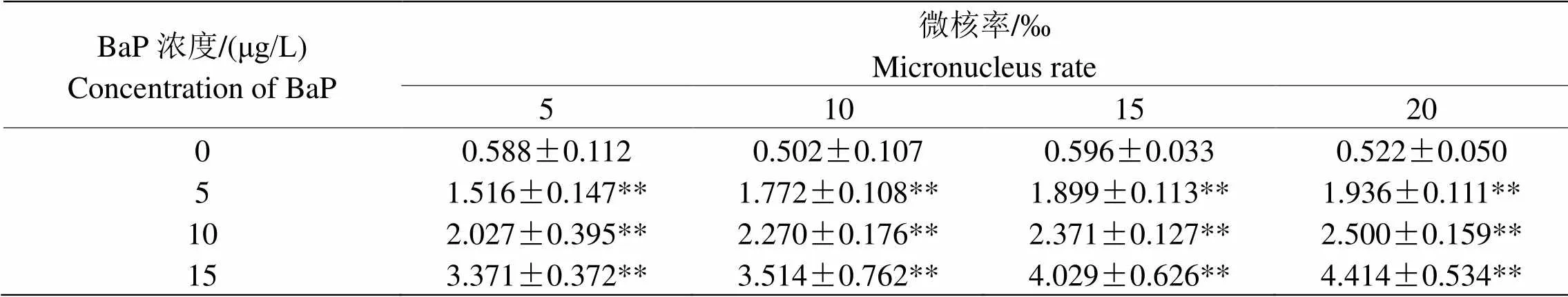
表 1 BaP對泥鰍外周血紅細胞微核率的影響
注:*<0.05,表示與對照組0 μg/L相較差異顯著;**<0.01,表示差異極顯著。
Note: *P< 0.05, Compared with the control group (0 μg/L) , signifying significant difference; **< 0.01, signifying significant difference.
表1可見,BaP各處理組微核率顯著高于對照組。在相同暴露時間,隨著BaP濃度的升高,泥鰍紅細胞微核率上升極其顯著(<0.01);在相同濃度組,泥鰍紅細胞微核率隨暴露時間的延長而極顯著上升(<0.01),且在最高濃度15 μg/L暴露20 d時達到最大值。
2.2 BaP對泥鰍肝臟SOD活性的影響
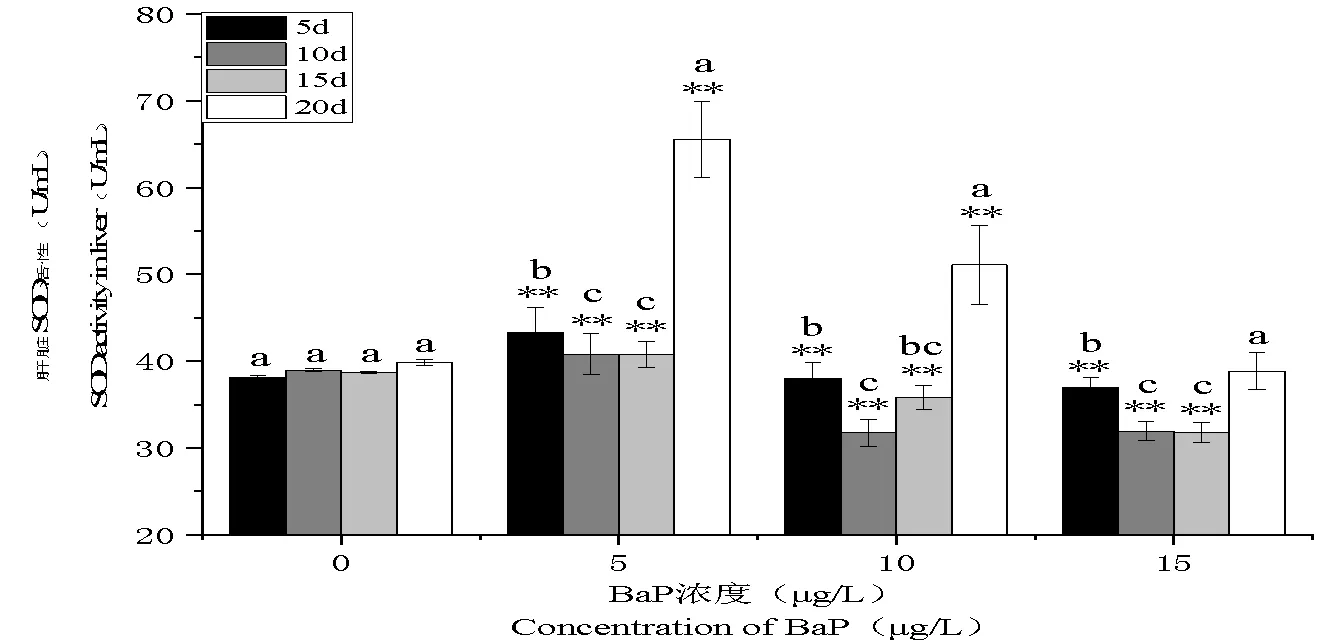
圖 2 BaP對泥鰍肝臟SOD活性的影響
注:*<0.05,表示與對照組差異顯著;**<0.01,表示與對照組差異極顯著;不同字母表示相同濃度組在不同時間差異顯著。
Note: *<0.05, Compared with the Control Group, signifying significant difference; **<0.01, signifying significant difference, letters represent differences in time with the same concentration gradient.
如圖2所示,與對照組相比較,暴露時間達到5 d時,3個BaP濃度處理組泥鰍肝臟SOD活性均呈極顯著升高(<0.01),同時,隨著BaP濃度的升高,SOD活性值變化趨勢表現出先升高后降低的特點,低濃度組(5 μg/L)BaP脅迫下,SOD活性值較其他2組(10 μg/L、15 μg/L)高。除高濃度組(15 μg/L)20 d時,各處理組泥鰍肝臟SOD活性與對照組相比均有極顯著差異(<0.01)。
3個濃度處理組(5 μg/L、10 μg/L、15 μg/L)泥鰍在暴露時間達到10 d時SOD活性均顯著下降(<0.01),20 d時活性又顯著上升(<0.01),在中、高劑量組(10 μg/L、15 μg/L)下SOD活性值達到該組最低值。從暴露時間來看,3個濃度組SOD活性變化隨暴露時間的延長呈先下降后上升的趨勢,在脅迫中、中后期(10、15 d)時SOD活性達到最低值。
2.3 BaP對泥鰍肝臟CAT活性的影響
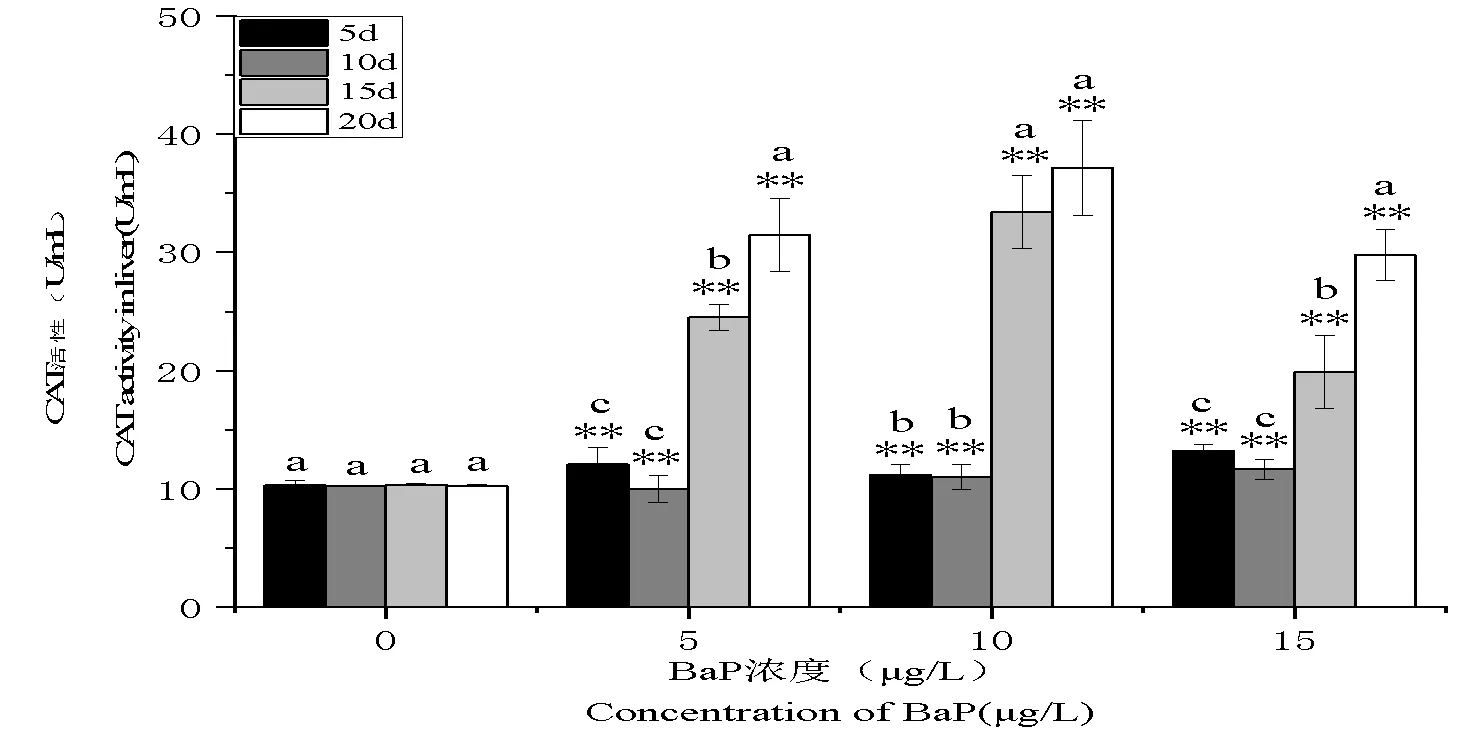
圖 3 BaP對泥鰍肝臟CAT活性的影響
注:*<0.05,表示與對照組差異顯著;**<0.01,表示與對照組差異極顯著;不同字母表示相同濃度組在不同時間差異顯著。
Note: *<0.05, Compared with the Control Group, signifying significant difference; **<0.01, signifying significant difference, letters represent differences in time with the same concentration gradient.
BaP脅迫下,泥鰍肝臟CAT活性變化如圖3所示。與對照組相比,3個BaP濃度組(5 μg/L、10 μg/L、15 μg/L)暴露5d泥鰍肝臟CAT活性均顯著升高(<0.01),同時,隨著BaP濃度的升高,泥鰍肝臟CAT活性呈現出先升高后降低的趨勢。3個BaP濃度組(5 μg/L、10 μg/L、15 μg/L)中,隨著脅迫時間的延長,泥鰍肝臟CAT活性呈現先降低后升高的趨勢,在暴露中期(10 d)達到各濃度組最低值,分別為9.997、11.044、11.677 U/mL,在暴露后期(20 d)時達到最高值,分別為31.487、37.167、29.788 U/mL。且在相同濃度組不同暴露時間比較下,泥鰍肝臟CAT活性前、中期(5 d、10 d)并未有明顯變化,中后、后期(15 d、20 d)呈顯著升高。圖中可見,隨著BaP濃度的升高,CAT活性值會隨之下降,呈現一定的劑量-效應關系。這也說明,BaP脅迫濃度的升高,導致泥鰍肝臟CAT活性恢復緩慢。
3 討論
3.1 BaP對泥鰍遺傳毒性效應
魚類外周血紅細胞微核率的變化,反映其染色體是否出現損傷和損傷程度,進一步指示環境污染情況[11]。蔣玫等[12]通過彗星實驗研究BaP對縊蟶紅細胞DNA損傷發現,隨著BaP濃度的增大和暴露時間的延長,紅細胞DNA鏈斷裂損傷程度以及帶尾彗核DNA百分比增加。姜姍等[13]在研究重金屬對泥鰍細胞DNA損傷及金屬硫蛋白表達影響中發現,暴露在不同濃度硫酸銅和氯化鋅溶液中,泥鰍鰭細胞拖尾率、彗尾DNA比例以及彗尾尾長均顯著高于對照組,表現出一定的遺傳毒性。
本研究通過20 d的靜水實驗法發現,BaP脅迫下泥鰍外周血紅細胞出現微核、胞質突起、核固縮等核異常現象,血紅細胞微核率與BaP暴露濃度以及暴露時間呈正相關,說明一定濃度BaP暴露會誘導泥鰍血紅細胞微核以及核異常現象,這種損傷會隨著BaP脅迫濃度的升高和脅迫時間的延長而加劇,可能是由于BaP脅迫使得泥鰍紅細胞染色體發生斷裂和損傷,形成微核,導致微核率升高。該實驗結果證明了泥鰍血紅細胞對環境污染物BaP響應較為敏感,進一步應用于污染物脅迫下魚類遺傳毒性效應的環境評價。
3.2 BaP對泥鰍氧化毒理效應
已有研究表明,當生物體在受到污染物誘導產生較多的自由基時,體內酶促抗氧化保護機制會被激活,超氧歧化酶、過氧化氫酶活性可以被誘導或抑制[14-16]。戚珍珠等[17]通過研究幼齡泥鰍對壬基酚(Nonylphenol,NP)脅迫的抗氧化酶系響應發現,在15 d的暴露周期內泥鰍肝臟SOD以及CAT活性隨NP質量濃度增大而升高。Strobel Anneli等[18]探究BaP脅迫下南極魚超氧化物歧化酶的變化中發現,暴露在10和100 mg/kgBaP下其肝臟SOD水平一直保持在較高水平。
本研究結果顯示,隨著BaP脅迫濃度的升高,泥鰍肝臟SOD活性呈現出先誘導后抑制的特點。在各個BaP暴露濃度組,泥鰍肝臟SOD活性在暴露早期(5~10 d)表現出抑制作用,這說明BaP對泥鰍肝臟造成了氧化損傷,隨著時間的延長SOD活性升高說明泥鰍在適應環境的過程中,體內抗氧化保護機制被激活,抵御自身受到的氧化損傷。尚泰宇[19]在氰氟草酯脅迫對泥鰍抗氧化酶活性影響研究中發現,氰氟草酯脅迫對泥鰍體內SOD活性影響隨著暴露濃度的升高表現為先抑制后誘導的趨勢,這與我們的實驗結果一致。此外,本實驗還發現在高濃度BaP暴露下,泥鰍肝臟SOD活性雖也表現出先抑制后誘導,但其誘導作用并沒有低濃度的顯著,我們判斷可能是因為苯并芘對泥鰍肝臟造成了不可逆損傷,導致泥鰍SOD活性恢復緩慢。
過氧化氫酶存在于紅細胞及某些組織內的過氧化體中,它的主要作用是催化H2O2分解為H2O與O2,避免生成非常有害的-OH[20,21]。研究表明,隨著污染物濃度的升高,生物體內CAT活性會隨著SOD活性上升同時被激活,抵御減少氧化應激損傷,但隨著污染物濃度的持續升高、不斷對生物體造成破壞導致CAT活性被抑制。蔣潤蘭等[22,23]通過對菲脅迫下中華絨螯蟹急性毒性效應的研究表明,各濃度梯度菲暴露下肝胰腺和鰓組織中的CAT活性被誘導呈現顯著的劑量-效應關系。再者,關曉燕等[24]通過研究蝦夷扇貝暴露在BaP下血清SOD、CAT活性發現,SOD活性與CAT活性變化在前期呈顯著負相關、后期顯著負相關,且具有顯著的劑量-效應關系和時效關系。
在本研究中,隨著BaP濃度的升高,泥鰍肝臟中CAT活性呈現出先誘導后抑制的特點。暴露前期(5~10 d),泥鰍肝臟CAT活性表現出抑制作用,隨著暴露時間的延長(15~20 d)CAT活性升高,表明泥鰍對所處環境已經有了一定的適應。比較可見,隨著BaP濃度的升高,泥鰍肝臟SOD和CAT活性都呈現先上升后下降的趨勢。出現這種情況的原因可能是低濃度BaP暴露下,泥鰍體內染毒、內穩態遭到破壞,體內SOD和CAT活性被誘導;但隨著BaP暴露濃度的升高,生物的自我調節能力有限、機體損傷嚴重,故SOD和CAT活性被抑制。同時,在各濃度梯度組中,隨著暴露時間的延長,泥鰍肝臟SOD和CAT活性都呈現先下降后上升的趨勢。這可能是由于在暴露早期泥鰍急性染毒各項生理指標下降,導致暴露早、中期(5 d、10 d)泥鰍肝臟SOD、CAT活性下降,隨后各項生理指標逐漸恢復,機體抵御減少氧化應激損傷,導致SOD、CAT活性被誘導。
此外,我們還發現苯并芘脅迫下對泥鰍肝臟CAT活性與SOD活性誘導存在一定的差異,這主要體現在暴露早期對SOD抑制作用較CAT強;隨著BaP暴露時間延長,BaP對CAT活性的誘導作用較SOD顯著,這也說明CAT活性對BaP脅迫更為敏感。Liang J等[25]在十溴聯苯醚和鐵對蚯蚓抗氧化酶系影響研究中,也得到了CAT活性誘導作用更為敏感的結果。
因此,我們在應用抗氧化酶系對水體內苯并芘監測時,生物體血紅細胞微核率、SOD活性、CAT活性這幾個指標可用于監測環境,且從SOD活性與CAT活性兩項指標的變化進行分析,依據二者作用的不一致性綜合分析,能夠更準確的分析苯并芘的環境毒理學效應。
[1] Chen KG, Kang RR, Sun Q,. Resveratrol ameliorates disorders of mitochondrial biogenesis and mitophagy in rats continuously exposed to benzo(a)pyrene from embryonic development through adolescence [J].Toxicology, 2020,442:152532
[2] 孫嘉,黃藝,韓萍,等.苯并(a)芘誘導對雙齒圍沙蠶腺苷酸環化酶(AC)基因及酶活性表達的影響[J].大連海洋大學 學報,2020,35(3):368-75
[3] Zhuo CY, Hu SJ, Yang Y,Effects of the structures and micropores of sedimentary organic matter on the oxidative degradation of benzo(a)pyrene by Na2S2O8 [J].Water research, 2020,174:115635
[4] Islam J, Shree A, Afzal SM,. Protective effect of Diosmin against benzo(a)pyrene‐induced lung injury in Swiss Albino Mice [J]. Environmental Toxicology, 2020,35(7):747-757
[5] 何躍華.苯并芘和鎘單一及復合暴露下厚殼貽貝抗氧化反應以及CYP3A基因的表達[D].杭州:浙江海洋大學,2019
[6] 陳劍杰,曹謹玲,賀鑫晉,等.苯并芘(BaP)對鯉魚肝、腎抗氧化、非特異性免疫能力及組織結構的影響[J].核農學報,2019,33(3):623-630
[7] 劉濤,李蓉,肖蘅,等.RAD-seq技術在魚類基因組學中的研究進展[J].云南大學學報(自然科學版),2018;40(6):1283-1289
[8] 張靈.魚類毒理蛋白質組學研究進展:以海洋青鳉魚和斑馬魚為例[J].海洋環境科學,2015,34(4):616-621
[9] 李政,何歡祺,張天旭,等.典型底棲生物泥鰍的急性毒性物種敏感性評價[J].生態與農村環境學報,2019,35(3):392-397
[10] 陳玉明,盧少勇,朱旭,等.泥鰍在污染物毒性評價中的應用[J].生態毒理學報,2013,8(4):447-455
[11] 張貴生.鄰苯二甲酸二乙基己酯對鯉非特異性免疫的影響及遺傳毒性[J].水生生物學報,2014,38(4):729-736
[12] 蔣玫,李磊,沈新強,等.苯并[a]芘和菲對縊蟶血細胞DNA損傷的研究[J].生態毒理學報,2015,10(3):281-287
[13] 姜姍,李霞,李狀狀,等.銅、鋅對泥鰍細胞DNA損傷及金屬硫蛋白表達的影響[J].水產科學,2020,39(3):381-387
[14] 林芳,毛楷林,江秀,等. BaP和DDT暴露對翡翠貽貝胚胎重要酶活性影響的比較研究[J].生態毒理學報,2018,13(3):129-137
[15] Derakhshesh N, Salamat N, Movahedinia A,. Exposure of liver cell culture from the orange-spotted grouper, Epinephelus coioides, to benzo[a]pyrene and light results in oxidative damage as measured by antioxidant enzymes [J]. Chemosphere, 2019,226(3):534-544
[16] 邢艷帥,朱桂芬.重金屬對水生生物的生態毒理效應及生物耐受機制研究進展[J].生態毒理學報,2017,12(3):13-26
[17] 戚珍珠,雷忻,王文強,等.壬基酚脅迫對幼齡泥鰍雌激素活性及抗氧化酶活力的影響[J].西北農林科技大學學報 (自然科學版),2017,45(2):49-55
[18] Anneli SCMF, Helmut S, Patricia BH. Expression of aryl hydrocarbon receptor-regulated genes and superoxide dismutase in the Antarctic eelpout Pachycara brachycephalum exposed to benzo[a]pyrene [J]. Environmental toxicology and chemistry, 2018,37(5):1487-1495
[19] 尚泰宇,時春雨,秦朝輝,等.氰氟草酯對泥鰍的毒性效應[J].河南農業科學,2019,48(9):162-167
[20] 許友卿,張青紅,張茜,等.對多氯聯苯敏感的水生動物生物標志物[J].水產科學,2015,34(1):66-70
[21] 王召,彭舒,孟立霞.噻蟲嗪對鯽魚的急性毒性和抗氧化酶及乙酰膽堿酯酶活性的影響[J].水產科學,2020,39(6):922-927
[22] 蔣閏蘭.菲對中華絨螯蟹()毒性效應的研究[D].上海:華東師范大學,2015
[23] 蔣閏蘭,肖佰財,張帆,等.菲脅迫對中華絨螯蟹()的急性毒性效應[J].應用與環境生物學報,2015,21(1):108-114
[24] 關曉燕,王擺,董穎,等.二甲苯、蒽、苯并[α]芘對蝦夷扇貝幼貝血清SOD、CAT活性的影響[J].生態毒理學報,2016,11(1):289-294
[25] Liang J, Xia XQ, Zaman WQ,. Bioaccumulation and toxic effects of decabromodiphenyl ether in the presence of nanoscale zero-valent iron in an earthworm–soil system [J]. Chemosphere, 2017,169(11):78-88
Effects of Benzo(a)pyrene Stress on Erythrocyte and Antioxidant Enzyme Activities in the Peripheral Blood of
YANG Na1,2, PAN Peng-tao1,2, DONG Xu1,2, FAN Pei-yue1,2, WU Hang-li1,2, WANG Jia1,2, LEI Xin1,2*
1.716000,2.716000,
To study the effect of Benzo(a)pyrene on erythrocyte and antioxidant enzyme activities in fish, loach was exposed to 0,5,10 and 15 μg/L BaP solution for 20 days. During the BaP treatment, the blood and liver were collected on 5,10,15 and 20 days. The erythrocyte micronucleus and nuclear abnormality were detected by blood smear, the activities of superoxide dismutase (SOD) and catalase (CAT) in liver were measured by pyrogallol autoxidation and ammonium molybdate colorimetry. The results showed that: (1) With the increase of BaP concentration and exposure time, the micronucleus rate of erythrocytes ofincreased significantly. (2) With the increase of BaP concentration, the activities of SOD and CAT ofincreased at first and then decreased during 20 days of exposure. Therfore, BaP stress could induce certain genotoxicity and oxidative toxicity to, and the toxicity had time-dose effect.
Benzo(a)pyrene;; blood erythrocyte; antioxidant enzymes
S917
A
1000-2324(2021)06-0936-06
2021-04-27
2021-05-15
陜西省自然科學基礎研究計劃面上項目(2021JM-417);延安市科技惠民計劃項目(2017HM-05);陜西省大學生創新創業訓練計劃項目(S201910719037)
楊娜(1997-),女,在讀研究生,主要從事水生態毒理學研究. E-mail:yangna970618@126.com
通訊作者:Author for correspondence. E-mail:leizz66@126.com

