影像組學在胃腫瘤診療中的應用進展及挑戰*
張璐希,程云章,黃陳,張明偉,李凱
(1.上海理工大學 上海介入醫療器械工程技術研究中心,上海 200093;2.上海交通大學附屬第一人民醫院胃腸外科,上海 200025)
引言
胃腫瘤作為發病率和病死率居于前列的消化道腫瘤疾病,對其進行術前影像學檢查,精準評估胃腫瘤的良惡性及分期至關重要。臨床上主要依靠上提取消化道造影、超聲胃鏡(endoscopic ultrasonography,EUS)、計算機斷層掃描(computed tomography,CT)等圖像中的形態學特征,來鑒別胃腫瘤的良惡性及分期,輔助醫生制定個體化治療方案。但因醫師經驗差異,在診斷上存在一定的主觀性[1]。隨著腫瘤診療模式開始向精準醫療發展,傳統醫學影像中形態學指標的主觀判斷已無法完成腫瘤的精準量化。影像組學通過提取腫瘤的高通量特征,將醫學圖像轉換成高維數據,通過系統化分析,提取出關鍵信息來評估惡性腫瘤分期、良性腫瘤危險因素分級、腫瘤異質性、腫瘤分子生物分型,設計精準化治療方案[2-4],更加符合精準醫療的發展趨勢[5]。本文就影像組學在胃腫瘤的鑒別診斷、轉移預測、病理學研究及術后療效評價的研究進展進行綜述,評價其優勢及局限性,并對影像組學在胃腫瘤診療的應用前景進行展望。
1 胃腫瘤影像組學的研究流程
影像組學流程主要包括:原始影像數據獲取、圖像感興趣區(ROI)分割(見圖1)、定量特征的提取和篩選、模型建立及臨床應用。其中ROI的精確分割是獲取準確特征值的關鍵,也是影響胃腫瘤影像組學精度的重要因素。目前對胃腫瘤ROI的分割方式有:軟件自動化分割、經驗豐富的臨床醫師手動勾畫和利用半自動化軟件選擇。手動勾畫方式對醫師經驗的依賴度高、費時費力。軟件自動化分割工作效率高,但分割效果差,無法做到對腫瘤邊界的精準勾畫。半自動分割技術(例如3D-Slicer軟件)綜合前兩種方法的優點,在機器完成大部分勾畫工作后,研究者只需對少量腫瘤邊界進行部分修改。
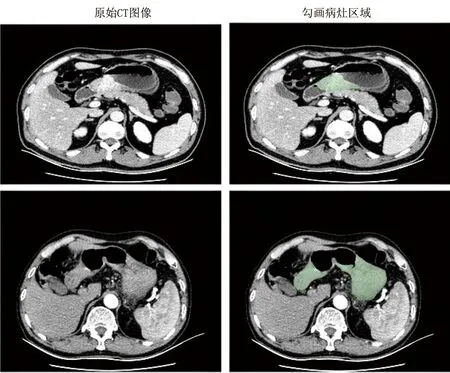
圖1 胃癌病灶勾畫示意圖Fig.1 Sketch of gastric cancer lesions
胃腫瘤的影像組學特征數據主要包括影像強度(腫瘤的大小、直徑的標準差、能量等,約40余種)、影像形態(腫瘤的密度、體積等,約30余種)、影像紋理(包括灰度、熵值、共生矩陣特征等,約200余種)、影像高階特征(包括邊界、粘面自由比值,約300余種)等。對胃腫瘤三維ROI進行影像組學特征提取,并根據影像組學特征建立胃腫瘤評價模型,可輔助醫生決策。隨著人工智能技術在臨床上的廣泛應用,通過機器學習建立胃腫瘤影像組學的精確診斷和預后預測模型取得了長足發展[6]。
2 影像組學在臨床研究中的進展
2.1 影像組學用于胃腫瘤鑒別診斷的研究進展
胃部惡性腫瘤主要包括胃癌、胃淋巴瘤和胃惡性間質瘤,三者在臨床及影像學表現上存在一定的重疊,但治療方案卻不盡相同,術前精確診斷至關重要。鄧嬌等[7]回顧性研究28例原發性胃淋巴瘤患者和43例Borrmann Ⅳ型胃癌患者的增強CT影像,提取影像組學特征,同時組入胃周脂肪浸潤、胃壁柔軟度、黏膜白線征及腹水臨床征象,建立影像組學模型。研究結果顯示,影像組學模型的敏感性(93.00%)、特異性(96.40%)、AUC(0.964)均高于CT征象模型,具有更優的準確性。同期也有研究[8]證實,在影像組學模型中納入患者臨床信息,有助于提高胃腫瘤診斷的準確性。Sun等[9]通過觀察經術后證實為胃癌和胃間質瘤的CT增強圖像,建立臨床主觀CT征象模型、放射組學模型及兩者組合診斷模型,發現組合診斷模型的AUC值(0.903)、特異性(93.33%)和準確性(86.00%)均為最高。上述研究表明,影像組學特征結合臨床特征可以更全面地評估腫瘤信息,能夠顯著提高診斷準確性,且穩定性較好,可輔助臨床診斷。
以上研究均采取門靜脈期CT圖像進行紋理特征提取,不同期相的紋理特征在胃腫瘤鑒別診斷方面的預測準確性顯著不同。相關研究[10]結果顯示,動脈期紋理特征,在鑒別胃腸道腫瘤和胃淋巴瘤、胃淋巴瘤和腺癌中效果顯著;靜脈期紋理特征在鑒別腺癌和胃腸道腫瘤、預測腺癌分級中準確性較高。總結見表1。

表1 胃腫瘤鑒別診斷研究文獻總結
2.2 影像組學用于胃癌分期及轉移預測的研究進展
精準分期可對患者進行適當的干預治療,提高患者生存質量。常用的胃癌分期為美國癌癥聯合委員會(American Joint Committee on Cancer,AJCC)的TNM分期系統,其主要描述原發腫瘤的浸潤程度、淋巴結受累范圍,及是否存在遠處轉移。目前胃癌分期的主要成像方式是EUS,需引進影像組學新方法來無創地評估腫瘤分期[11],改善臨床決策。
中國臨床腫瘤協會建議T3期及以上患者行術前新輔助化療,精準評估患者T分期,有助于制定精準化、個體化治療方案。有報道[12]根據紋理分析發現,大量的表觀擴散系數直方圖參數在不同T階段間存在顯著差異。Wang等[13]探討CT放射組學在鑒別T2和T3/4期胃癌中的價值,采用類內相關系數篩選特征并構建隨機森林影像組學模型,結果顯示,動脈期模型準確率較高,為75.40%~84.10%。以上研究表明,影像組學模型可為T期病理鑒別提供潛在價值。
對于胃癌N分期患者,準確評估淋巴結轉移情況對于確定手術及輔助化療方案至關重要。如Gao等[14]觀察分析463例行根治性胃癌切除術患者的CT增強圖像預測早期胃癌淋巴結轉移情況,提取859個影像組學特征,利用最小絕對收縮和選擇算子(least absolute shrinkage and selection operator ,Lasso)方法進行篩選降維,同時結合CT顯示的淋巴結狀態構建模型。研究結果顯示,在訓練組和測試組AUC分別為0.91、0.89,模型具有良好的穩定性,該研究表明影像組學可以預測胃癌淋巴結轉移,為個體化治療方案提供指導意見。
腹膜轉移是常見的胃癌遠處轉移,是導致胃癌患者死亡的主要原因之一,精確術前診斷可以輔助制定治療決策。Dong等[15]應用影像組學列線圖方法行晚期胃癌患者隱匿性腹膜轉移的術前診斷。通過勾畫原發腫瘤(RS1)和腹膜區(RS2)兩個ROI區域,利用Lasso logistic回歸篩選放射組學特征,以列線圖可視化顯示,訓練組AUC最高達0.958。該研究結果強調了腹膜區的表型特征對胃癌轉移預測具有增益價值。
目前對胃癌的研究多數是基于單源CT圖像,而能譜CT成像作為一項新技術,可以融合圖像、碘基質圖等[16-17],提供包含更多腫瘤微環境的信息,為胃癌分期預測提供新思路[18-19]。Chen等[20]通過分析DECT衍生120 kV混合能量圖像及碘攝取圖像(IU),構建了基于R_IU、R_MIX及組合特征的隨機森林影像組學模型,預測胃癌腹膜轉移。結果顯示,相較于傳統的影像組學模型,基于碘攝取圖像的影像組學模型結果最優(AUC=0.981)。因此,雙能CT可獲取更豐富的腫瘤異質性信息,預測胃癌腹膜轉移方面優于增強CT。上述研究表明,影像組學模型有望成為評估胃癌淋巴結轉移及遠處轉移風險的非侵入性工具,為胃癌患者提供更優的預后判斷。
2.3 影像組學應用于胃癌組織病理學的研究進展
胃癌組織病理學特征主要包括分化程度、Lauren分型等,臨床診斷金標準為胃鏡活檢,但活檢具有局限性和有創性。近年來,已有研究證明影像組學特征可作為非侵入性成像生物標記物反映腫瘤異質性,從而預測組織病理學特征[21]。寸紅麗等[22]納入109例胃癌患者的CT圖像,篩選出最具意義的特征參數構建模型,證實影像組學特征對診斷胃癌分化程度具有一定的應用價值。Wang等[23]利用放射組學列線圖區分胃癌Lauren分型,納入不同特征構建多種模型,結果顯示,放射組學列線圖的AUC、敏感度、準確度均最高,是目前較準確、高效的Lauren分型的無創預測工具。上述研究表明,影像組學模型可作為胃癌組織病理學預測的輔助方法,進一步幫助合理制定個體化診療方案。
隨著人工智能技術的快速發展,學者們開始關注于深度學習的影像組學研究。其中,一方面是利用卷積神經網絡提取深度學習特征,與手工影像特征相結合,構建深度影像組學模型,實現疾病預測。如Sun等[24]預測胃癌漿膜浸潤程度,采集深度特征和放射組學特征,分別構建臨床特征模型、放射組學特征模型、深度特征模型和聯合臨床及放射組學特征的列線圖,結果顯示,放射組學列線圖的診斷準確性最高,深度學習模型診斷準確性略低于放射組學列線圖,但也可有效識別胃癌漿膜侵犯。有研究[25]融合深度學習放射組學特征預測胃癌Ki-67的表達水平,聯合模型診斷效果優于僅包含影像組學標簽的模型,有助于提高預測準確度。
另一方面是利用端到端的卷積神經網絡自動實現深度特征提取完成疾病預測。Jiang等[26]首次提出基于CT圖像采用卷積神經網絡模型對腫瘤間質環境進行無創評估。該研究使用數據增強技術彌補數據量少的缺點,降低過擬合風險,提高了腫瘤間質分類的預測準確性,同時深度特征被證實是胃癌切除術后輔助化療預后及生存期的預測因子,預測準確率達90%。上述研究結果對于實現自動化影像組學研究具有較大意義。總結見表2。

表2 胃癌組織病理學研究文獻總結
2.4 影像組學用于胃癌療效評價及預后預測的研究進展
目前胃癌主要治療方式為根治性手術聯合輔助治療,如免疫治療、靶向治療、放療、新輔助化療等。由于患者耐受性及對治療方式的接受度不同,術前準確預測患者預后情況,對制定個性化治療方案至關重要[27]。
Giganti等[28]報道了基于MDCT圖像的紋理特征與胃癌患者總生存期的相關性研究,發現最大HU值、偏度、均方根、能量、熵和平均絕對偏差與較差預后顯著相關,證實紋理特征可以有效改善胃癌風險分層多因素預后模型的性能。同樣,有研究[29-30]基于胃癌CT圖像構建影像組學模型預測患者生存期,結果顯示,相較于TNM分期和臨床特征模型,放射組學模型可以更好地預測患者的遠期生存。
早期胃癌患者在不進行化療的情況下仍有較好的預后,但遠處轉移患者需要系統化療而非手術切除。多數研究[31-34]主要聚焦于進展期胃癌CT圖像,利用影像組學模型預測患者對新輔助化療(NAC)的反應。Shin等[35]使用帶有懲罰的最小絕對收縮和選擇算子的Cox回歸建立影像組學模型,預測局部進展期胃癌無復發生存期(RFS)預后情況,結果顯示具有良好的RFS預測效果,優于臨床模型。影像組學可為進展期胃癌患者術前治療決策提供客觀、準確的臨床信息,且無需任何侵入性操作。Zhang等[36]建立了一種殘差卷積神經網絡模型預測胃癌患者的總生存期(overall survival, OS),并與臨床特征模型和放射組學模型進行比較,結果顯示,深度學習模型的預測能力最優。相較于其他研究,此模型通過加入數據增強和殘差網絡,減少了數據過擬合,提高了深度學習模型的魯棒性及預測準確性。
3 胃腫瘤影像組學研究的挑戰與對策
影像組學是一門多領域融合的新興技術,仍有較多問題等待解決。首先是研究方法的標準化,在圖像獲取時,采集設備、圖像預處理方法、ROI分割閾值設置及機器學習算法選擇等不同,均會對圖像質量產生影響。例如胃腫瘤ROI勾畫方法尚無技術上的統一,導致研究結果的可重復性及準確性降低;不同采集儀器的造影劑濃度、掃描參數設置及噪聲指數等遵循不同標準,導致影像組學模型的不穩定性增加[37]。對圖像獲取、圖像預處理、ROI勾畫、相關特征的選擇等步驟進行標準化,有助于提高研究結果的準確性及可重復性。此外,胃腫瘤的放射組學特征與腫瘤異質性間雖無直接聯系,但放射組學特征與胃腫瘤患者病理信息的有無相關性研究尚待進一步探索。影像組學在胃腫瘤研究方面多是回顧性、單中心研究,受限于樣本量不足,容易造成數據過擬合,未來應采用標準技術建立共享數據庫,推動胃腫瘤影像組學快速發展[38]
4 展望
影像組學是大數據技術與醫學影像輔助診斷的有機融合,可以充分挖掘醫學圖像中肉眼無法發現的潛在信息。在胃腫瘤臨床研究中,影像組學通過提取腫瘤區域影像強度、形態、紋理、高階特征等,結合臨床、病理信息建立模型,從而更有效地評估整個腫瘤區域與其周圍組織的差異,反映腫瘤時間及空間異質性,以此完成胃腫瘤的鑒別診斷、轉移預測、病理學研究及術后療效評價。胃癌影像組學已取得初步發展,未來將通過多中心臨床研究[39]挖掘反映胃腫瘤異質性的通用特征,開發針對不同胃腫瘤的通用影像組學計算機軟件,完成對高度復雜、信息量龐大的醫學圖像的數據挖掘,為傳統活檢提供影像補充信息,更好地輔助臨床醫生完成高精度診斷,減少放射影像科醫師的工作強度。后續研究中,實現對影像學特征識別的統一化、標準化,將是影像組學在胃腫瘤領域的研究重點。

