三種水質調控方式對春秋季刺參池塘水細菌菌群結構的影響
張東升,周 瑋
三種水質調控方式對春秋季刺參池塘水細菌菌群結構的影響
張東升1,2,周 瑋1※
(1. 大連海洋大學水產與生命學院,大連 116023;2. 大連海洋大學農業農村部北方海水增養殖重點實驗室,大連 116023)
通過16SrRNA高通量測序技術,以自然納潮和微孔曝氣兩種水質調控方式池塘為對照,研究了養水機水質調控方式對春秋季刺參養殖池塘水細菌菌群結構的影響。結果表明:各池塘水前10優勢門和前3優勢綱組成基本一致,但優勢屬組成差異較大;試驗后期(11月份),養水機池塘水與自然納潮池塘水和微孔曝氣池塘水中某些種群豐度具有明顯的差異,養水機顯著提高了池塘水乳酸菌目的豐度(lefse分析LDA Score>4),分別提高了251和343倍,顯著降低了交替假單胞菌科和屬的豐度(-test檢驗),各池塘水優勢功能菌為化能異養菌12.78%~19.65%和好氧化能異養菌0.96%~4.97%,各功能菌豐度均值差異不顯著,但試驗后期養水機池塘水發酵菌和植物致病菌豐度增加明顯,比自然納潮池塘和微孔曝氣池塘分別提高了32、50和159、216倍;硝酸鹽還原菌豐度降低明顯,養水機池塘水-多樣性最高,養水機顯著提高了池塘水乳酸菌和植物致病菌豐度,提高了細菌種群的-多樣性,前者抑制池塘大型藻生長,后者有益于水質穩定。
水產養殖;群落組成;水質調控;養水機;功能菌;FAPRTAX;刺參池塘
0 引 言
細菌菌群組成和功能特點與環境息息相關,不同環境其細菌菌群組成和功能特點不同[1],因此測定環境中細菌菌群組成和功能特點,不僅能指示環境好壞及環境物質組成,也能為矯正環境提供理論和技術指導[2],因此人們在改善池塘、湖泊、河流生態時,往往測定水質或沉積物中的細菌菌群組成和功能特點以及他們與環境中物理化學及生物參數的關系[3-9],以期了解不同水質改良技術對細菌菌群、物理化學參數的影響,探討細菌菌群與環境因子的關系,為以后的水質調控提供技術指導。
近30年遼寧、山東地區刺參養殖發展迅速,而隨著養殖時間的延長,刺參疾病頻發,主要原因在于池塘環境不佳,池塘底部沉積大量有機物,且在2、6月份池塘形成的溫鹽躍層[10-11],加據了池塘環境惡化,導致刺參疾病甚至死亡,降低了漁民收入,因此,刺參池塘水質調控勢在必行[10]。
為了解引起刺參疾病的主要細菌種群,不少科研工作者對刺參養殖池塘細菌菌群進行了研究[12-14],為預防刺參疾病提供技術支撐,然而水質調控對刺參池塘微生物菌群和功能的影響報道較少。目前刺參養殖池塘的主要水質物理調控方式為自然納潮和微孔曝氣,前者為刺參養殖池塘普遍采用的一種方式,后者是部分池塘采用的方式,后者在改良水質方面比前者有優勢,但其設備通氣孔易堵塞,難以清理,費用較高,同時2種水質調控方式池塘均存在水體分層和大型藻生長旺盛現象,尤其夏、秋季,池塘生長的大型藻纏繞刺參,致其死亡;大型藻在秋季死亡后,嚴重污染池塘,為更好地解決上述問題,本課題組研制了一種新型水質改良機-養水機,為探討養水機對池塘水質改良效果,王祖峰[10]報道了養水機對池塘水體分層及水質的影響,孫廣偉等[11]報道了養水機對池塘生產力的影響,均表明養水機對池塘2、6月份的池塘水分層具有明顯的消除作用;林青、張東升等[15-16]報道了養水機對池塘浮游植物和水化指標及異養菌豐度的影響。本文報道了養水機對刺參池塘水細菌菌群、功能和水質的影響,不僅為養水機對刺參池塘水質調控機理提供技術支撐,同時探討了細菌種群變化與水質的關系,為不同細菌種群的主要功能提供基礎數據,也為是否可用細菌菌群變化預示調控效果奠定技術基礎。
1 材料與方法
1.1 養水機結構和使用原理
養水機是一種針對刺參生長特點、能打破池塘水體溫、鹽躍層的新型水質調控設備(圖1),該設備主要分為進水組件、生物包、水循環動力裝置和水輸出噴頭4部分,其中生物包直徑1 m、高度0.3 m,內含生物濾料(活性炭),進水組件和微生物添加管隨池水的高度變化而變化。該設備結合物理和生物水質調控技術,在實際應用中表現出肥水、抑草、活水、節能等多方面優點[7-10]。養水機在工作時通過位于生物包內的動力裝置和進水組件抽取表層溶氧豐富的水,進入生物包進行過濾,然后由位于生物包外面的出水噴頭將水朝向與養水機位置相對的池塘方向噴射出去,實現池塘水在垂直方向快速交換,打破溫、鹽躍層造成池塘底部缺氧問題。
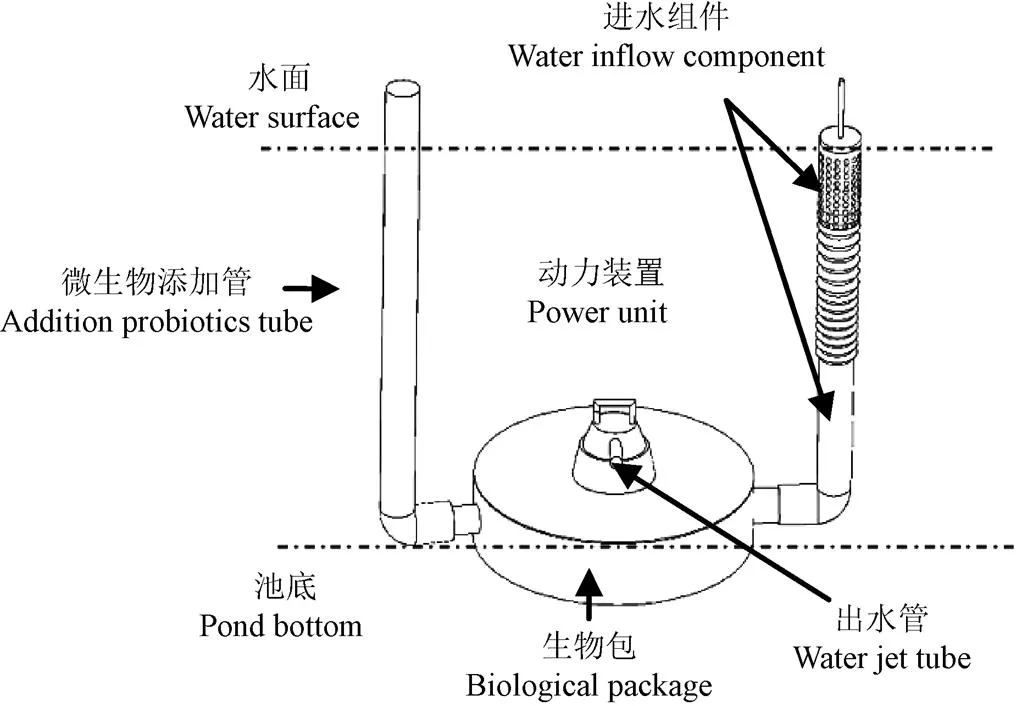
圖1 養水機結構示意圖
1.2 試驗池塘及刺參養殖管理
本試驗在大連莊河寶發海珍品有限公司刺參養殖池塘進行,所選池塘長約600 m,寬85 m,水深1.2~2.0 m,選擇9口大小、形狀一致的相鄰池塘進行試驗,3口安裝了養水機的池塘作為試驗組,其余6口池塘均為對照組,其中3口為微孔曝氣對照組,3口為自然納潮對照組,上述各池塘已運轉了2 a。
養水機試驗組,在池塘最深處放置一臺功率為750 W的養水機,3-11月份每日21:00-次日9:00工作,連續工作12 h(共消耗9 kW·h),冬季(12、1、2月)工作1 h;微孔曝氣對照組,在池塘底部鋪設1套微孔曝氣系統,由空壓機(1.5 kW·h/m2,每天用電量至少15.2 kW·h)、總供氣管和微孔曝氣盤組成,池塘缺氧時,開始工作)這是微孔曝氣裝置標準使用方法);自然納潮對照組,除了與養水機試驗組和微孔曝氣對照組在每月大潮期間同時更換池塘水外,無其他調水裝置。試驗期間,各池塘放養的刺參規格(2.5 g/個)、密度(15個/m2)相同,不投餌、不投藥,統一管理(包括所有池塘均使用微生態制劑的時間和劑量等)。
試驗周期為9個月,試驗開始時間是從每年的3月開始,至當年的11月結束,投苗時間分別為春季和秋季。
1.3 試驗方法
1.3.1 水樣采集
2017年,每月于大潮前3~5d的上午采集水樣1次,采用5L顛倒式采水器采集各池塘進水口、出水口、中心位點的表層(距水面約5cm)、中層、底層水(距池底約5cm),然后各點各層水樣在現場等量混合后帶回實驗室。
1.3.2 池塘水理化指標測定
各個采樣點,使用YSI多參數水質分析儀(Pro Plus,美國)即時測定水的各層水溫、鹽度、溶解氧。將采回的混合水樣,立即采用GB/T 12763.4?2007中的次溴酸鹽氧化法、萘乙二胺分光光度法、鋅隔還原法、磷鉬藍分光光度法、過硫酸鉀氧化法測定總銨氮(Total Ammonia Nitrogen,TAN)、亞硝酸態氮(NO2--N)、硝酸態氮(NO3--N)、活性磷酸鹽(PO43--P)、總磷(Total Phosphorus,TP)和總氮(Total Nitrogen,TN)含量[17]。
懸浮物的測定采用GB/T 11901-1989標準中[18]的重量法,葉綠素的測定采用HJ-897-2017標準[19]中的分光光度法。
1.3.3 水樣中細菌菌群及功能菌的測定
除前言中表明的目的以外,為了解養水機對刺參生長期菌群的影響,本次試驗僅測定了刺參生長期3、5、11月份的細菌菌群結構,將1.3.1中采集的水樣,用0.22m無菌醋酸纖維濾膜過濾,濾膜裝入無菌自封袋中,養水機、自然納潮、微孔曝氣3個刺參池塘水樣分別標記為Wn、Wt、Ws,采樣的月份用羅馬數字表示,然后立即放入?80 ℃液氮中冷凍1 h后,用干冰冷凍運送至北京諾禾致源科技股份有限公司,該公司采用Illumina NovaSeq 16SrRNA高通量測序技術,測定細菌的V3-V4區,根據所擴增的16S區域特點,構建小片段文庫,基于Illumina NovaSeq 測序平臺對該文庫進行雙末端測序(Paired_End)。經過Reads拼接過濾,OTUs(Operational Taxonomic Units)聚類,進行物種注釋及豐度分析;通過-和-多樣性分析,揭示出樣本中物種組成和樣本間群落結構的差異;采用PAPROTAK和PICRUSt軟件對細菌功能進行預測,通過wilcox和-test對不同池塘同一功能菌進行顯著性檢驗。
2 結 果
2.1 水質調控方式對池塘水質的影響
池塘水理化參數見表1,水溫變化在?3.0~27.9 ℃之間,8月份最高,12月份最低;溶氧變化在0.3~13.9 mg/L之間,12、1-3月最高,7月最低;鹽度變化在29.9‰~36.3‰之間,1-3月份最高,8月份最低;銨態氮、亞硝酸、硝酸鹽含量分別變化在0.1~0.56、0.005~0.023、0.19~0.65 mg/L之間,最高均出現在9月份,最低分別出現在2、4、6月份;PO43--P含量變化在0.018~0.048 mg/L之間,最高出現在9月份,最低出現在1月份,TN變化在0.540~1.878 mg/L之間,最高值出現在8-10月份,最低值出現在1月份;TP變化在0.022~0.330 mg/L之間,最高值出現在7-9月份;懸浮物變化在4.318~20.938 mg/L間,最高值出現在2-4月和10月份;葉綠素變化在0.019~2.009 mg/L之間,最高值出現在10或11月,上述理化因子中無機氮均是養水機池塘年均值較低,而溶氧、磷酸鹽、TN、TP、葉綠素、懸浮物年均值均是養水機池塘較高,其中養水機池塘溶氧年均值顯著高于自然納潮池塘(<0.05),與微孔曝氣池塘無顯著差異,葉綠素年均值顯著高于自然納潮和微孔曝氣池塘(<0.05)。
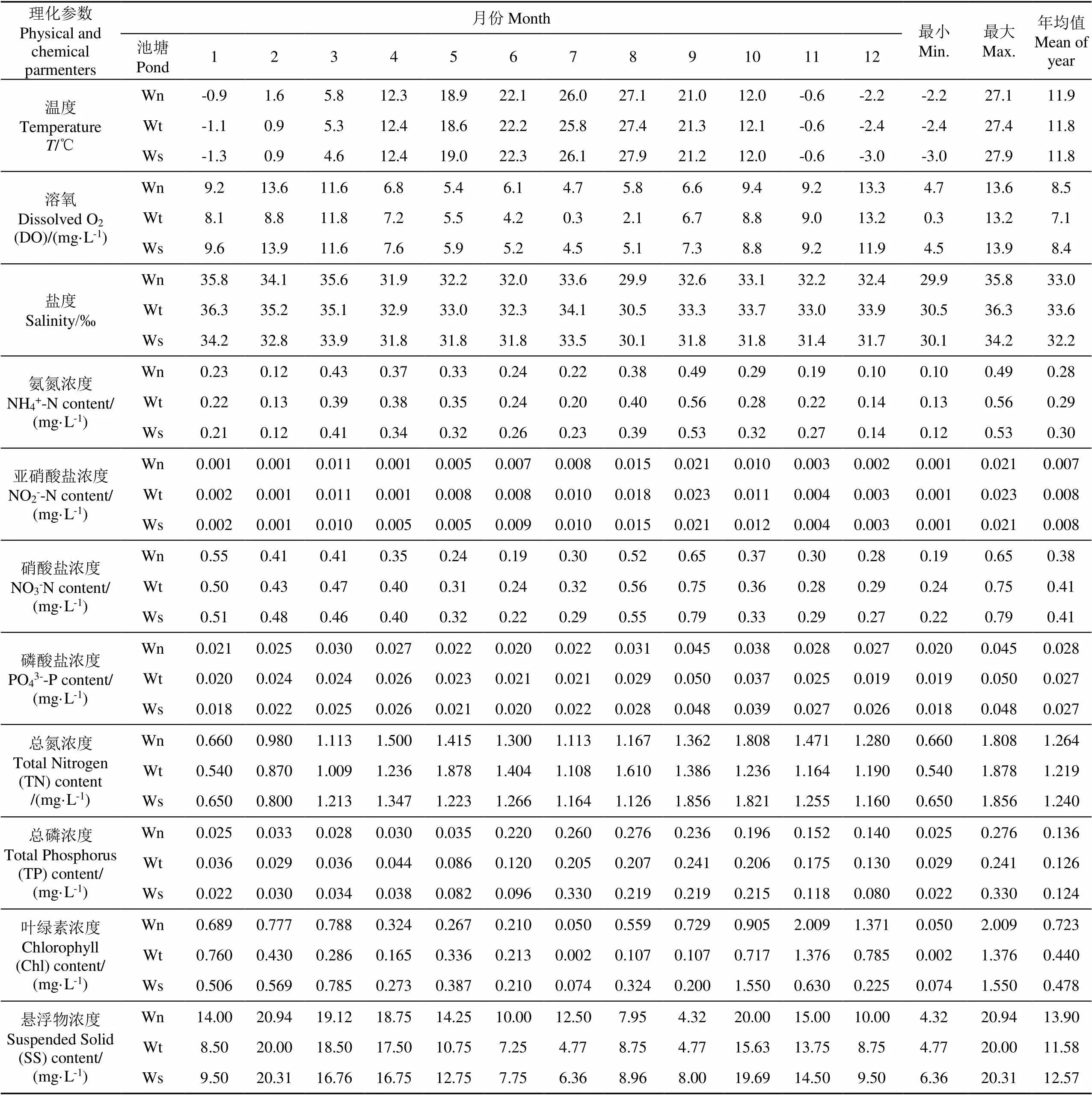
表1 池塘水物理化學參數
注:Wn、Wt、Ws分別表示養水機、自然納潮、微孔曝氣池塘水樣。下同。
Note: Wn, Wt and Ws respectively represent the water samples of the pond with Jet Water Mixer (JWM), water exchange by spring tides (WEST), submerged aerator (SA). The same below.
2.2 養水機對池塘水細菌菌群α、β多樣性及結構的影響
本研究對所獲序列片段,經拼接、質控和去除嵌合體后共得到681 429條有效克隆序列,樣品文庫覆蓋率均大于0.98,說明本試驗數據準確且有說服力,所獲序列以97%的相似度聚類后共獲得19 334個操作分類單元(OTUs)。池塘水細菌菌群-多樣性指數見(圖2a、b、c、d),可見,養水機池塘水在各時段菌群豐富度(Observed species, Shao1, ACE)、多樣性指數和均勻度(Shannon, simpson)均最高,而微孔曝氣池塘水菌群豐富度均最低,但經過Tukey和wilcox檢驗,3組之間-多樣性差異不顯著。-多樣性的PCoA分析和基于Amova unweighted unifrac檢驗分析,養水機池塘與對照池塘水細菌菌群結構總體差異不顯著(圖2e),但相似度(Similarity)也不高,僅在8.77%~9.37%之間,這種菌群結構相似度不高、區別性又不顯著(>0.05)的現象是月份不同和水質處理方式不同協同作用的結果,既水質調控方式對試驗前期(3, 5月份)同一月份各池塘水菌群結構影響較小,對試驗后期(11月份)菌群結構影響較大的結果。經spearman分析,影響養水機池塘水與對照池塘水-多樣性差異的主要環境因子為NH4+-N、NO2--N、NO3--N含量,它們均與-多樣性指數呈負相關(表2),即水質越差,-多樣性指數越低。
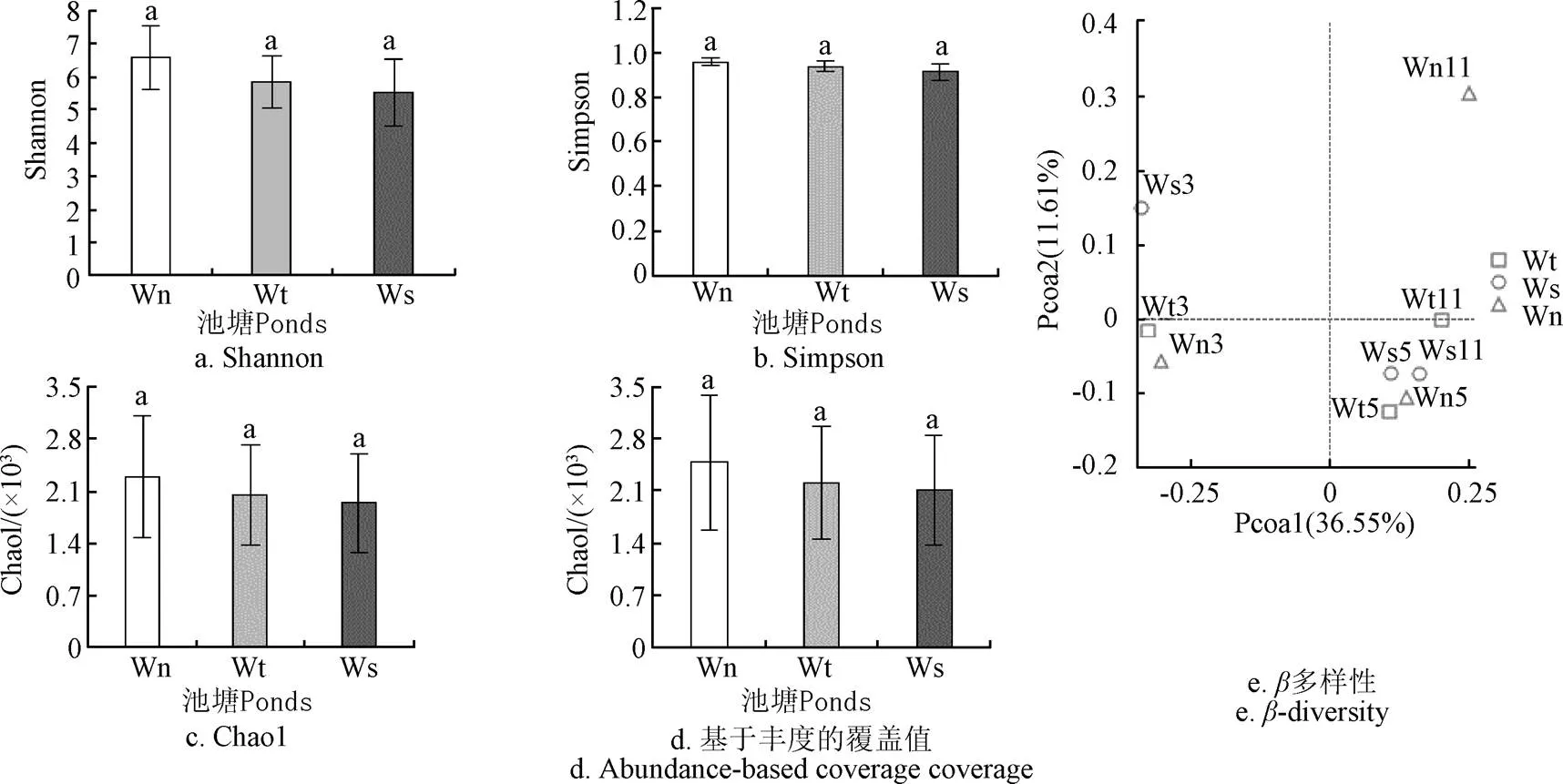
注:Wn3、Wn5、Wn11分別代表3、5、11月份的養水機池塘,Wt3、Wt5、Wt11分別代表3、5、11月份的自然納潮池塘,Ws3、Ws5、Ws11分別代表3、5、11月份的微孔曝氣池塘,下同。
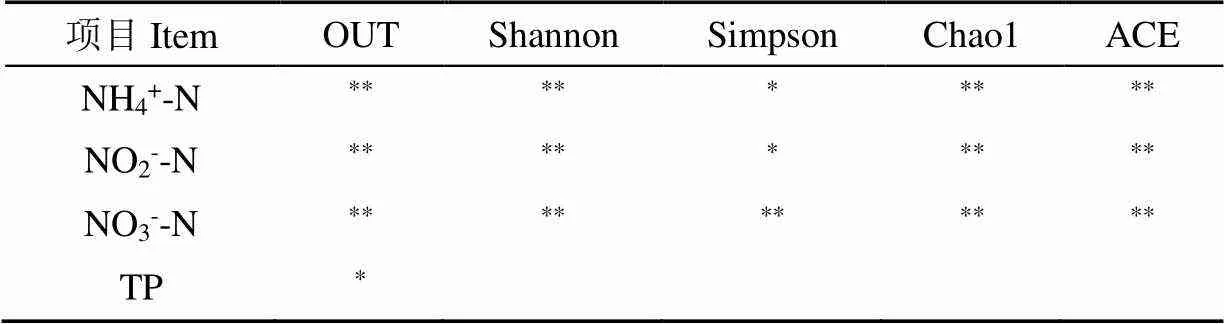
表2 菌群α-多樣性與環境因子的相關性
2.3 養水機對池塘水優勢菌群組成的影響
養水機池塘水前10優勢門和前3優勢綱組成基本與對照池塘水一致,前10優勢門(圖3a),分別為變形菌門、擬桿菌門、疣微菌門、放線菌門、厚壁菌門、浮霉菌門、酸桿菌門a、綠彎菌門、藍細菌門、芽單胞菌門,除11月份養水機池塘水以變形菌門和厚壁菌門為前2優勢門外,其余時間各池塘水前2優勢門均為變形菌門和擬桿菌門,豐度極顯著高于其它門(<0.05),除11月份養水機池塘水前3優勢綱為-變形桿菌綱、-變形菌綱和桿菌綱外,其余各時間各池塘水前3優勢綱均為-變形桿菌綱、-變形菌綱和黃桿菌綱,但各綱排序不同(圖3b),可見,11月份養水機池塘水與對照池塘水在門和綱水平上出現了差異。
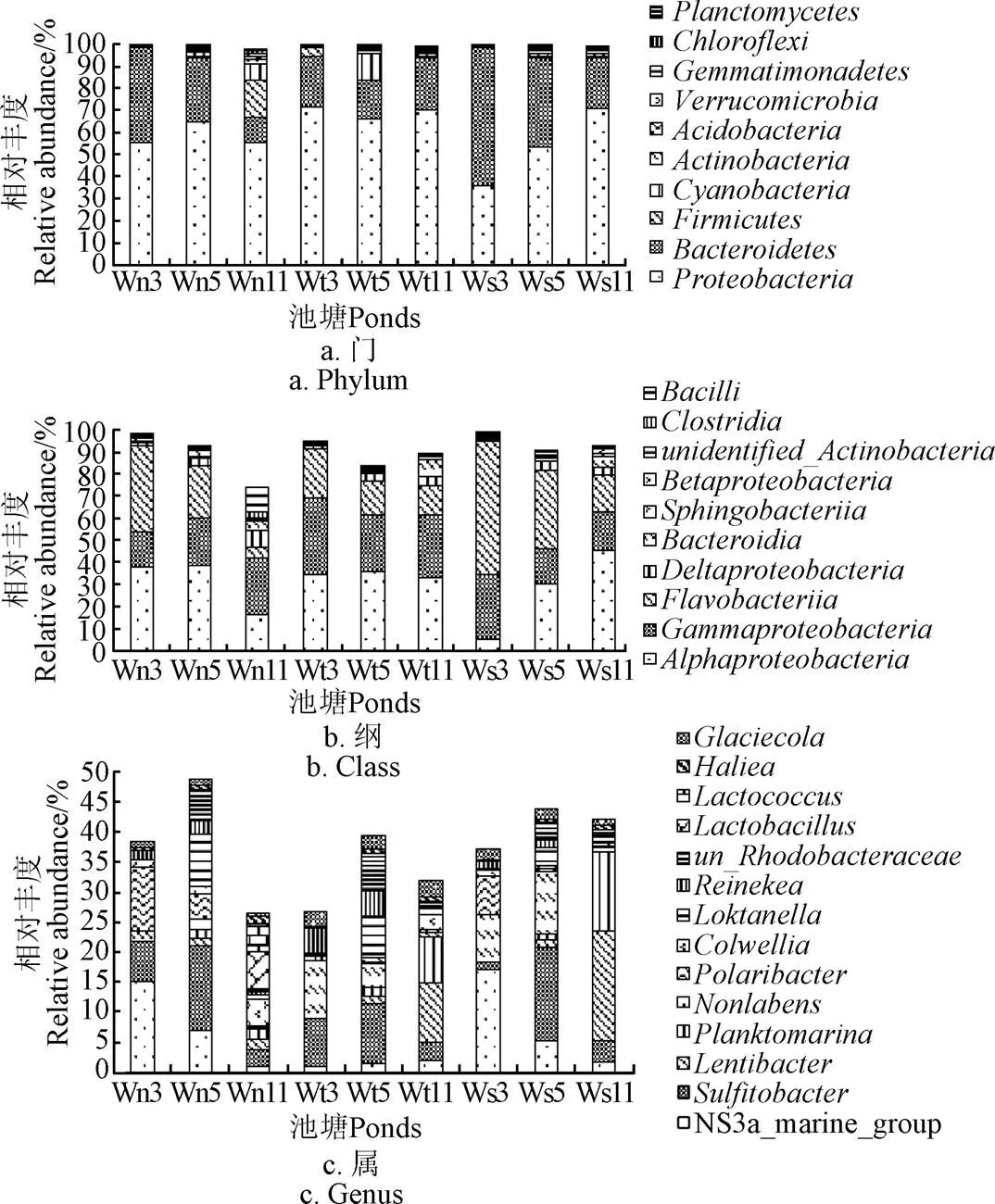
圖3 在門、綱、屬水平上的優勢菌群組成
養水機池塘水與對照池塘水豐度超過1%的優勢屬組成差異較大(圖3c),豐度超過3%的優勢屬養水機池塘有亞硫酸桿菌屬、NS3a_marine_group、極地桿菌屬、4屬,自然納潮池塘有亞硫酸桿菌屬、、、4屬,微孔曝氣池塘有、NS3a_marine_group、亞硫酸桿菌屬、、5屬,可見對照微孔曝氣池塘和自然納潮池塘優勢屬組成相近,而與養水機池塘有一定的差異,值得關注的是各池塘均含有亞硫酸桿菌屬。在測定期間,自然納潮池塘水除了藍藻在5月份增量較多以外,變形菌門和擬桿菌門的豐度變化不大,而養水機池塘和微孔曝氣池塘水擬桿菌門均呈下降趨勢,養水機池塘水除了變形菌門變化不大以外,其他菌門均呈明顯升高,尤其是厚壁菌門和藍藻門,而微孔曝氣池塘變形菌門呈增加趨勢,其它門變化不明顯,說明養水機和微孔曝氣對池塘水的菌群影響既有相同之處,也有不同之處。
總體來說,水質調控方式對池塘水分類層級越高的優勢菌群組成影響越小,對分類層級越低的菌群組成影響越大,試驗后期(11月份)影響較試驗前期(3、5月份)大。
2.4 各池塘水豐度差異顯著的種群
通過T-test檢驗,養水機池塘水與對照池塘水細菌菌群在門、綱、目分類層次上無顯著差異,但在某些科和屬的豐度上有顯著差異,養水機池塘水交替假單胞菌科見圖4a)和屬(見圖4b)的豐度顯著低于對照自然納潮池塘水的豐度,與對照微孔曝氣池塘水無顯著差異,的豐度均值分別為1.2%、2.8%、1.53%,屬的豐度均值分別為0.87%、2.47%、1.42%。再通過lefse(LDA Effect Size)差異性檢驗可知(圖4c),養水機池塘水與對照池塘水只有厚壁菌門-桿菌綱-乳酸菌目豐度具有生物統計學Biomarker意義,其中養水機池塘水和自然納潮池塘水及微孔曝氣池塘水中的豐度均值分別為5.98%、1.48%、0.52%,豐度均值分別為4.01%、0.26%、0.17%,均值分別是3.720%、0.048%、0.039%,其LDA值超過4.0,這主要得益于養水機不斷促進生長的結果,運轉到后期(11月份),仨池塘該目豐度分別達到11.02%、0.04%、0.03%,說明養水機顯著促進了該種群細菌的生長。
2.5 引起各池塘水菌群結構差異的主要種群
通過Simper(Similarity percentage)分析(見圖5),引起各池塘水菌群結構差異的門,按照從大到小排序分別是擬桿菌門、變形菌門、藍細菌門和厚壁菌門,可見擬桿菌門對水質反應比變形菌門敏感,引起各池塘水菌群結構差異的屬是各池塘前優勢屬(除亞硫酸桿菌屬外),再加上科爾韋爾氏菌屬和屬,可見引起各池塘水菌群結構差異的主要類群為各池塘優勢種群。
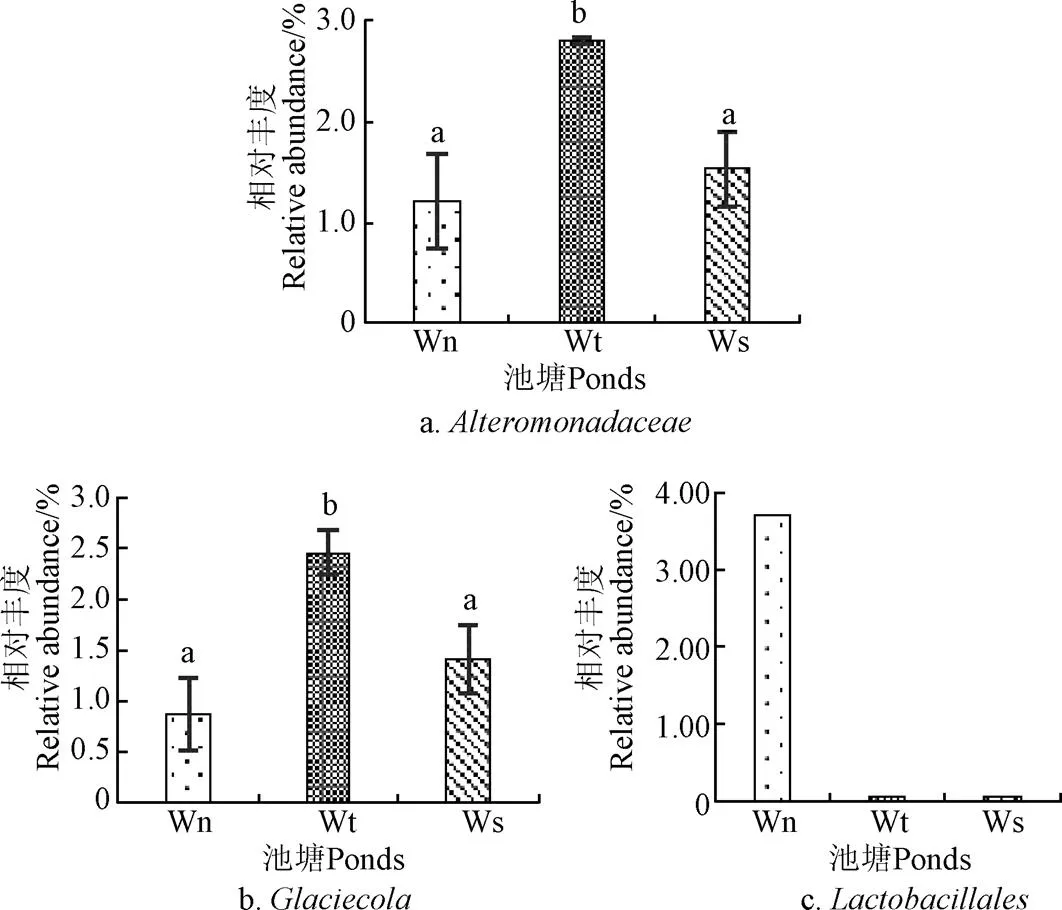
圖4 水中細菌菌群顯著差異科和屬及目
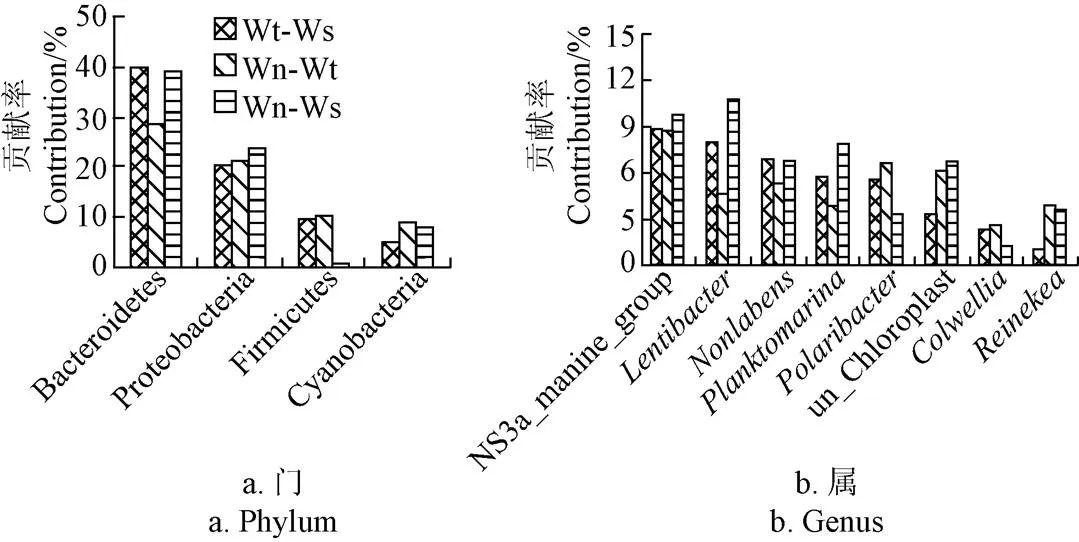
圖5 引起池塘之間菌群結構差異的細菌門和細菌屬
2.6 影響各池塘水菌群結構差異的環境因子
通過spearman和CCA_envifie中的OUT分析可見,引起池塘水多數門豐度和菌群結構差異的水質指標是水中的總磷TP(=0.003)、NH4+-N(=0.005)、NO2--N(=0.008)(見表3),如影響擬桿菌門豐度的環境因子是NH4+-N、NO2--N和總磷TP,與NH4+-N、NO2--N濃度成正相關,與總磷TP濃度成負相關,影響厚壁菌門豐度的環境因子是PO43--P和O2,該門豐度與2環境因子呈正相關,值得注意的是影響池塘水豐度最高的變形菌門的環境因子卻是鹽度,兩者呈正相關,而與營養鹽無關。影響池塘菌群結構差異的環境因子也是總磷TP(=0.003)、NH4+-N(=0.005)、NO2--N(=0.008)濃度(見圖6)。
2.7 養水機對池塘水功能菌的影響
采用FAPROTAX、PICRUS軟件預測了池塘各功能菌豐度,經FAPROTAX預測菌群功能的t-test和wilcox檢驗分析,養水機與對照池塘相比,各功能菌豐度均無顯著差異,池塘水FAPROTAX檢驗的優勢功能菌依次為:化能異養、好氧化能異養、硫氧化、硫呼吸、硝酸鹽還原、發酵和植物病原菌(圖7a),各功能菌豐度分別變化在12.78%~19.65%、0.96%~4.97%、0.37%~2.74%、0.05%~11.40%、0.18%~8.07%之間,其他功能菌豐度低于1%;與細菌菌群結構變化類似,試驗前期(3,5月),各池塘同一優勢功能菌豐度差異較小,試驗后期(11月),有些功能菌豐度差異較大(圖7b),其中養水機池塘水較對照自然納潮和微孔曝氣池塘水發酵菌豐度(分別為9.658%、0.300%、0.190%)、植物致病菌豐度(分別為3.676%、0.023%、0.017%)有較大的提高(圖7a),硝酸鹽還原菌豐度(分別為1.563%、7.378%、12.104%)有較大的降低。
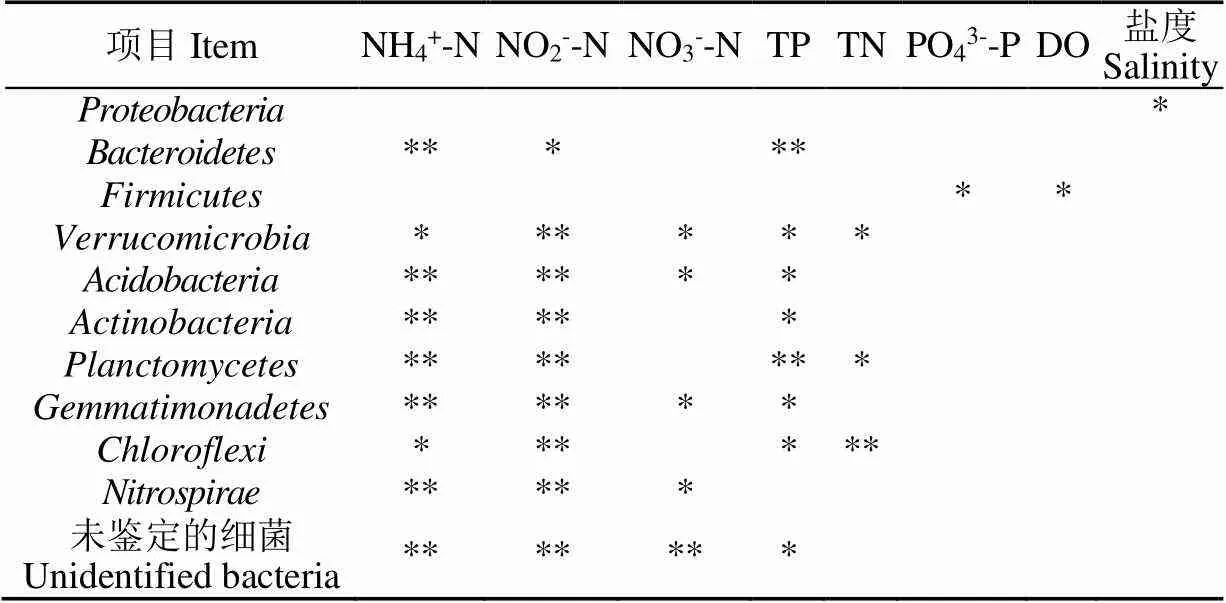
表3 影響細菌門豐度與水質的相關性
注:*為顯著(<0.05),**為極顯著(<0.01)。
Note: * is significant (<0.05), ** is extremely significant (<0.01).
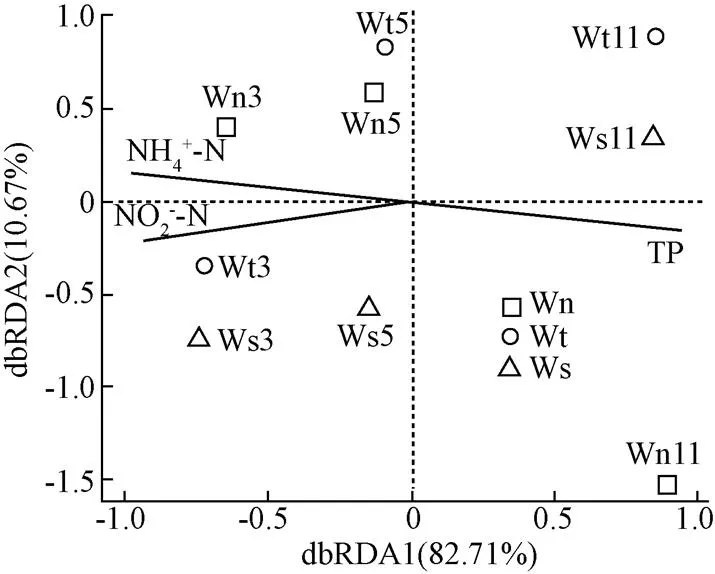
圖6 菌群結構與水質指標的關系
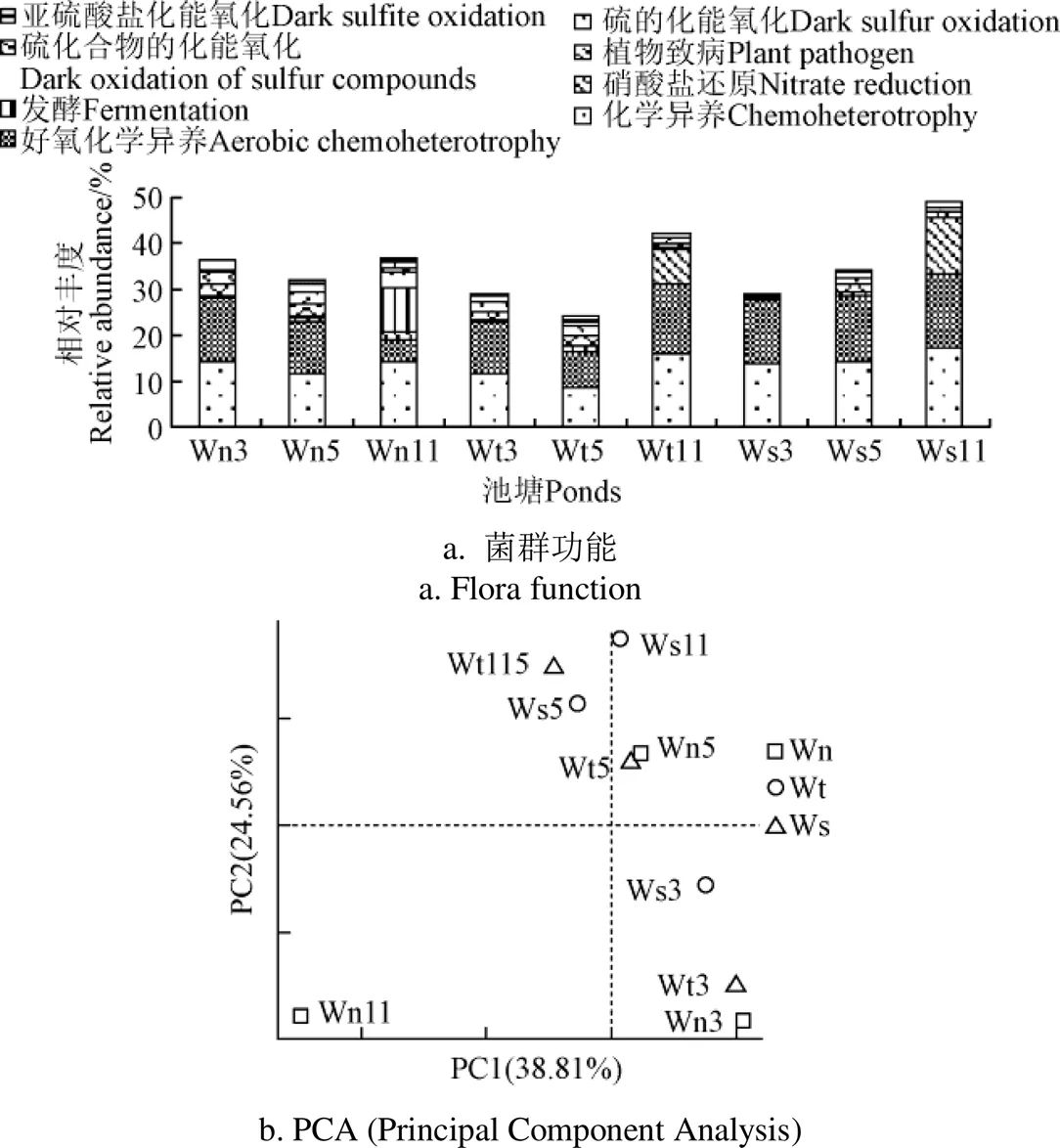
圖7 FAPROTAX檢驗的池塘優勢功能菌的相對豐度及PCA分析
經過PICRUS軟件分析(圖8),各池塘主要功能菌依次為代謝、遺傳信息處理、環境信息處理、細胞過程,其豐度依次變化在50.97%~52.48%、14.43%~17.24%、10.51%~14.24%、3.31%~3.75%之間,其中在Level 1水平上2對照池塘中的代謝和細胞過程存在顯著差異(<0.05),而養水機與對照池塘菌群功能并無顯著差異。在代謝Level 2水平上,養水機池塘和對照微孔曝氣池塘除了外源物質生物降解和代謝豐度低于自然納潮池塘以外,其他代謝功能均高于自然納潮池塘,而養水機池塘以碳水化合物、能量代謝、外源性物質生物降解和代謝為主要代謝類型,對照微孔曝氣池塘以氨基酸代謝、輔助因子和維生素代謝、脂質代謝、核苷酸代謝為主,其中氨基酸代謝在2池塘中(<0.05)值顯著,而(>0.05)值不顯著,可見不同水質調控方式池塘水主要代謝類型是不同的。
各池塘植物致病菌豐度與優勢屬關系不同(表4),養水機池塘植物致病菌豐度與科爾韋爾氏菌屬、乳球菌屬、乳桿菌屬三屬豐度呈顯著正相關,微孔曝氣池塘與NS3a-marine- group呈顯著正相關,但三種水質調控方式池塘植物致病菌均與NO3--N含量呈正相關,說明驅動池塘植物致病菌豐度的主要因素是水中的NO3--N含量。
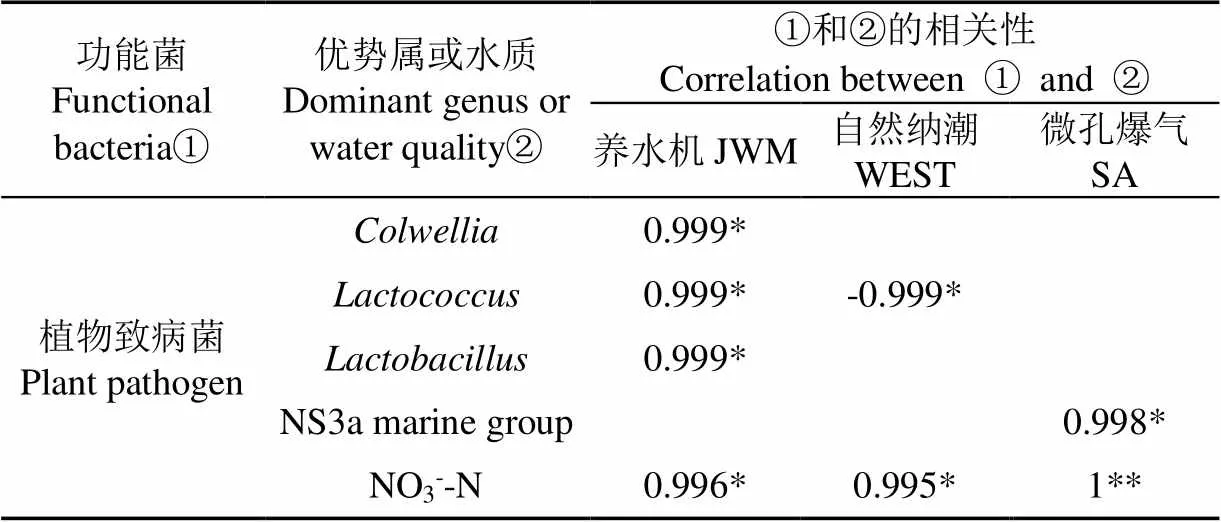
表4 植物致病菌與水中優勢屬和水質的相關性
3 討 論
3.1 養水機對刺參池塘水質的影響
養水機對刺參池塘水質的影響與前一年測定結果類似[12],說明養水機對池塘水質的影響是比較穩定的。
3.2 刺參養殖池塘水細菌優勢類群特點
刺參養殖池塘細菌前10優勢門的組成與文獻報道基本一致,這可能與養殖對象均為刺參有關[4,12-14,20-21],自然納潮刺參養殖池塘水第1優勢門和優勢綱分別為變形菌門和-變形桿菌綱,均與文獻報道一致[4,12-14,20-21],這可能與變形菌門為自然界中第1大菌門有關,變形菌門包括各種生態位細菌,因此不同環境條件的改變,可能對其排位影響不大,而第2優勢門和優勢綱與文獻報道存在差異,本試驗池塘中的第2優勢門與長海、乳山刺參池塘一致[4,12]均為擬桿菌門(均為黃海水域池塘),而渤海海域刺參池塘均為放線菌門[4],本文刺參池塘第2優勢綱為-變形菌綱,與長海池塘一致,但與營口和乳山刺參池塘分別為黃桿菌綱和放線菌綱不同,可見相同海域距離較近池塘第2優勢門和第2優勢綱相同,不同海域或相同海域距離較遠,第2優勢門和優勢綱差異較大,說明刺參池塘水第2優勢門和優勢綱類別既受不同海域影響,也受相同海域距離遠近的影響;而不同海域或距離相近的同一海域對池塘水的第3優勢菌門和優勢綱影響更大,這可能與第3優勢門及優勢綱菌群包含的細菌種類少,受環境條件影響更大有關。而不同海域對優勢屬組成影響更大[4],屬級位于分類層級較低的位置,包含菌種數量少、生態位較窄,受環境影響其豐度變化差異更大,但不同海域刺參池塘中均出現了極地桿菌屬、亞硫酸桿菌屬、、4屬[4],其豐度均超過了1%,而該四屬中的某些種是某些藻類的伴隨者,某些種卻是柴油降解菌[22-23],這可能與刺參池塘里某些藻較多和柴油較多有關。
3.3 水質調控方式對池塘水優勢細菌類群豐度的影響
養水機對池塘水優勢細菌類群組成的影響顯示對分類層級越高影響越小,對分類層級越低影響越大的特點,這與王飛鵬等[7]的結果一致,其原因與分類層級越高生態位越多,分類層級越低生態位越小有關。
盡管在門、綱水平上,各池塘各優勢門、綱豐度差異不顯著,但與自然納潮對照池塘相比,養水機池塘水和微孔曝氣池塘水變形菌門豐度降低了,擬桿菌門豐度升高了,說明養水機和微孔曝氣裝置對池塘水細菌菌群的調節有一定的相似性,這可能與養水機和微孔曝氣裝置都能提供池塘氧氣有關,但養水機對池塘細菌菌群的作用也有其特殊性,養水機對厚壁菌門豐度影響比對變形菌門和擬桿菌門豐度影響更大,養水機池塘厚壁菌門豐度分別是自然納潮和微孔曝氣對照池塘的4和11.5倍,分別是對照池塘的15.4和23.4倍,乳桿菌目豐度分別是對照池塘的77.6、95.6倍,且該目豐度在養水機池塘與對照池塘之間具有顯著差異,而該目在養水機池塘主要以乳桿菌屬和乳球菌屬為主,說明養水機的轉運具有富集乳酸桿菌和乳酸球菌的作用,該屬細菌兼性厭氧,通常被用作益生菌使用,理論上,該屬的增多對改善水質、加快池塘有機物的降解有益,但養水機池塘該屬大量繁殖其機理需進一步研究。
與自然納潮對照池塘相比,養水機顯著降低了交替單胞菌科科和居水菌屬屬豐度,這2組細菌基因組較大,適合環境變動較大和具有較多大型褐藻、甲殼等復雜高分子糖類環境里生長[24-25],說明養水機池塘大型藻類較少、環境相對穩定,而對照池塘大型藻類較高、水質參數波動較大,這與實際情況相符[16],可見,池塘細菌豐度差異反應了池塘環境條件。
除上述具有顯著差異的菌科和菌屬以外,養水機池塘前優勢屬與對照池塘差異也較大,養水機池塘以藻類分泌物為營養的優勢菌豐度較高,如NS3a marine group[26-27]和極地桿菌屬[28],而以大型藻類分泌物為營養屬細菌[29]豐度較低,比對照組低了3.7~6.5倍,除此以外,屬的細菌也比對照組低了4.2~5.5倍,這都與養水機池塘浮游藻類豐度高,尤其是硅藻高,而大型藻類豐度低是一致的,而優勢亞硫酸桿菌屬細菌在養水機和對照池塘豐度差異極小,這可能與該屬能利用的機質物較復雜有關[30]。
3.4 養水機對池塘水菌群多樣性的影響
養水機池塘水細菌-菌群多樣性和均一性最高,而對照微孔曝氣池塘僅在5月份細菌多樣性和均一性高于對照自然納潮池塘,其余時間均最低,細菌多樣性和均一性高,對穩定水質、不易受外界環境干擾具有重要作用[31-33],說明養水機池塘水質狀況良好[34]、且穩定,這有利于刺參的養殖。
3.5 細菌菌群豐度與環境因子的關系
根據細菌系統發生將細菌分成不同的類群,在高層次類群中,如門,其成員生態位復雜,某門豐度很難與某一環境因子有直接的關聯,但也有些門豐度與某些環境有密切的關聯,而被用來作為指示生物,如擬桿菌門的豐度可以用來指示土壤的利用情況[35],因此,人們希望利用某類群豐度變化預警某一環境變化,以便能及早矯正不良環境,但是,因為環境條件的復雜性和細菌生態位的多樣性,至今尚無某門與某環境因子在各種環境條件下的統一關系,如有些報道變形菌門喜歡生活在低溶氧、有機物豐富的水域[7-8],但也有研究表明,變形菌門與水溶氧呈正相關[20],Ji等[36]報道變形菌門可以生活在各種溶氧條件下,本文并沒有觀測到變形菌門Proteobacteria豐度與溶氧的關系,而是與池塘鹽度呈正相關;擬桿菌門Bacteroidetes主要用來降解生物圈中復雜有機物,尤其喜歡降解海洋中的多糖和碳氫化合物[35],其豐度與pH值呈負相關[35,37-38],與PO43--P含量呈正相關[38-39],本文顯示擬桿菌門與TP呈負相關,與NH4+-N、NO2--N呈正相關,可見在不同生態環境里,影響優勢門的外界環境條件不一,但影響擬桿菌門豐度的環境因子均與營養鹽N和P有關,有些文獻報道擬桿菌門對外界環境條件敏感[35],可以作為環境的指示生物,本文也證實了這點,其豐度如何與水質關聯,尚需大量的試驗。本文測定厚壁菌門桿菌綱Bacilli與O2具有正相關,這與該門的生理特點相符,希望本文對變形菌門、擬桿菌門、厚壁菌門與水質的關系,為今后三門的生態研究有所幫助。
3.6 養水機對池塘水細菌菌群功能的影響
目前,有關刺參養殖池塘細菌功能的文獻較少[39],且采用的方法與本文不同,難以進行比較。本試驗表明,水質調控方式影響了刺參池塘細菌功能菌的豐度,但通過FAPROTAX和PICRUS level1檢測的功能菌豐度差異不顯著,這可能與各池塘在冬季幾乎不運轉,導致3、5月差異較小所致,但到11月份各水質調控方式下各池塘功能菌有較明顯的差異,特別是養水機池塘有利于抑制大型植物病害菌的生長,這有利于避免大型藻類過度生長,有利于刺參生長和避免過多有機物的積累提供了生物基礎。比自然納潮池塘和微孔曝氣池塘分別提高了32、50和159、216倍;硝酸鹽還原菌豐度明顯降低。
4 結 論
1)不同水質調控方式對分類層級高的優勢類群組成影響較小,對分類層級低的優勢類群影響較大。
2)NS3a_marine_group、極地桿菌屬兩屬菌可作為刺參池塘水質較好的指示菌。
3)養水機提高了池塘水菌群-多樣性、厚壁菌門豐度和植物致病菌豐度,這導致了養水機池塘水質穩定、有機質少,植物生長緩慢,有利于刺參池塘水質和刺參生長。
[1] 賈鵬麗,馮海艷,李淼. 東北黑土區不同土地利用方式下農田土壤微生物多樣性[J]. 農業工程學報,2020,36(20):171-178.
Jia Pengli, Feng Haiyan, Li Miao, et al. Soil microbial diversity of black soil under different land use patterns in northeast China[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(20): 171-178. (in Chinese with English abstract)
[2] 胡愈炘,張靜,黃杰,等. 長江流域河流和湖庫的浮游細菌群落差異[J]. 環境科學,2022,43(3):1414-1423.
Hu Yuxin, Zhang Jing, Huang Jie, et al. Characteristics of bacterioplankton community between river and lake/reservoir in the yangtze river basin[J]. Environmental Science, 2022, 43(3): 1414-1423. (in Chinese with English abstract)
[3] 黃志濤,宋協法,李勛,等. 基于高通量測序的石斑魚循環水養殖生物濾池微生物群落分析[J]. 農業工程學報,2016,32(增刊1):242-247.
Huang Zhitao, Song Xiefa, Li Xun, et al. Analysis of microbial diversity of submerged biofilters in recirculating aquaculture system (RAS) for grouper () based on high-throughput DNA sequencing[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(Supp.1): 242-247. (in Chinese with English abstract)
[4] Xu H C, Wang L, Bao X Y, et al. Microbial communities in sea cucumber () culture pond and the effects of environmental factors[J]. Aquaculture Research, 2019: 1-12.
[5] Arroyo P, Sáenz de Miera L E, Ansola G. Influence of environmental variables on the structure and composition of soil bacterial communities in natural and constructed wetlands[J]. Science of the Total Environment, 2015, 506-507: 380-390.
[6] Lew S, Glińska-Lewczuk K, Burandt P, et al. Impact of environmental factors on bacterial communities in floodplain lakes differed by hydrological connectivity[J]. Limnologica- Ecology and Management of Inland Waters, 2016, 58: 20-29.
[7] 王飛鵬,黃亞玲,張瑞瑞,等.不同曝氣方式對人工濕地細菌多樣性、代謝活性及功能的影響[J]. 環境科學,2022,43(4):2007-20017
Wang Feipeng, Huang Yaling, Zhang Ruirui, et al. Effects of different aeration treatments on bacterial diversity, metabolic activity, and function in constructed wetlands[J]. Environmental Science, 2022, 43(4): 2007-2017. (in Chinese with English abstract)
[8] 楊霄.分層型水庫水細菌群落演變機制與揚水曝氣強化作用研究[D]. 西安:西安建筑科技大學,2016.
Yang Xiao. Study on the Evolvement Mechanism of Aquatic Bacteria Community and its Enhanced Effect by Water-Liftling Aerator in Stratified Resovirs[D]. Xi'an: Xi'an University of Architecture and Technology, 2016. (in Chinese with English abstract)
[9] 劉俊,張世文,宋桂芳,等. 復墾土壤細菌群落結構及其與土壤肥力的關系[J]. 農業工程學報,2021,37(21):124-133.
Liu Jun, Zhang Shiwen, Song Guifang, et al. Bacterial community structure of reclaimed soil and its relationship with soil fertility[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(21): 124-133. (in Chinese with English abstract)
[10] 王祖峰. 仿刺參養殖池塘三種水質控制技術效果的比較[D]. 大連:大連海洋大學,2016.
Wang Zufeng. A Comparative Study of Three Water Quality Controlling Technologies Effected in Apostichopus Japonicus[D]. Dalian: Dalian Ocean University, 2016. (in Chinese with English abstract)
[11] 孫廣偉,周瑋,黨子喬,等. 3種水質調控方式下刺參池塘初級生產力的周年變化[J]. 水產學報,2020,44(4):632-641.
Sun Guangwei, Zhou Wei, Dang Ziqiao, et al. Annual change of primary productivity inponds by three water quality regulations[J]. Journal of Fisheries of China, 2020, 44(4): 632-641. (in Chinese with English abstract)
[12] Zhao Z, Jiang J, Pan Y, et al. Temporal dynamics of bacterial communities in the water and sediments of sea cucumber () culture ponds[J]. Aquaculture, 2020, 528: 1-12.
[13] Gao F, Li F, Tan J, et al. Bacterial community composition in the gut content and ambient sediment of sea cucumberrevealed by 16S rRNA gene Pyro sequencing[J]. Plos One, 2014, 9(6): 1-10.
[14] Lv X, Yu P, Mao W, et al. Vertical variations in bacterial community composition and environmental factors in the culture pond sediment of sea cucumber[J]. Journal of Coastal Research, 2018, 84: 69-76.
[15] 林青,張東升,魏亞南,等. 3種水質調控方式對刺參池塘浮游植物種群結構的影響[J]. 大連海洋大學學報,2019,34(4):566-572.
Lin Qing, Zhang Dongsheng, Wei Yanan, et al. Effects of three water quality regulation methods on phytoplankton population structure in a sea cucumber culture pond[J]. Journal of Dalian Ocean University, 2019, 34(4): 566-572. (in Chinese with English abstract)
[16] 張東升,王祖峰,周瑋. 養水機對刺參池塘理化參數和細菌豐度的影響[J]. 南方水產科學,2021,17(6):85-92.
Zhang Dongsheng, Wang Zufeng, Zhou Wei. Effects of Jet Water Mixer on physicochemical parameters and bacterial abundance in pond[J]. South China Fisheries Science, 2021, 17(6): 85-92. (in Chinese with English abstract)
[17] 國家海洋局. 海洋調查規范第4部分:海水化學要素調查:GB/T 12763.4-2007 [S]. 北京:中國標準出版社,2008.
[18] 國家海洋局.漁業水質標準-懸浮物的測定-重量法:GB11607-89 [S]. 北京:中國標準出版社,1989.
[19] 環境保護部.水質葉綠素a的測定-分光光度法: HJ-897-2017 [S]. 北京:中國環境出版集團有限公司,2018.
[20] Wang L, Wei C, Chang Y, et al. Response of bacterial community in sea cucumberintestine, surrounding water and sediment subjected to high-temperature stress-Science Direct[J]. Aquaculture, 2021, 535: 736353.
[21] Gao L, He C, Bao X, et al. Comparative study of water environment variation in the industrial aquaculture system of sea cucumber[J]. Aquaculture Research, 2017, 48(4): 1787-1798.
[22] Ryther C M, Ortmann A C, Wohlgeschaffen G, et al. Temperate coastal microbial communities rapidly respond to low concentrations of partially weathered diesel[J]. Microbial Ecology, 2021, 1-11.
[23] Kataoka T, Ocki A, Nomura D. Production of dibromomethane and changes in the bacterial community in bromoform-enriched seawater[J]. Microbes Environ, 2019, 34(2):215-218
[24] Qin Q L, Xie B B, Yu Y, et al. Comparative genomics of the marine bacterial genusreveals the high degree of genomic diversity and genomic characteristic for cold adaptation[J]. Environmental Microbiology, 2014, 16(6): 1642-1653.
[25] Mario López-Pérez, Rodriguez-Valera F. 5 the Family Alteromonadaceae[M]. Berlin: Springer Berlin Heidelberg, 2014.
[26] Kirchman D L. The ecology of cytophaga-flavobacteria in aquatic environments[J]. FEMS Microbiology Ecology, 2002, 39(2): 91-100.
[27] Koo H, Mojib N, Huang JP, et al. Bacterial community shift in the coastal Gulf of Mexico salt-marsh sediment microcosm in vitro following exposure to the Mississippi Canyon Block 252 oil (MC252)[J]. Biotech, 2015, (5): 379-392.
[28] Klindworth A, Mann A, Huang S, et al. Diversity and activity of marine bacterioplankton during a diatom bloom in the North Sea assessed by total RNA and pyrotag sequencing[J]. Marine Genomics, 2014, 18: 185-192.
[29] Li Z, Qu Z, Zhang X, et al.gen. nov. sp. nov. isolated from coastal water during a massive green algae bloom[J]. International Journal of Systematic & Evolutionary Microbiology, 2012, 62(5): 1042-1047.
[30] Rosenberg E, DeLong E F, Lory S, et al. The Prokaryotes–Alphaproteobacteria and Betaproteobacteria-The Family Rhodobacteraceae[M]. USA: Springer Verlag, 2014: 440-512.
[31] Yachi S, Loreau M. Biodiversity and ecosystem productivity in a fluctuating environment: the insurance hypothesis[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96( 4): 1463-1468.
[32] Loreau M, Naeem S, Inchausti P, et al.Biodiversity and ecosystem functioning: current knowledge and future challenges[J]. Science, 2001, 294(5543): 804-808.
[33] 郭超,張東升,林青,等. 3種水質調控方式下春季參池環境及刺參腸道的細菌群落結構[J]. 大連海洋大學學報,2019,34(3):338-344.
Guo Chao, Zhang Dongsheng, Lin Qing, et al. Bacterial flora structures in intestinal tract and pond environment of sea cucumber under three water quality regulation methods in spring[J]. Journal of Dalian Ocean University, 2019, 34(3): 338-344. (in Chinese with English abstract)
[34] Ji B, Liang J, Ma Y et al. Bacterial community and eutrophic index analysis of the East Lake[J]. Environmental Pollution, 2019, 252: 682-688
[35] Wolińska A, Ku?niar A, Zielenkiewicz U, et al. Bacteroidetes as a sensitive biological indicator of agricultural soil usage revealed by a culture-independent approach[J]. Applied Soil Ecology, 2017, 119: 128-137.
[36] Ji B, Yang K, Zhu L, et al. Aerobic denitrification:a review of important advances of the last 30 years[J]. Biotechnology and Bioprocess Engineering, 2015, 20(4): 643-651
[37] Lauber C L, Hamady M, Knight R, et al. Pyrosequencing- based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale[J]. Applied and Environmental Microbiology, 2009, 75: 5111-5120.
[38] Ganzert L, Bajerski F, Wagner D. Bacterial community composition and diversity of five different permafrost-affected soils of Northeast Greenland[J]. FEMS Microbiology Ecology, 2014, 89: 426-441.
[39] Figueiredo D, Ferreira RV, Cerqueira M, et al. Impact of water quality on bacterioplankton assemblage along Certima River Basin (central western Portugal) assessed by PCR-DGGE and multiyariate analysis[J]. Environmental Monitoring and Assessment, 2012, 184(1): 471-485.
Effects of three water treatments on the structure of bacterial flora of sea cucumber breeding pond water in spring and autumn
Zhang Dongsheng1,2, Zhou Wei1※
(1.,,116023,; 2.&,,116023,)
Sea cucumber is an important species cultivated in seawater ponds in Liaoning and Shandong provinces of China in the past 30 years. However, the current conventional techniques for improving pond water quality, such as water exchange by spring tides (WEST) and submerged aerator (SA), are not very ideal. The ponds can still form thermohaloclines in February and June, and a large number of macroalgae will be produced in summer and autumn. Jet Water Mixer (JWM) is a new water quality control device for sea cucumber pond. In order to explore the effect and mechanism of water quality improvement of sea cucumber breeding pond by JWM, we measured the annual changes of water quality and the changes of bacterial flora and function in spring and autumn by 16SrRNA high-throughput sequencing technology under the three water quality control methods. Nine adjacent ponds of the same size and shape were selected for the experiment. Three ponds with JWM were used as the experimental group, and the other six ponds were used as the control group, among which 3 ponds were used as SA control group and 3 ponds were used as WEST control group. The results showed that the contents of NH4+-N, NO2--N and NO3--N in the pond water with JWM were decreased, and the contents of O2, PO43--P, TN, TP, chlorophyll and suspended matter were increased, But except that the content of chlorophyll in the pond water with JWM was significantly higher than that in the control pond, there was no significant difference in other water quality indexes. The effect of water quality regulation on the composition of dominant bacterial groups in pond water showed that the higher the classification level, the smaller the effect, while the lower the classification level, the greater the effect. The composition of the top 10 dominant phyla and the top 3 dominant classes in the pond water with JWM were basically the same as that in the control ponds. The first and second dominant phyla are Proteobacteria and Bacteroidetes. The first three dominant classes were Alphaproteobacteria, Gammaproteobacteria, and Flavobacteria, but the composition of the dominant genus varied greatly in different ponds. Lefse analysis showed that JWM significantly increased the abundance of Firmicutes-Bacilli-Lactobacillales in the pond water (LDA SCORE > 4), and t-test showed that WEST significantly increased the abundance of Alteromonadaceae and SA significantly increased the abundance ofin the pond water. FAPRTAX analysis showed that the main functional bacteria in each pond were chemoheterotrophy, aerobic chemoheterotrophy, sulfur oxidation, sulfur respiration, nitrate reduction, fermentation and plant pathogens. There was no significant difference in the annual mean abundance of the same functional bacteria among the ponds, but at the late stage of the experiment, there were large difference in the abundance of some functional bacteria between ponds. JWM increased the abundance of fermentation and plant pathogen bacteria and decreased the abundance of nitrate reduction bacteria. SA increased the abundance of nitrate reduction bacteria and decreased the abundance of plant pathogenic bacteria. The-diversity of microbiota was the highest in the water of pond with JWM, and the lowest in that of pond with SA. The main environmental factors affecting the structure of bacterial flora were the contents of TP, NH4+-N and NO2--N in pond water. In conclusion, JWM significantly increased the abundance of Lactobacillales and plant pathogenic bacteria, and increased the-diversity of bacterial flora in pond water. The former inhibited the growth of macroalgae, while the latter was beneficial to water quality stability.
aquaculture; flora composition; water quality regulation; Jet Water Mixer; functional bacteria; FAPRTAX; sea cucumber pond
10.11975/j.issn.1002-6819.2022.19.022
S96; Q939.1
A
1002-6819(2022)-19-0202-10
張東升,周瑋. 三種水質調控方式對春秋季刺參池塘水細菌菌群結構的影響[J]. 農業工程學報,2022,38(19):202-211.doi:10.11975/j.issn.1002-6819.2022.19.022 http://www.tcsae.org
Zhang Dongsheng, Zhou Wei. Effects of three water treatments on the structure of bacterial flora of sea cucumber breeding pond water in spring and autumn[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2022, 38(19): 202-211. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2022.19.022 http://www.tcsae.org
2022-06-15
2022-09-15
遼寧省科學計劃項目(2018104009);遼寧省“興遼英才”項目(XLYC1008029);大連市2020年度科技特派團項目;大連市重點領域創新團隊支持計劃項目(2019RT11);大連市第二批領軍人才項目聯合資助。
張東升,教授,研究方向為水域微生態。Email:zhangds0415@126.com
周瑋,教授,研究方向為水產健康養殖技術。Email:zhouwei@dlou.edu.cn

