芍藥苷保肝藥理作用及新劑型的研究進展
袁騰騰,王雷,唐亞楠,胡子晗,杜嬌嬌,王汝琳,張彩云*,陳衛東*
(1.安徽中醫藥大學藥學院,安徽 合肥 230012;2.中藥復方安徽省重點實驗室,安徽 合肥 230012;3.現代藥物制劑安徽省工程技術研究中心,安徽 合肥 230038)
芍藥苷(paeoniflorin,PF)來源于芍藥科植物芍藥根、牡丹根和紫牡丹根,是一種單萜糖苷類化合物[1]。作為中藥芍藥的主要活性成分,PF具有多種藥理作用,如保肝、抗炎、鎮痛、抗抑郁、降低心肌耗氧量等[2]。然而,PF是一種高水溶性的酚類化合物,脂溶性差,不易通過細胞膜,雖然在一些疾病的治療中表現出明顯的優勢,但起效較慢,生物利用度較低,限制了其廣泛應用[3]。近年來,為改善PF的理化性質,針對PF劑型改造的研究越來越多,如將其制備成磷脂復合物、醇質體、脂質體等劑型可提高PF的生物利用度和藥效。本文圍繞PF的保肝藥理作用和機制及相關新劑型的研究進行綜述,以期為PF的應用和新劑型開發提供參考思路。
1 芍藥苷保肝藥理作用及機制
肝臟作為腹腔中最大的實質性器官,其功能復雜多樣,主要包括代謝、合成、生物轉化、分泌和排泄膽汁等。當肝臟功能受到損壞時,導致肝細胞壞死凋亡,從而引起肝衰竭。目前,肝臟疾病主要包括膽汁淤積性肝損傷、非酒精性脂肪肝(NAFLD)、肝纖維化、肝癌(HCC)及肝臟缺血/再灌注(I/R)損傷等。闡明各種肝臟疾病的發生發展機制,尋找有效治療藥物,減少該病的發病率與死亡率是人類世界亟須攻克的難題。
1.1 抗膽汁淤積性肝損傷 膽汁淤積性肝病包括原發性膽管炎(PBC)、原發性硬化性膽管炎(PSC)和雌激素所致膽汁淤積等。膽汁的積聚和成分的改變對肝細胞和膽管均有毒性作用,導致損傷和炎癥。如果治療延遲,可能會進一步發展為肝纖維化、肝硬化甚至肝癌[4]。研究報道,膽管結扎、α-萘異硫氰酸酯(ANIT)、雌激素和脂多糖(LPS)等是常用的用于模擬膽汁淤積性肝損傷的動物模型[5]。有趣的是,膽汁淤積的發病機制與諸多信號通路的調節有關,主要涉及炎癥通路、肝臟轉運蛋白表達失調以及肝組織氧化應激損傷等。
PF作為我國傳統中草藥芍藥的主要活性成分已廣泛應用于肝臟疾病中。研究報道,PF(0.2、0.1或0.05 g·kg-1)能顯著抑制ANIT誘導的血清谷丙轉氨酶(ALT)、谷草轉氨酶(AST)、堿性磷酸酶(ALP)、血清總膽紅素(TBIL)、直接膽紅素(DBIL)、總膽汁酸(TBA)和γ-谷氨酰轉肽酶(γ-GT)的變化,且組織學檢查顯示,PF對大鼠肝損傷和膽管增殖有明顯的緩解作用。發揮這一保護作用的機制是通過磷脂酰肌醇-3-羥激酶(PI3K)/蛋白激酶B(Akt)依賴通路激活核因子紅細胞相關因子2(Nrf2),增加谷胱甘肽(GSH)的合成[1]。此外,PF具有潛在的抗氧化作用,Zhao等[6]研究證明高劑量(0.2 g·kg-1)和中劑量(0.1 g·kg-1)的PF能顯著抑制一氧化氮和丙二醛的生成,并能恢復ANIT引起的谷胱甘肽的減少;實驗數據表明PF能抑制ANIT介導的活性氧(ROS)生成,可明顯逆轉ANIT誘導還原性煙酰胺腺嘌呤二核苷酸磷酸氧化酶(NOX4)的過表達,提示PF可以通過抑制NOX4的表達來清除ROS。肝臟轉運蛋白的調節、炎癥反應和凋亡途徑也是ANIT誘導的膽汁淤積性肝損傷的重要機制。膽汁酸的合成和分泌離不開位于肝細胞小管膜和基底外側膜上的轉運蛋白的操縱,包括小管轉運體(BSEP和MRP2)和基底外側轉運體(NTCP)。它們的主要職責是負責膽汁酸和外源性物質的攝取和流出,PF(200和50 mg·kg-1)顯著升高NTCP、MRP2、BSEP的表達,從而改善膽汁淤積所致的膽汁酸的積聚;核因子-κB(NF-κB)是將炎癥信號從細胞質轉移到細胞核的關鍵因子,誘導肝細胞中一系列炎癥因子,主要包括白介素-1β(IL-1β)、白介素-6(IL-6)和腫瘤壞死因子(TNF-α)。PF處理后,肝組織中NF-κB和IL-1β的表達降低[7];細胞凋亡是膽汁淤積過程中膽汁酸介導損傷的主要結果。線粒體膜蛋白B細胞淋巴瘤-2(Bcl-2)和Bax基因(Bax)位于不可逆細胞損傷的上游,直接作用于線粒體,是凋亡的關鍵調控因子,而細胞色素c位于線粒體內外膜之間,它從線粒體釋放到胞質中從而激發下游半胱氨酸天冬氨酸特異性蛋白酶(caspase)級聯反應,激活caspase-9,隨后激活caspase-3。因此膽汁酸被認為能直接引起線粒體細胞毒性,從而激活細胞凋亡的內在途徑。Zhou等[8]研究證實PF(0.2、0.1和0.05 g·kg-1)能顯著降低ANIT所致的促凋亡基因(Bax、caspase-9和caspase-3)表達的增加,同時逆轉抗凋亡基因Bcl-2的表達增強,PF可通過線粒體依賴途徑抑制體內細胞凋亡,從而減輕ANIT誘導的膽汁淤積。
PF也可通過干預膽汁酸代謝的相關靶點,在膽汁淤積性肝損傷的治療中發揮關鍵作用。在膽管結扎的膽汁淤積大鼠中,采用超高效液相色譜-四級桿串聯飛行時間質譜(UPLC-Q-TOF-MS)法對其血清進行分析,同時使用代謝組學的方法篩選出特異性代謝產物。在對膽汁淤積癥大鼠肝組織進行靶點驗證時,PF(200和50 mg·kg-1)可促進這些蛋白(MAP2K1、MAPK1、ILBP、ABCB1和LTA4H)的表達[9]。
1.2 抗非酒精性脂肪肝 非酒精性脂肪肝(NAFLD)是指除酒精和其他明確肝損傷因素所致的以肝臟中脂肪過度沉積為主要表現的臨床病理綜合征[10]。NAFLD發生發展的機制是復雜的、多因素的。現有的研究主要遵從“多重打擊”學說,主要包括以下幾個幾點:①胰島素抵抗;②線粒體功能失調;③氧化應激和ROS的產生;④內質網(ER)應激;⑤炎癥通路的激活和促炎細胞因子的釋放;⑥直接毒性和凋亡激活機制等[11]。由于傳統中藥多成分、多靶點的獨特性質,已被應用于各種疾病的研究中。研究表明PF可以通過多種信號通路抑制NAFLD的發生。在高脂飲食(HFD)誘導的NAFLD大鼠中,20 mg·kg-1的PF治療可顯著降低肝臟指數,降低血清總膽固醇、游離脂肪酸、ALT和AST水平且病理損傷減輕。此外,PF治療可顯著降低肝臟的脂質積聚,發揮這一作用的機制是PF通過調節脂質代謝、抑制氧化應激和調節IRS/Akt/GSK3β等通路來實現的[12]。在進一步的研究中,PF[20 mg·(kg·d)-1]顯著降低高膽固醇高脂肪(HCF)飼料誘導NASH大鼠的血清ALT和AST的活性,顯著降低總膽固醇、低密度脂蛋白和TNF-α水平。同時,PF可改善肝臟脂肪變性和炎癥,抑制CD68和轉化生長因子β1(TGF-β1)的表達。PF減輕大鼠NAFLD的機制可能還與下調肝組織Rho激酶(ROCK)活性和抑制 NF-κB信號通路的激活有關[13]。在探究PF對果糖誘導的胰島素抵抗和肝脂肪變性的影響中,Li等[14]研究發現PF(10~40 mg·kg-1)提高了肝臟中AMP激活的蛋白激酶(AMPK)和PKB/Akt的磷酸化水平,抑制了乙酰輔酶A羧化酶1(ACC1)的磷酸化;提高了肝臟肉堿棕櫚酰轉移酶(CPT)-1 mRNA和蛋白的表達,降低了固醇調控因子結合蛋白(SREBP)1c、硬脂酰輔酶A脫羧酶(SCD)-1和脂肪酸合成酶(FAS)mRNA的表達。此外,PF還顯著增加了腫瘤抑制因子絲氨酸/蘇氨酸激酶(LKB)1的肝臟蛋白表達,但不增加Ca2+/CaM依賴性蛋白激酶激酶(CaMKK)β的表達。提示PF的保護作用可能與激活LKB1/AMPK和胰島素信號通路有關,從而抑制脂肪生成,激活β-氧化和糖生成,改善胰島素抵抗和肝臟脂肪變性。在添加0.05% PF飲食處理的NAFLD模型中,PF發揮保護作用機制是通過阻斷炎癥基因的激活和降低糖異生基因的表達所介導的[15]。
1.3 抗肝纖維化 肝纖維化是大多數慢性肝損傷的病理反應的結果,是一種由病因引起的輪廓刺激轉化為病理狀態的生理過程[16]。各種類型的慢性肝損傷可導致肝纖維化,逐漸發展為肝硬化,并可導致肝癌[17]。肝纖維化的標志是結締組織成分的過度合成和異常沉積,特別是肝外細胞基質中的間質膠原[18]。而在放射性肝纖維化的研究中發現PF可顯著減輕肝損傷,減少膠原沉積,PF(20、40和80 mg·kg-1)可下調信號蛋白Smad3/4和轉化生長因子(TGF-β1)的表達,上調Smad7的表達。因此,PF可能通過調節TGF-β1/Smads信號通路抑制放射性肝纖維化[19]。在對四氯化碳(CCl4)誘導的小鼠肝纖維化模型中,PF(100 mg·kg-1)可明顯改善肝損傷小鼠的肝功能和肝組織病理。PF干預后,血清單胺氧化酶(MAO)酶活性和羥脯氨酸含量顯著降低。且波形蛋白(vimentin)、細胞骨架蛋白(α-SMA)、I型膠原蛋白(Col1a)和肌間線蛋白(desmin)的表達下降表明肝星狀細胞活化受到抑制。有趣的是,PF干預顯著上調了血紅素加氧酶-1的表達,減輕了炎癥細胞因子的產生以及CCl4誘導的氧化應激失衡。可見PF通過上調血紅素加氧酶-1來調節氧化應激、炎癥和肝星狀細胞活化以減輕CCl4誘導的小鼠肝纖維化[20]。在對CCl4大鼠和HSC-T6細胞株進行肝纖維化實驗中,PF(80~200 mg·kg-1)治療可減輕肝纖維化,抑制HSC活化。PF通過降低血清ALT、AST、ALP水平,升高白蛋白(ALB)、總蛋白(TP)水平,顯著增強肝功能。PF可抑制細胞外基質的降解,顯著降低α-SMA和Ⅲ型膠原mRNA的表達。其機制是PF通過mTOR依賴途徑抑制缺氧誘導因子-1α減輕肝纖維化[21]。
在探究二甲基亞硝胺(10 mg·kg-1)誘導的大鼠模型中潛在的抗纖維化作用,Chen等[22]發現,PF[20 mg·(kg·d)-1]處理的肝纖維化大鼠肝臟羥脯氨酸含量明顯降低,組織病理學明顯改善。發揮這一改善作用的原因部分是通過抑制主要器官的巨噬細胞激活(肝、脾、肺組織CD68表達明顯降低)而降低二甲基亞硝胺誘導的大鼠肝纖維化。
血吸蟲病是一種引起肝纖維化的慢性寄生蟲病[23]。Harb等[24]將PF與吡喹酮(PZQ)進行抗寄生蟲和抗纖維化性能比較評價發現,PF[50 mg·(kg·d)-1]治療組能改善寄生蟲學參數,包括降低蟲重、幼蟲、成熟卵和增加死亡蟲卵。但PF對于血吸蟲病引起的肝纖維化的治療中發現,肝平均肉芽腫直徑和纖維化面積明顯減小,血清TNF-α、caspase-3和p53凋亡表達明顯升高,血清IL-13、NF-κB、TGF-β1、α-平滑肌肌動蛋白表達明顯降低,以上結果表明PF在靶向凋亡和減輕纖維化方面具有明顯的優勢。
1.4 抗肝癌 肝癌(HCC)是世界上最普遍的惡性腫瘤之一,主要的臨床特點是侵襲性、預后較差和治療選擇有限,是長期慢性肝臟炎癥和肝硬化的直接結果[25]。目前關于HCC成熟的分子機制主要涉及上皮-間充質轉化、腫瘤-間充質相互作用和腫瘤微環境、腫瘤干細胞和衰老旁路。此外,循環腫瘤細胞、免疫調節和神經調節也參與HCC的發生發展[26]。因此,深入了解HCC進展的分子機制和尋找預后良好、毒副作用小的藥物是迫切需要的。PF被認為是一種有效的抗轉移、抗侵襲藥物,Lu等[27]研究證實PF可能具有抗腫瘤活性。6.25~200 μmol·L-1的PF對HepG2和Bel-7402肝癌細胞株的生長有抑制作用,降低肝癌細胞株的侵襲、轉移和黏附,其機制可能是PF降低了HepG2和Bel-7402細胞中基質金屬蛋白酶(MMP-9)和細胞外信號調節蛋白激酶(ERK)的表達,增加了上皮型鈣黏蛋白(E-cad)的表達。王昌高等[28]給予10、30 μmol·L-1PF抑制肝癌HepG2細胞的侵襲和遷移是通過抑制TGF-β1/Smads信號通路實現的。此外,晏雪生等[29]研究表明PF(2 mg·mL-1)能在一定程度上抑制HepG2細胞的增殖和誘導其凋亡,其作用機理之一可能是上調促凋亡基因Bax和P53的表達。張亞武等[30-31]的研究結果發現PF(0.5、 2 mg·mL-1)可能通過調節caspase-3活性和NF-κB信號通路誘導HepG2肝癌細胞凋亡,達到抗腫瘤效果。路景濤[32]證實PF(50、100和200 μmol·L-1)可激活Hedgehog/Gli信號通路、上調MAPK/ERK信號通路及增加MMP-9蛋白的表達參與肝癌Bel-7402細胞的侵襲轉移。還有研究證實PF(1、5、10、20、40 μmol·L-1)可能通過蛋白酪氨酸激酶/信號傳導及轉錄活化因子3(JAK/STAT3)通路調節程序性細胞死亡配體1(PD-L1),參與腫瘤患者的免疫調控系統,增強抗腫瘤免疫應答[33]。5-羥色胺1D受體(5-HT1D)是一種神經遞質受體,具有多種生理功能,被認為與腫瘤發生有關,而5-HT1D可顯著促進HCC細胞的增殖、上皮間質轉化和轉移。因此,通過下調5-HT1D來抑制Wnt/β-catenin通路是PF影響肝癌進展的又一機制。不同濃度的PF(0、5、10和20 μmol·L-1)刺激下,HepG2和SMMC-7721細胞中5-HT1D的表達顯著下調,從而抑制細胞凋亡,延緩肝癌的進展[34]。
1.5 抗肝臟缺血/再灌注損傷 肝臟缺血/再灌注損傷(I/R)損傷是一個極其復雜的過程,起先是缺氧導致損傷,隨后再灌注引起血液充氧,從而激活先天免疫反應,進而導致肝臟損傷[35]。小鼠尾靜脈注射PF(5、10和20 mg·kg-1)可通過抗氧化、抗炎、抗凋亡途徑對抗I/R。其中,線粒體結構完整性的破壞,導致呼吸鏈、內外膜及基質蛋白功能和ATP合成的抑制都可誘發肝細胞的凋亡,I/R導致線粒體功能障礙,而尾靜脈注射30 mg·(kg·d)-1PF預處理緩解這一情況,提示PF預處理可減輕大鼠I/R的機制可能與保護線粒體有關[36]。同時,灌胃PF[100 mg·(kg·d)-1]顯著抑制I/R組血清ALT、AST活性(分別為40.3%和53.8%),顯著抑制肝臟病理損傷和肝細胞凋亡(P<0.01),抑制中性粒細胞向肝臟浸潤。對肝臟I/R損傷具有保護作用與抑制I/R激活的HMGB1-TLR4信號通路減輕肝臟炎癥反應有關[37]。
綜上所述,PF具有良好的保肝活性(見表1、圖1),在臨床應用中具有較好的成藥前景。但由于PF脂溶性較差,口服生物利用度低,嚴重影響了臨床療效的發揮。目前,針對PF進行制劑新技術改進研究是重要的研究熱點。
2 芍藥苷新劑型
2.1 納米粒 納米粒可使藥物的溶解度增大,提高藥物的有效性和安全性。錢佳佳等[38]制備的玉米醇溶蛋白-芍藥苷納米粒顯著提高PF的穩定性和口服生物利用度。對于中樞神經系統性疾病,血腦屏障是阻礙藥物發揮治療作用的重要原因之一,為了提高PF的腦靶向,Xiong等[39]制備了乳鐵蛋白并負載PF的黑磷納米片,這些納米顆粒協同光熱效應,能夠穿透血腦屏障,有效地靶向治療帕金森病。此外,脂質液晶納米粒因其具有包封不同極性的藥物、提高藥物的穩定性和靶向給藥等優點被廣泛應用[40]。將PF載入脂質液晶納米粒達到維持PF的穩定和緩釋的目的[41]。為了進一步研究PF脂質液晶納米粒在大鼠不同腸段的吸收特性,滕爽等[42]采用離體腸外翻模型進行腸吸收研究,結果也證實了脂質液晶納米粒能顯著改善PF的腸吸收,提高了PF的生物利用度。
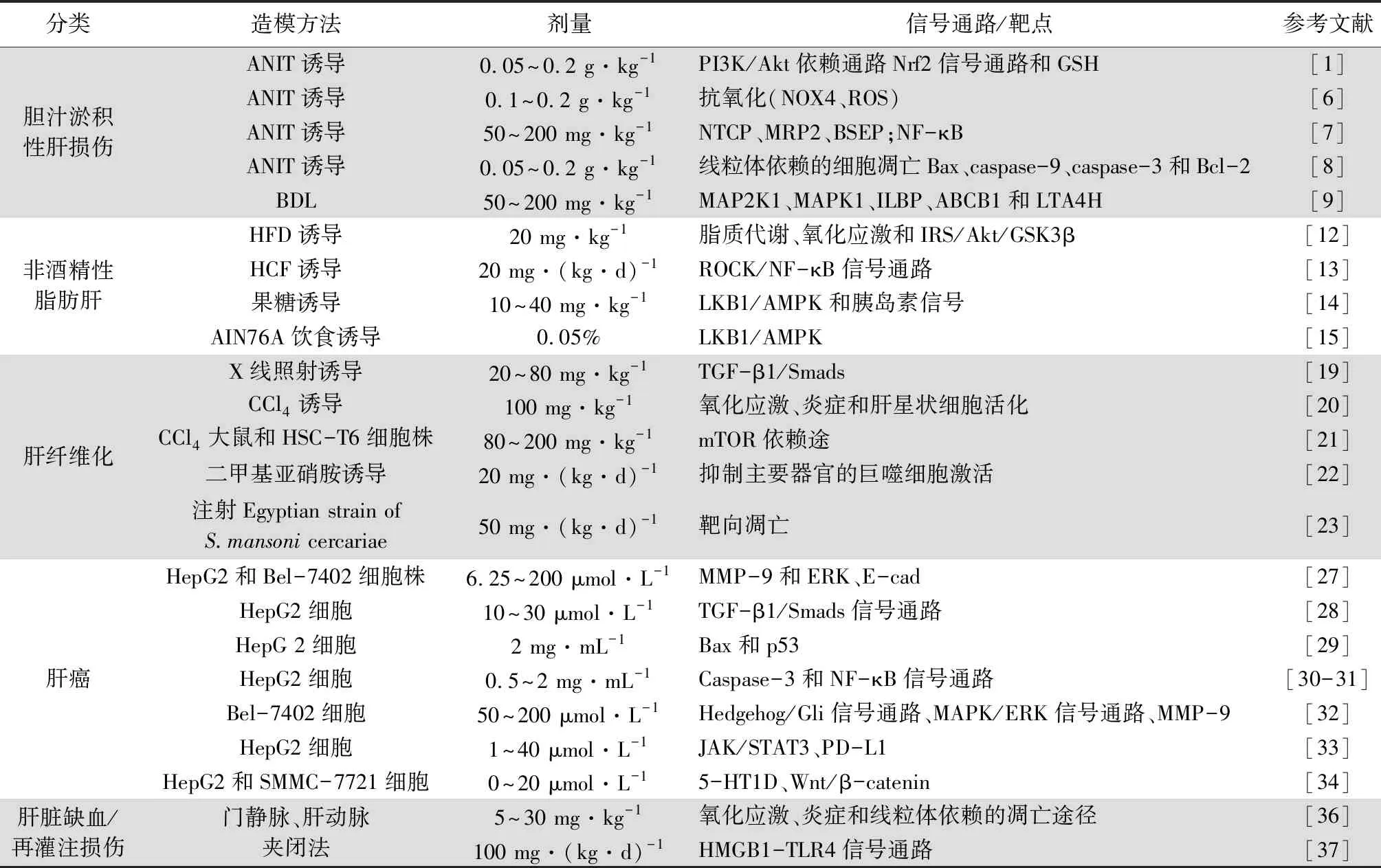
表1 PF在肝臟疾病中的藥理活性
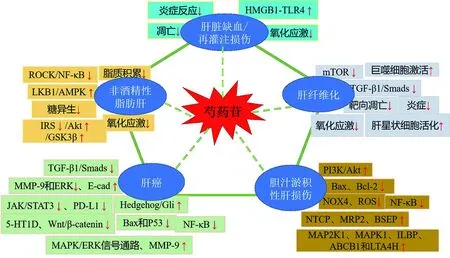
圖1 芍藥苷通過信號通路對肝臟疾病的調控作用 注:“↑”表示上調,“↓”表示抑制。
2.2 脂質體與醇質體 脂質體是將藥物包封于類脂質雙分子層內而形成的微型泡囊,類似于生物細胞膜,可使藥物選擇性的達到靶向部位[43]。洪璐峰等[44]利用脂質體的雙親性,將水溶性的PF和脂溶性的丹參酮IIA共同包載于脂質體中,實驗證實其3個月內的穩定性較好且12 h的釋放量達到90.0%±3.22%。脂質體的形成有效改善了丹參酮IIA的水溶性差、易氧化分解等缺點,為脂質體同時負載水溶性和脂溶性藥物提供了一定的實驗研究基礎。
醇質體是藥物經皮傳遞系統中最受關注的新型載體之一,廣泛應用于醫學、藥學、美容和皮膚抗衰老等領域,具體制備方法見表2[45-50]。對于外用制劑,跨越皮膚屏障進入真皮是藥物被毛細血管吸收進入體循環的前提,藥物通過毛細血管擴散到真皮,從而發揮治療效果[51]。PF被包裹在醇質體中,結果顯著提高了包封率,還聯合物理方法提高了透皮吸收速率,增加了PF完整的滲透深度[45-46,52]。以上研究為醇質體促進藥物深部組織滲透的研究提供了實驗依據,也為PF劑型和給藥途徑的研究提供了參考。

表2 醇質體的制備方法及特點
2.3 磷脂復合物 磷脂復合物是藥物與磷脂分子通過電荷轉移形成的相對穩定的化合物或復合物,其在水溶液中能通過自組裝形成類似于脂質體結構的藥物遞送系統,具有良好的親水親油性[53]。藥物與磷脂復合形成載體系統或前體藥物后,能改善藥物在胃腸道的溶出和吸收,提高血藥濃度,延緩藥物消除,進而提高生物利用度,同時磷脂復合物也能夠改善藥物的穩定性[54]。朱延焱等[55-56]以復合物的得率為指標,通過單因素考察或正交試驗等優化制備工藝,并結合紫外、紅外光譜等分析確認芍藥苷磷脂復合物(PF-PLC)的形成。在Qian等[57]研究的PF-PLC中,正辛醇/水分配系數(lgP)結果顯示,lgP值高的親脂性較好,釋放較慢,符合一級動力學,且初步藥代動力學結果也證明PF-PLC可提高大鼠口服生物利用度。Yuan等[58]研究了具有雙層球形的PF-PLC自組裝納米粒對膽汁淤積大鼠肝損傷的保護作用,結果證實PF-PLC自組裝納米粒的形成顯著改善PF對膽汁淤積大鼠肝臟指標的影響,有效緩解肝臟損傷,為PF的應用提供了一種有前景的給藥體系。
2.4 微囊與微乳 微囊化是一種提高難溶藥物生物利用度的新型制劑,藥物通過微囊化處理可以提高分散度,增大表面積,使藥物的吸收效率提高,從而提高藥物的生物利用度[59]。董自亮等[60]采用復凝聚法制備了PF微囊,結果發現微囊中PF 3 h后的釋藥速度緩慢且體外釋放按照一級動力學模型釋藥。王昭[61]制備的PF微囊在pH為6.8的溶液中,釋放速度較緩慢,由此可以看出PF微囊在人體生理環境下藥效是緩釋的。
微乳液是一種黏度低、具有良好的各向同性和熱力學穩定性的透明或半透明制劑,制備簡單,保存方便,對親脂親水藥物有良好的增溶作用,藥物分散性好[62]。魏偉課題組對PF微乳劑進行了深入的研究,體外經皮滲透性研究發現PF微乳提高了離體小鼠的透皮吸收能力[63];對大鼠腸道的吸收動力學的研究中發現(油包水型)PF微乳通過大鼠在體腸吸收模型,的吸收速率常數Ka明顯高于PF水溶液,說明將PF制備成微乳可以顯著提高其生物利用度[64];與PF組(100 mg·kg-1)的藥代動力學參數相比,PF微乳(100 mg·kg-1)的最大濃度(Cmax)、血藥濃度-時間曲線下面積(AUC0~t)、平均保留時間(MRT0~∞)明顯增加,而分布體積(Vd)和清除率(Cl/F)下降;同時,在對大鼠佐劑性關節炎(AA)的研究中還發現,PF微乳對AA大鼠多發性關節炎和免疫功能的抑制作用明顯優于PF原料藥[65]。上述研究結果表明,微乳能顯著提高AA大鼠對PF的吸收和藥效[66]。
2.5 凝膠劑 凝膠是由一定濃度的高分子溶液或溶膠增大黏度后失去流動性而形成[67],具有可觀的穩定性和生物相容性[68]。目前針對PF所制備的凝膠劑主要包括PF醇質體凝膠劑、PF固體脂質納米粒凝膠劑、載PF水凝膠等[69]。對于皮膚疾病的治療研究中發現,無論是哪種PF凝膠劑在透皮滲透性能的研究中都表現出與皮膚的高融合性,顯著提高PF的累積透皮量和在皮膚中的滯留量,凝膠劑增強了透過效率,提高了PF生物利用度并使療效提高,為皮膚疾病的治療提供一個新的研究思路[70]。
2.6 其他劑型 為了提高PF的口服生物利用度,Shen等[69]以甘草酸(GL)為載體,采用超聲分散法制備負載PF的GL膠束,單通道腸道灌注研究發現負載PF的GL膠束可明顯增強PF的腸道通透性;體內藥代動力學結果證明PF膠束的Cmax和AUC0~t值分別約為PF原料藥的2.18倍和3.64倍。在對于中樞神經系統的疾病治療中,朱智濤等[71]基于大鼠鼻腔灌流法篩選了PF經鼻給藥制劑的吸收促進劑,以實現繞過血腦屏障直接進入中樞系統,增加PF的吸收從而有效發揮PF治療中樞神經系統性疾病的藥理作用。
3 總結與展望
PF作為芍藥的有效活性成分,具有廣泛的藥理作用。特別是對于肝臟疾病的治療作用,通常發揮多靶點的作用。本文全面綜述了PF保肝藥理作用及機制,可為PF的臨床應用提供依據。為了提高PF的穩定性,改善其不易透過生物膜、生物利用度低等不足,本文整理了PF不同的劑型研究,并分析了對PF吸收和藥效提高的改善情況,為PF遞送系統的研究開發提供更多參考。

