CT薄層影像特征制定的肺結節分級評估系統區分良惡性肺結節的應用價值
劉海玲 陳國萍 陶景山 謝迎娣
孤立性肺結節(solitary pulmonary nodule, SPN)胸外科常見疾病之一,包括肺部原發性和轉移性腫瘤等惡性病變、良性腫瘤及感染性病變等[1]。隨著多層螺旋CT的廣泛應用,肺結節的檢出率明顯提高。對檢出的結節依據惡性危險性高低不同進行合理分級,對臨床推薦下一步處理意見和預后意義重大,是目前臨床研究的熱點問題之一。肺部影像報告和數據系統(lung imaging reporting and data system,Lung-RADS) 是2014年美國放射學院(American College of Radiology,ACR)頒布的肺癌CT篩查評估系統,然而從既往的報道[2-3]中發現Lung-RADS分級征象依據不夠充分,且未納入較多的影像學征象。因此,我科多位臨床醫師在查閱了近年肺結節相關文獻[4-5]及參考Lung-RADS后共同制定了基于CT薄層影像特征的肺結節分級評估系統。本研究擬應用該評估系統,分析了我院SPN進行回顧性分級評定,旨在為臨床診斷良惡性SPN提供更多依據,現報告如下。
資料與方法
一、 一般資料
回顧性分析我院2018年9月至2020年7月確診的122例SPN患者的臨床資料。納入標準[6-7]:(1)患者以咳嗽、咳痰、痰中帶血、胸痛、胸悶或胸部不適入院檢查;(2)肺部單發結節且結節直徑≤3 cm;(3)行薄層CT 重建并有病理結果;(4)入院前未接受任何治療;(5)獲取完整薄層CT影像資料,且圖像質量高。排除標準[7]:(1)伴肺不張或明顯淋巴結腫大、腫瘤病史者;(2)對比劑過敏史、無法耐受高對比劑注射流率者;(3)檢查中呼吸配合不佳,致預掃描SPN病灶超出掃描范圍者。其中男性78例,女性44例;年齡26歲~68歲,平均(48.2±8.2)歲,病灶直徑0.6~3.0 cm,平均(2.1±0.6)cm,經術后病理證實62例,其余經穿刺活檢細胞學檢查證實。
二、 儀器與方法
所有入組患者使用64排螺旋CT(生產廠商:美國通用電氣,型號:Optima CT 660)掃描儀。掃描參數:管電壓120kV,管電流 100mAs,層厚5 mm,層間距5 mm,準直管寬度0.6 mm,螺距1.2,重建層厚0.625 mm。檢查取仰臥位兩手上舉囑患者深吸氣后屏氣,掃描從肺尖一直到橫膈層面,肺窗設為1500HU、-500HU,縱隔窗設為350HU、40HU。將所得原始資料按1 mm標準算法重建后傳到GE AW4.7工作站行多平面重組(Multiplanar reorganization, MPR)、容積再現 (Volume representation, VR)重建,著重觀察CT掃描圖像中SPN大小、形態、密度、邊緣等,并據此確定SPN的良惡性。
三、 圖像分析
選擇2位有具有胸部疾病影像診斷經驗的醫師閱片,在薄層軸位上觀察結節征象對肺結節進行分級評估,診斷結果不一致時,須經協商給出統一結果。結節進行分級采用肺結節分級評估系統分級標準(見表1)。

表1 肺結節分級評估系統2~4級標準
四、 統計學方法
采用SPSS21.0統計學軟件,計數資料以率(%)表示行χ2檢驗,并通過Kappa(κ)檢驗分析肺結節分級標準與病理診斷結果的一致性。Kappa>0.61為良好,>0.81為非常好。按α=0.05的檢驗水準,以P<0.05為差異有統計學意義。
結 果
一、 SPN病理診斷、肺結節分級標準結果
122例單發SPN患者,經病理診斷證實良性SPN 56例(占45.9%),其中31例不典型增生(占55.4%),16例錯構瘤(占28.6%),5例肺炎性假瘤(占8.9%),4例硬化性肺細胞瘤(占7.1%);惡性SPN 66例(占54.1%),其中44例腺癌(占66.7%),15例鱗癌(占22.7%)、7例原位癌(占10.6%)。
肺結節分級標準結果2級31例、3級29例、4A級9例、4B級53例。
二、 肺良、惡性結節的CT 征象比較
肺惡性結節中空泡征、寶石征、腫瘤血管征、毛刺征的發生率明顯高于肺良性結節(均P<0.05),而病灶周圍有衛星病灶的發生率明顯低于肺良性結節(P<0.05)(見表2)。
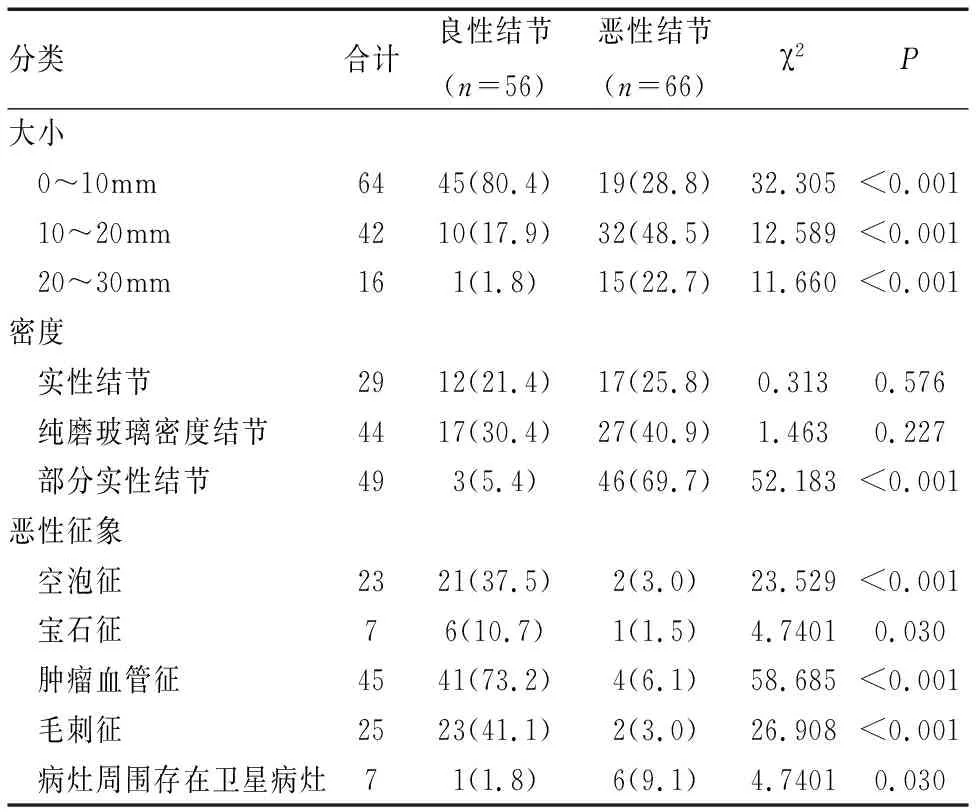
表2 肺良、惡性結節的CT 征象比較[n(%)]
三、 肺結節分級標準與病理結果比較
將肺結節分級標準中3級及以下歸為陰性結節,4級及以上歸為陽性結節,診斷準確率為90.2%。肺結節分級標準診斷肺良性結節與病理結果表現出了較好的一致性(Kappa=0.803),以肺結節分級標準診斷肺良性結節的結果與“金標準”(病理診斷結果)比較,得到的敏感度87.9%(58/66)和特異度92.9%(52/56)(見表1)。

表3 肺結節分級標準與病理結果比較
四、 典型病例圖像(見圖1)。
病例1,女,54歲:(圖1A、B)CT平掃示病灶呈純磨玻璃密度,大小約11mm×9mm,多平面重建顯示病灶中心可見空泡征;肺結節分級標準4A級,病理證實左上肺微浸潤腺癌(MIA)。病例2(圖1C、D),女,45歲:C. CT平掃示病灶呈實性小結節,大小約7 mm×6 mm,邊緣光滑,血管貼邊;D.矢狀面重組示小橢圓形,小葉間隔線貼邊,肺結節分級標準2級,證實為左肺下葉肺內小淋巴結。病例3(圖1E、F),男,71歲:E. CT平掃示病灶呈部分實性結節,大小約21 mm×19 mm,中心密度高,周圍邊界清晰磨玻璃暈,呈寶石征;F. CT平掃冠狀面重建示腫瘤血管征,毛刺征,實性成分長徑約10 mm,肺結節分級標準4B級,病理證實右上肺浸潤性腺癌(IAC)。病例4(圖1G、H),男,56歲:G. CT平掃示病灶呈斑片狀淡磨玻璃密度,邊界清晰,大小約10 mm×9 mm,肺結節分級標準3級;H.12個月復查,大小約15 mm×10 mm,隨訪結節體積增大,密度增高,腫瘤血管征,觸發分級4處理方案,病理證實右上肺腺癌(LPA,貼壁生長為主型)。
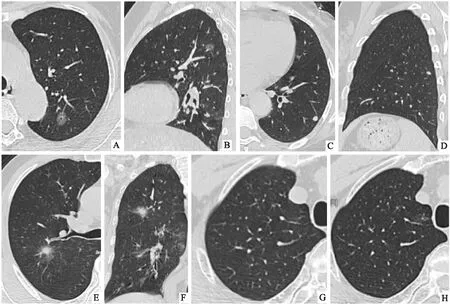
圖1 A、B:病例1,CT平掃示左肺上葉尖后段見結節,呈純磨玻璃密度,中心可見空泡征;C、D:病例2,CT平掃示左肺下葉胸膜下見實性小結節,邊緣光滑;E、F:病例3,CT平掃示右肺上葉后段見一結節,部分實性,中心密度高,周圍邊界清晰,呈寶石征,冠狀面重建可見腫瘤血管征,邊緣毛刺征;G、H:病例4,CT平掃示右肺上葉尖段見結節,病灶呈斑片狀淡磨玻璃密度,邊界清晰,復查后見結節體積增大,密度增高,見腫瘤血管征。
討 論
肺癌發病率居世界所有疾病之首,且呈逐年上升趨勢。多種肺部良惡性疾病早期均可表現為SPN,因此SPN的正確鑒別對臨床下一步診療工作具有重要的指導意義。Lung-RADS分級標準用來規范肺癌基線篩查、影像報告書寫、病灶處理建議,不過其分級征象依據不夠充分且未納入較多的影像學征象,一定程度上限制了其應用[8-9]。本文考慮到薄層CT具有對SPN細節清晰顯示特點,因此提出基于CT薄層影像特征的肺結節分級評估系統,通過加入較多的CT影像學征象對不同結節進行分級管理,為進一步給出不同級別結節的下一步診療提供建議。本次研究結果顯示基于CT薄層影像特征的肺結節分級判斷肺良性結節與病理結果表現出了較好的一致性(Kappa=0.803),與“金標準”(病理檢查結果)比較,得到的敏感度87.9%(58/66)和特異度92.9%(52/56),提示該分級標準預測肺惡性結節的價值較高,可以對SPN 良、惡性進行充分鑒別。
SPN的大小和生長方式是評估結節惡性潛能的兩大要素,Pinsky等[10]指出惡性結節的可能性與結節直徑呈顯著正相關,本文也得到了類似的結果。亞實性結節依據有無實性成分,分為部分實性結節和磨玻璃結節[11-12],臨床證實磨玻璃結節病灶內保留了支氣管和血管等正常的肺結構,表現為更惰性的生物學行為,惡變率低[13]。張艷等[13]指出部分實性結節與惡性腫瘤的發生明顯相關,相較實性病灶,部分實性病灶具有更高的惡性風險。本次研究結果亦發現部分實性結節為惡性結節的可能性更高,明顯高于實性結節及純磨玻璃密度結節,提示部分實性結節分級,在肺結節分級評估系統3~4級,高度懷疑惡性可能。
即便SPN的大小和實性成分對定性診斷病灶意義重大,但SPN形態學的價值同樣值得重視。臨床發現毛刺、分葉及腫瘤血管征等,是鑒別SPN良惡性最敏感的征象,臨床診斷SPN良惡性時結合上述征象可顯著提高臨床診斷的準確率[14-15]。本次研究結果顯示肺惡性結節中空泡征、寶石征、腫瘤血管征、毛刺征的發生率明顯高于肺良性結節(均P<0.05),提示這與腫瘤細胞生長浸潤方式相關,如圖像表現出的分葉或細短毛刺改變是由于腫瘤細胞在肺泡壁間不同程度播散及結締組織增生引起的。而病灶周圍有衛星病灶的發生率明顯低于肺良性結節(P<0.05),Fleischner學會也提出SPN病灶周圍有衛星病灶多為良性[16],提示這一現象多是由陳舊性病灶愈合引起的,屬于穩定性病灶。
綜上所述,SPN結節良惡性評估需同時把握病灶的大小、實性成分及形態學,影像診斷時合理利用基于CT薄層影像特征制定的肺結節分級評估系統能有效地對 CT 篩查出的肺結節進行分類,對 SPN良惡性的鑒別診斷具有較高的臨床應用價值。不過本次研究所選樣本均為手術確證病例且為單中心回顧性研究,結果可能存在一定偏倚,還有待后續研究進一步驗證。

