MALDI-TOF MS鑒定馬爾尼菲籃狀菌的實驗條件優化*
劉俞谷,賀 瑩,傅俊方,龍 軍,熊 君,江凌曉,王艷芳△
1.南方醫科大學珠江醫院檢驗醫學部微生物組醫學中心,廣東廣州 510282;2.南方醫科大學珠江醫院廣東省公共衛生創新平臺,廣東廣州 510282
馬爾尼菲籃狀菌(TM)是一種雙相真菌,流行于東南亞地區及我國南方地區,可致播散性感染,多發于免疫缺陷患者,其病情兇險、預后差,因此早期準確鑒定尤為重要[1-3]。目前,TM的鑒定以其典型菌落特征(溫度雙相性和紅色素)為主,但對于形態不典型菌株,單一溫度培養時檢驗人員易出現判斷錯誤的情況,從而延誤患者的診治。分子生物學方法雖是“金標準”,但目前尚不適用于臨床檢驗科的常規鑒定。近年來,基質輔助激光解吸電離飛行時間質譜技術(MALDI-TOF MS)在微生物鑒定領域發展迅速,因其具有快速準確的優點被稱為最有前景的鑒定方法[4-5]。目前MALDI-TOF MS應用較廣泛的有Bruker Biotyper及VITEK MS系統,但其對于雙相真菌的應用研究較為滯后[6]。本研究擬在VITEK MS科研模式(RUO模式)中構建TM的參考數據庫,并通過比較不同培養條件及樣品前處理方法,探索用于TM質譜鑒定的最佳培養條件和前處理方法。現報道如下。
1 材料與方法
1.1材料來源 南方醫科大學珠江醫院檢驗科分離的TM 8株,菌株編號分別為ZJ01、ZJ02、ZJ2360、ZJ399、ZJ18919110、ZJ110307、ZD180201、ZJLin,以上菌株均經形態學及ITS測序鑒定。以大腸埃希菌ATCC8739作為校準和內質控菌株。
1.2儀器與試劑 MALDI-TOF MS儀(法國生物梅里埃股份有限公司,數據庫版本V3.0,RUO模式);隔水式電熱恒溫箱(28、35 ℃),高速冰凍離心機,大型落地搖床(美國Themo Fisher科技有限公司);電子天平;沙保弱葡萄糖瓊脂培養基(SDA,廣州市迪景微生物科技公司);VITEK MS-CHCA基質液(主要成分為α-氰基-4羥基肉桂酸)、VITEK MS-FA(主要成分為甲酸,酵母菌前處理液)、VITEK MS-DS靶板(法國生物梅里埃股份有限公司);葡萄糖,蛋白胨[生工生物工程(上海)股份有限公司];70%乙醇,甲酸,乙腈(天津市化學試劑供銷公司),蒸餾水等。
1.3方法
1.3.1分生孢子懸液制備 于SDA平板接種上述8株TM,28 ℃培養5 d,用含0.05%吐溫20的磷酸鹽緩沖液收集菌液,并經12層無菌紗布過濾得到孢子懸液,計數并調節孢子濃度為2×107個/毫升。
1.3.2菌株培養 取上述TM菌株約2×106個孢子接種于SDA、沙氏葡萄糖肉湯培養基(SDB)中,于28、35 ℃進行培養,分別在第3、5、7、9天取菌落前處理進行質譜鑒定。以編號ZD180201菌株的質譜數據建立TM質譜參考庫。其余7株TM用于驗證參考庫及構建TM超級譜圖庫。
1.3.3菌落前處理方法 酵母相菌落(35 ℃)分別采用甲酸乙腈法或者直涂法處理,菌絲相菌落(28 ℃)生長過程的孢子與菌絲不夠豐富,且部分生長呈現“咬瓊脂”現象,難取樣,因此未采用直涂法,按照VITEK MS推薦的絲狀真菌前處理方法即甲酸乙腈法處理,具體步驟如下。甲酸乙腈法:按照VITEK MS絲狀真菌前處理方法進行處理,即生物安全柜內挑SDA或SDB中菌落分別于900 μL 70%乙醇靜置10 min,14 000 r/min離心2 min,棄上清液;沉淀中加入70%甲酸和乙腈各40 μL振蕩混勻,14 000 r/min離心2 min。取1 μL上清液及質控菌株加于靶板點位上,干燥后覆蓋1 μL CHCA基質液,室溫下干燥上機,自動采集質譜譜圖。直涂法:生物安全柜內直接取酵母相菌落適量涂靶板,待干后加入0.5 μL VITEK MS-FA,干燥后覆蓋1 μL CHCA基質液,同上采集質譜譜圖。
1.3.4構建參考庫 以其中1株(編號ZD180201)在不同培養基(SDA、SDB),培養溫度(28、35 ℃),培養天數(3、5、7、9 d),前處理方法(甲酸乙腈法、直涂法)的高質量譜圖,即背景噪音低、基峰分辨率高、主次峰分布錯落有致、一致性好、主峰信號強度強、基線穩定及出峰數為80~250個的譜圖,構建TM參考庫,加入VITEK SARAMI數據庫中。
1.3.5結果判讀 專用分析軟件對鑒定結果進行判讀,版本為V3.0。靶板點位通過點位顏色變化來提示結果的可信度,通常有綠、黃、紅3種顏色。綠色提示只有一個鑒定結果,概率為60.0%~99.9%,結果可信度水平高。黃色提示儀器對標本分辨率較低,需要進一步采用試驗進行區別。紅色提示與數據庫中任何質譜不匹配。
1.3.6驗證并創建超級譜圖庫 利用其余7株TM驗證TM參考庫,并匯總高質量質譜譜圖,創建超級譜圖庫,保留39~41個特征性峰,特征性峰權重之和≤1 400。
1.4統計學處理 計數資料以頻數或百分率表示,比較不同培養天數、培養溫度、前處理方法時的TM質譜鑒定正確率。正確率=正確鑒定菌株數/總數×100%。因樣本量小,未進行統計分析。
2 結 果
2.1不同培養天數、培養溫度及前處理條件對TM質譜譜圖的影響 TM質譜譜圖的離子峰以位于質荷比m/z7 848.00、6 113.00、6 668.00、3 335.00附近的特征峰為主,見圖1。不同培養溫度時,特征峰信號基本相似但略有不同,28 ℃培養特征峰主要以m/z6 113.00附近為主峰,見圖1A、B,而35 ℃培養以m/z7 848.00附近為主峰,見圖1C、D。
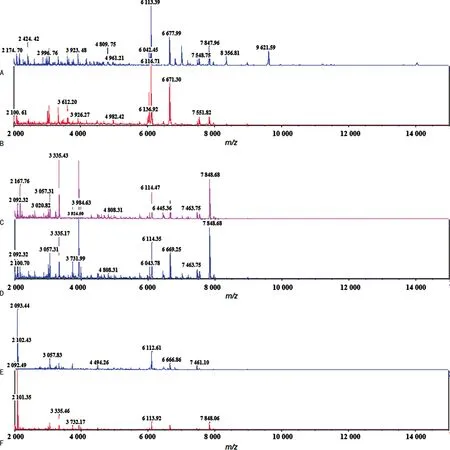
注:A為28 ℃,SDA培養3 d,甲酸乙腈法;B為28 ℃,SDB培養3 d,甲酸乙腈法;C為35 ℃,SDA培養5 d,直涂法;D為35 ℃,SDA培養5 d,甲酸乙腈法;E為28 ℃,SDA培養9 d,甲酸乙腈法;F為35 ℃,SDA培養9 d,直涂法。
相比于SDB,SDA培養的TM更易采集到較多的特征離子峰信號且強度明顯的高質量質譜譜圖,見圖1A、B。TM在SDB 35 ℃培養的菌落采集的高質量譜圖數量較少,譜圖主要表現為干擾峰多,特征峰信號強度不明顯,未納入參考庫。且未使用SDB繼續對其他7株臨床分離菌株進行培養。
不同培養時長對特征峰的數量與強度影響較為明顯,培養3~5 d時采集的質譜譜圖質量更佳,可獲得較多數量且信號強度明顯的特征峰,信噪比較高,見圖1A、B、C、D,而培養第9天時特征峰的數量明顯減少且信號強度減弱,甚至消失,見圖1E、F。
甲酸乙腈法與直涂法前處理方法進行比較后發現,在特征峰最佳的第3天培養時,甲酸乙腈法較直涂法可獲得更多數量、信號強度更明顯的特征峰,且信噪比更高,質譜譜圖與參考庫中的特征性質譜譜圖匹配效果更好,提示蛋白提取效果更佳,見圖1C、D。
2.2MALDI-TOF MS對不同培養溫度、培養天數的TM的鑒定正確率比較 不同培養溫度下的TM鑒定結果顯示,在相同培養天數時,35 ℃培養菌落鑒定正確率均高于28 ℃培養菌落,其中35 ℃培養3~7 d內鑒定正確率均超過70.0%,培養5 d時鑒定正確率可達100.0%。而28 ℃培養菌落則需要在培養3~5 d內行MALDI-TOF MS鑒定,正確率可超過70.0%,見表1。
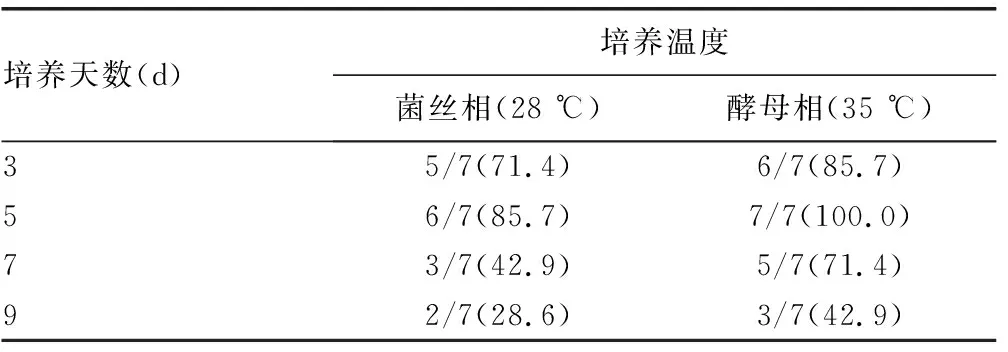
表1 VITEK MS RUO模式對不同培養溫度、培養天數的TM鑒定正確率比較[n/n(%)]
不同培養天數下的TM鑒定結果顯示,培養第5天鑒定正確率最高(28 ℃培養時鑒定正確率為85.7%,35 ℃培養時鑒定正確率為100.0%),而培養第9天時鑒定正確率最低,均不足50.0%,見表1。
2.3MALDI-TOF MS對不同前處理方法培養的TM的鑒定正確率比較 利用甲酸乙腈法、直涂法對35 ℃,SDA培養的TM進行前處理,結果顯示,經甲酸乙腈法提取蛋白進行鑒定的正確率略高于直涂法,見表2。另外,甲酸乙腈法及直涂法對TM的鑒定效果均表現為培養第3~5天鑒定正確率最高,隨著培養時間延長,鑒定正確率降低,見表2。

表2 VITEK MS RUO對不同前處理方法的TM的鑒定正確率比較[n/n(%)]
2.4MALDI-TOF MS在不典型TM鑒定中的價值
2.4.1不典型TM的形態學特征 本研究中的不典型TM菌株分離自南方醫科大學珠江醫院患者肺泡灌洗液和痰液,形態學表現為溫度雙相型,但是紅色素產生極緩慢,28 ℃培養7~9 d局部開始分泌紅色素,經ITS測序證實為TM(100%),見圖2。
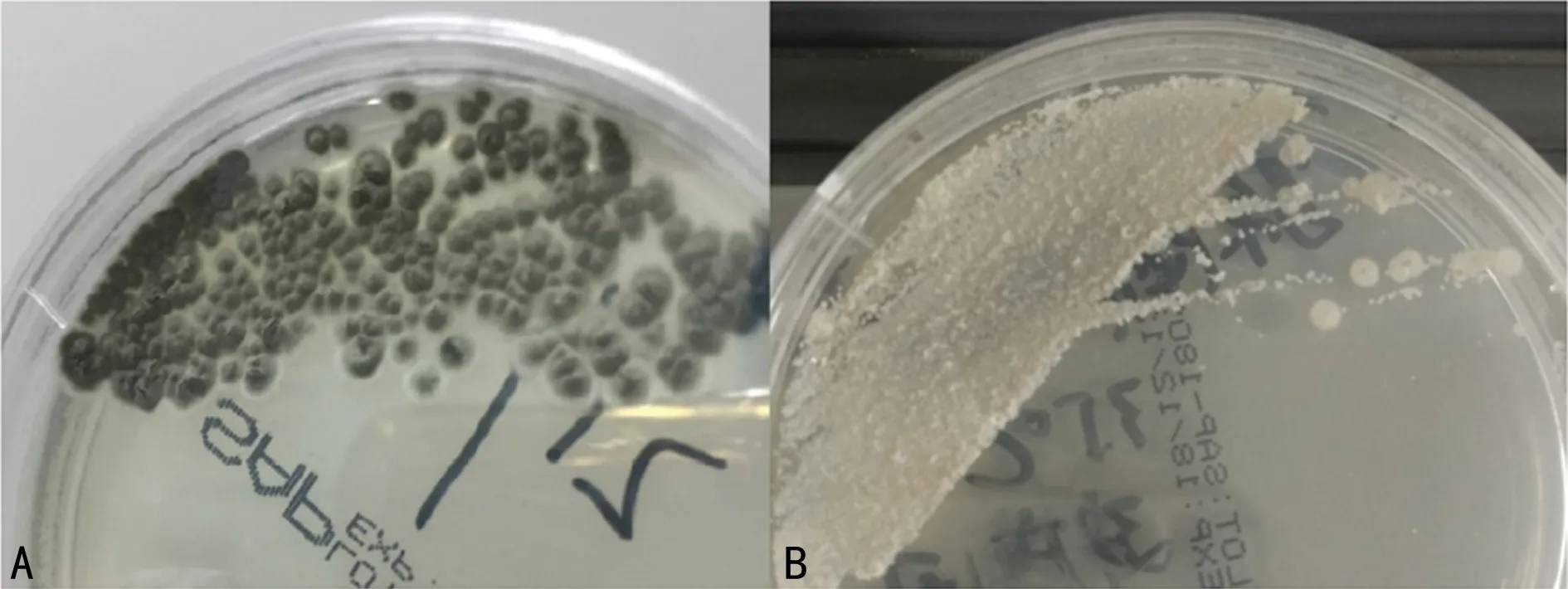
注:A為28 ℃,B為35 ℃。
2.4.2TM自建數據庫在不典型菌株鑒定中的應用 對于28 ℃培養7 d未分泌紅色素的不典型TM菌株(編號ZJLin),生長速度較典型TM慢,但培養3~5 d時可被TM自建數據庫正確鑒定,而培養第7~9天均無法經TM自建數據庫正確鑒定。不同溫度和前處理方法對鑒定結果均無差異。見表3。

表3 VITEK MS RUO模式TM自建數據庫在不典型TM鑒定中的應用
3 討 論
近年來,隨著免疫抑制人群數量的增加,TM感染發病率也隨之上升。目前臨床微生物實驗室對TM的鑒定,主要依賴其溫度雙相的菌落特征(35 ℃培養為酵母樣,28 ℃培養為霉菌樣)及典型紅色素來判斷,但形態學鑒定主要依賴于檢驗人員的經驗。分子生物學鑒定則需要獲取足夠數量的菌體。對于生長緩慢的菌落,其鑒定耗時長。這限制了TM感染的早期診斷和及時治療。同時,形態不典型菌株的出現,向微生物實驗室對TM的快速準確鑒定提出挑戰。
MALDI-TOF MS是微生物鑒定領域的一項極具前景的新技術,有成本低、耗時短、準確、高效等優點,可實現菌株的快速鑒定,目前在國內檢驗科被廣泛推廣。但國內外常用的Bruke Biotyper及VITEK MS系統均無TM鑒定參考庫,且適合用于TM質譜鑒定的菌落培養條件及前處理方案鮮有報道。
質譜鑒定的準確性受許多因素影響,如培養基種類、培養條件、培養時間、蛋白提取方法等[7]。本研究比較了兩種溫度(28、35 ℃)、兩種培養基(SDA、SDB)培養3~9 d的質譜鑒定正確率。其中從SDB 35 ℃培養菌落采集的質譜譜圖數量少,干擾峰較多且特征峰信號強度不明顯,考慮為液體培養基搖菌時菌量不足及洗滌不充分所致。因此,操作時應盡可能將菌落沉淀洗滌干凈。另外,從28 ℃ SDA及SDB中培養菌落采集到的質譜譜圖無明顯差異。液體培養基培養操作較復雜,培養液等營養成分會干擾質譜分析,且菌落培養耗時更長,因此固體培養基更適合臨床微生物室的快速鑒定。LAU等[8]發現,補充構建數據庫后,MALDI-TOF MS能準確鑒定TM,其菌絲相和酵母相質譜譜圖類似。本研究發現TM菌絲相及酵母相的特征峰相似,且與文獻報道的主峰一致,但在35 ℃培養時鑒定正確率略高。
不同真菌培養時間下質譜譜圖的特征峰數量和強度存在明顯差異[9-11]。本研究發現,TM培養3~5 d時進行質譜鑒定的正確率高,且第5天最佳,可達100.0%。這主要與此時質譜譜圖質量佳、信噪比高及鑒定結果穩定有關。隨著培養時間的延長,特征峰信號強度減弱,甚至消失,從而出現錯誤鑒定或無鑒定結果,這可能與真菌細胞壁較厚且堅韌難破壁、色素產生干擾等有關。
TM于28 ℃時呈菌絲相,35 ℃呈酵母相生長。法國梅里埃公司推薦對絲狀真菌采取甲酸乙腈法,對酵母菌采用直涂法進行前處理。直涂法用于酵母菌鑒定效果好,且適用于多種商業化MALDI-TOF MS系統[12-15]。而甲酸乙腈法是利用甲酸及乙腈對菌體進行蛋白提取來獲得高質量質譜譜圖,不僅適用于酵母菌鑒定[16],也適用于曲霉、皮膚癬菌等絲狀真菌鑒定[17-20]。本研究比較兩種前處理方法對TM酵母相菌落的鑒定發現,對培養3~5 d的菌落,甲酸乙腈法的鑒定正確率略優于直涂法(100.0%、100.0%vs.71.4%、85.7%)。這與甲酸乙腈法蛋白提取更充分有關。
綜上所述,本研究發現經SDA培養3~5 d的酵母相(35 ℃)菌落,經甲酸乙腈法處理后,可獲得良好的質譜譜圖,鑒定正確率高。此條件也同樣適用于形態不典型的TM,為TM的快速、準確鑒定提供了輔助手段。但本研究僅納入8株TM的質譜譜圖,還需要更多菌株進一步完善數據庫并驗證。MALDI-TOF MS提高了真菌鑒定的準確性,但在鑒定中仍需努力解決如生物安全問題、少見菌株數據庫問題及樣本處理標準化等問題。

