流式細胞術檢測HLA-B27兩種試劑比較與結果分析*
陳永強,鄭 璐,張 玥,王杜平,程 星,陳艷紅,周忠海,牛國平▲
1.徐州市中心醫院檢驗科,江蘇徐州 221009;2.徐州醫科大學附屬淮海醫院實驗科,江蘇徐州 221004
強直性脊柱炎(AS)是一類以脊柱和骶髂關節慢性進行性炎癥為主要特征的自身免疫性疾病,發病機制主要與遺傳、免疫反應和微生物感染等有關[1]。目前研究證實,人類白細胞抗原B27(HLA-B27)與AS發病具有很強的相關性,其陽性率在AS患者中高達90%,而在健康人群中陽性率僅為2%~7%[2]。有研究報道,HLA-B27介導TNAP磷酸酶活化促進AS中軟骨組織的生成[3]。目前,HLA-B27已成為臨床上輔助診斷AS的重要檢測指標。在HLA-B27的檢測方法中,流式細胞術因其具有檢測速度快、靈敏度和特異度高等優點在臨床上被廣泛應用[4]。本研究主要比較美國貝克曼庫爾特公司生產的HLA-B27-FITC/HLA-B7-PE檢測試劑盒和美國BD公司生產的HLA-B27-FITC/CD3-PE檢測試劑盒在臨床HLA-B27檢測過程中影響結果準確性的關鍵因素與異常結果分析,期望為臨床提供可靠的檢測報告。
1 資料與方法
1.1一般資料 收集來自徐州市中心醫院2019年8月至2020年7月門診及住院的1 208例臨床初診為腰椎病、頸椎病、關節痛、脊柱僵硬和AS患者的外周血標本,采用肝素抗凝管抽取5 mL,所有標本均于當天應用流式細胞術完成HLA-B27的檢測。
1.2儀器與試劑 CytoFLEX流式細胞儀為美國貝克曼庫爾特公司生產,FACS Calibur流式細胞儀為美國BD公司生產。HLA-B27-FITC/CD3-PE試劑盒(貨號:340183)和溶血素(貨號:349202)為美國BD公司生產;HLA-B27-FITC/HLA-B7-PE試劑盒(貨號:A07739)和溶血素(貨號:A11895)為美國貝克曼庫爾特公司生產。
1.3方法
1.3.1HLA-B27-FITC/HLA-B7-PE檢測試劑盒檢測方法 向編號的檢測管中依次加入10 μL檢測抗體和50 μL肝素抗凝外周血,振蕩混勻后置于室溫避光處孵育20 min,然后每管加入0.5 mL貨號為A11895溶血素,混勻避光孵育15 min,加入0.5 mL磷酸鹽緩沖液,避光孵育平衡5 min,每管加2 mL磷酸鹽緩沖液,1 600 r/min離心5 min,棄掉上清液,每管加0.5 mL磷酸鹽緩沖液,振蕩混勻后采用CytoFLEX流式細胞儀上機檢測分析。
1.3.2HLA-B27-FITC/CD3-PE檢測試劑盒檢測方法 向編號的檢測管中依次加入10 μL檢測抗體和50 μL肝素抗凝外周血,振蕩混勻后置于室溫避光處孵育20 min,隨后加入1 mL貨號為349202的溶血素,渦旋振蕩混勻后避光5 min,每管加入1 mL磷酸鹽緩沖液混勻后1 600 r/min離心5 min,棄上清液,再用2 mL磷酸鹽緩沖液洗滌1次后,加入0.5 mL磷酸鹽緩沖液,振蕩混勻后采用FACS Calibur流式細胞儀檢測分析。
2 結 果
2.1兩種試劑盒檢測原理 美國貝克曼庫爾特公司生產的HLA-B27-FITC/HLA-B7-PE檢測試劑盒主要通過FSC和SSC雙參數圖圈定淋巴細胞亞群設門,然后分析淋巴細胞中 HLA-B7-HLA-B27+細胞群的百分比,比例≥90%判讀為陽性,見圖1;美國BD公司生產的HLA-B27-FITC/CD3-PE試劑盒首先通過FSC和SSC雙參數圖圈定淋巴細胞亞群設門,然后分析淋巴細胞群中CD3+淋巴細胞中HLA-B27的平均熒光強度,通過試劑盒自設平均熒光強度(MFI)臨界值≥145判讀為陽性(不同試劑批號MFI值略有差異),見圖2。
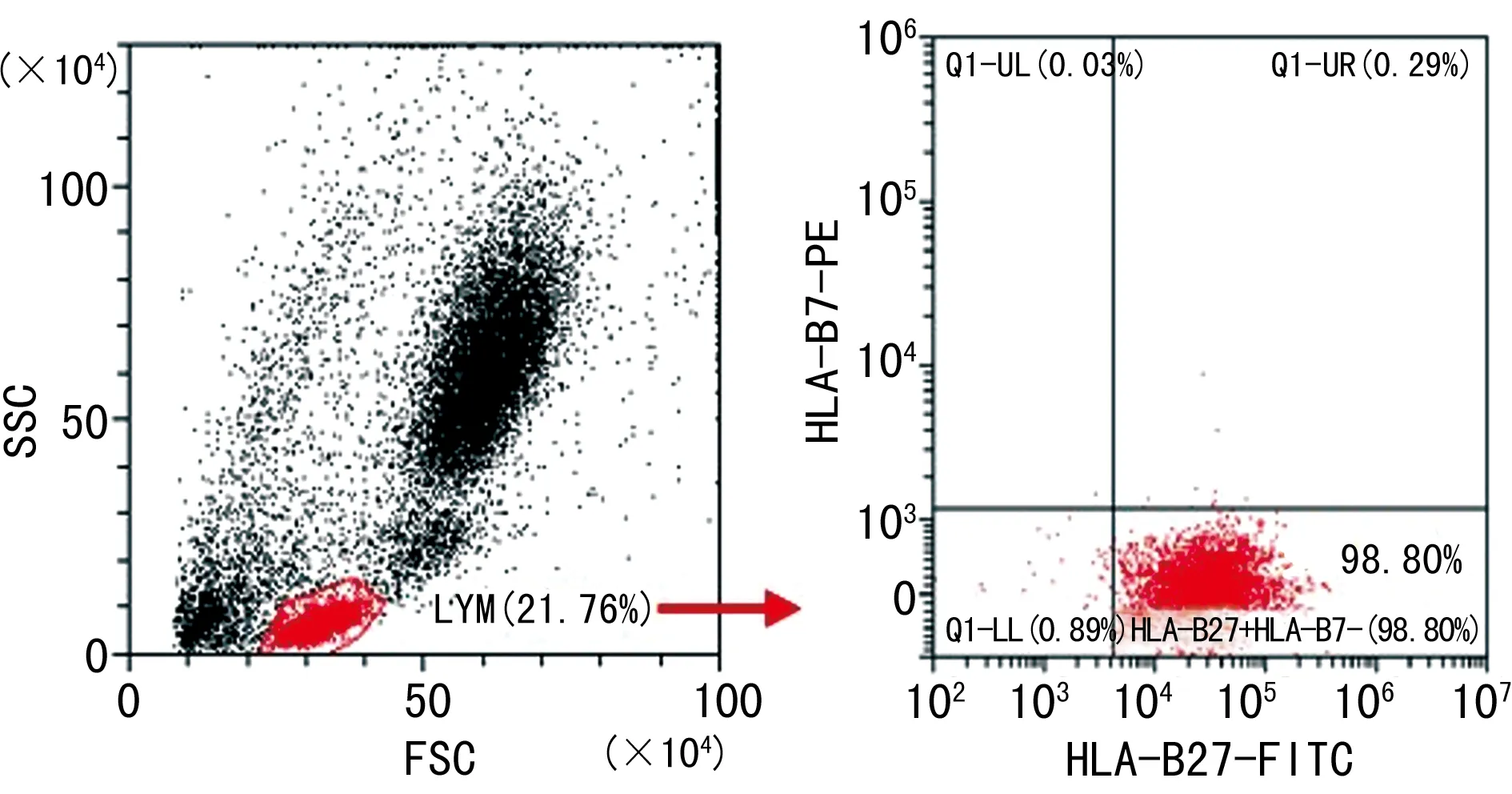
注:A為利用FSC和SSC雙參數顯示的免疫細胞散點圖,B為對A圖中圈定的淋巴細胞分析HLA-B7和HLA-B27表達水平散點圖。
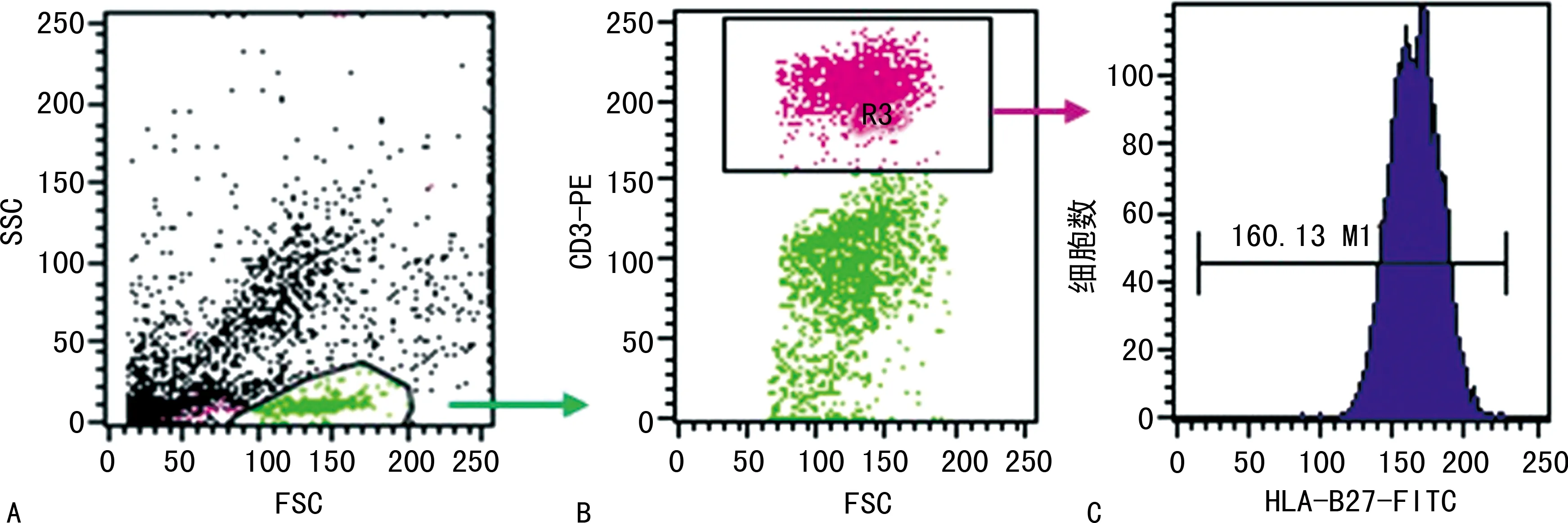
注:A為利用FSC和SSC雙參數顯示的免疫細胞散點圖,B為對A圖中圈定的淋巴細胞進一步分析CD3+淋巴細胞散點圖,C為對B圖中圈定的CD3+淋巴細胞分析HLA-B7的表達強度峰形圖。
2.2淋巴細胞亞群分群不清晰對兩種試劑盒檢測結果的影響 結果發現,淋巴細胞亞群分群不清晰會導致HLA-B27-FITC/HLA-B7-PE檢測試劑盒將HLA-B7-HLA-B27+細胞群≥90%的陽性結果判讀為陰性結果(<90%),見圖3;而HLA-B27-FITC/CD3-PE檢測試劑盒利用FSC和SSC雙參數圖圈定淋巴細胞亞群,同時繼續采用CD3-PE抗體進一步圈定表達CD3+淋巴細胞,可以避免淋巴細胞亞群分群不清晰導致的假陰性。
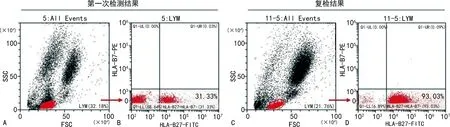
注:A、B為初次檢測中淋巴細胞分群不清晰HLA-B27的檢測結果,A為利用FSC和SSC雙參數顯示的免疫細胞散點圖,其中淋巴細胞群分群質量較差,B為對A圖中圈定的淋巴細胞分析HLA-B7和HLA-B27表達水平散點圖;C、D為復檢中淋巴細胞分群清晰HLA-B27的檢測結果,C為利用FSC和SSC雙參數顯示的免疫細胞散點圖,其中淋巴細胞分群質量較好,D為對C圖中圈定的淋巴細胞分析HLA-B7和HLA-B27表達水平散點圖。
2.3HLA-B27-FITC/HLA-B7-PE試劑盒檢測HLA-B27異常結果統計與結果分析 采用HLA-B27-FITC/HLA-B7-PE試劑盒檢測1 208份標本結果發現,除了標準的陰性標本和陽性標本之外,還存在兩種異常的標本類型,異常標本1為淋巴細胞表達HLA-B7且細胞群主要分布于第一和第二象限之間;異常標本2為淋巴細胞表達HLA-B7且細胞群分布于第二象限或第二和第四象限之間,見圖4。統計結果顯示,陰性標本887份,占73.43%;陽性標本225份,占18.63%;而異常標本1共有84份,占6.95%;異常標本2共有12份,占0.99%。
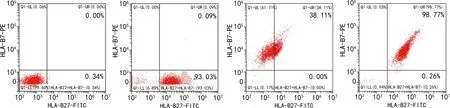
注:從左往右依次為陰性標本、陽性標本、異常標本1、異常標本2。
隨后,筆者對上述兩種類型的異常標本采用美國BD公司生產的HLA-B27-FITC/CD3-PE檢測試劑盒進行復測,結果顯示,HLA-B27-FITC/HLA-B7-PE試劑盒檢測的陰性和陽性標本與HLA-B27-FITC/CD3-PE試劑盒的檢測結果一致;而異常標本1的MFI值介于陰性和陽性標本的數值之間,仍然判讀為陰性標本;然而,12份異常標本2的MFI值均高于陽性臨界值145,判讀為陽性標本,見圖5和表1。
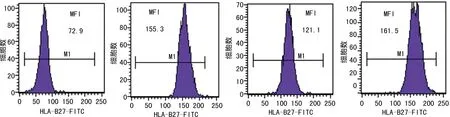
注:從左往右依次為陰性標本、陽性標本、異常標本1、異常標本2。
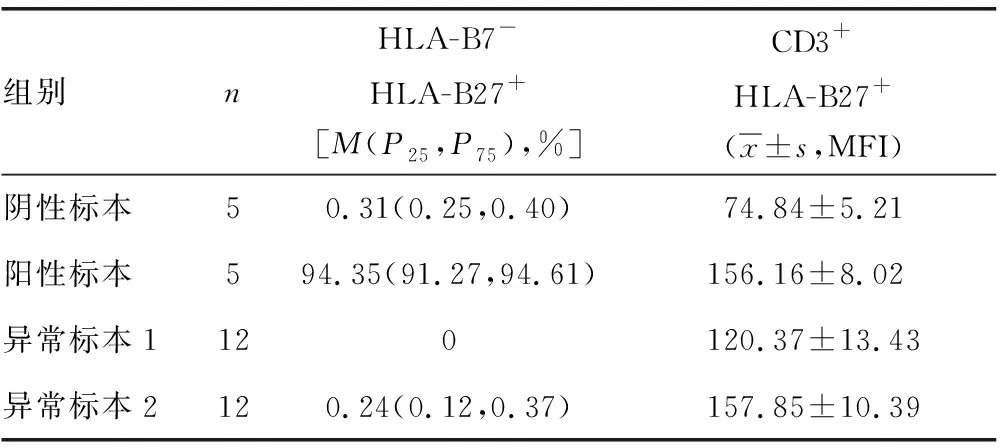
表1 兩種試劑盒檢測HLA-B27結果比較
2.4HLA-B27檢測結果與臨床診斷之間的關系 對1 208份臨床標本檢測結果與臨床診斷之間的關系分析結果顯示,887份HLA-B27陰性標本中有32份臨床診斷為AS患者,占3.16%;225份HLA-B7-HLA-B27+淋巴細胞比例≥90%的陽性標本中有52份臨床診斷為AS患者,占23.11%;84份異常標本1中有1份臨床診斷為AS患者,占1.19%;而12份異常標本2中有3份臨床診斷為AS患者,占25.00%,見表2。異常標本1臨床檢測結果可判讀為陰性,而異常標本2存在較高比例的AS患者。
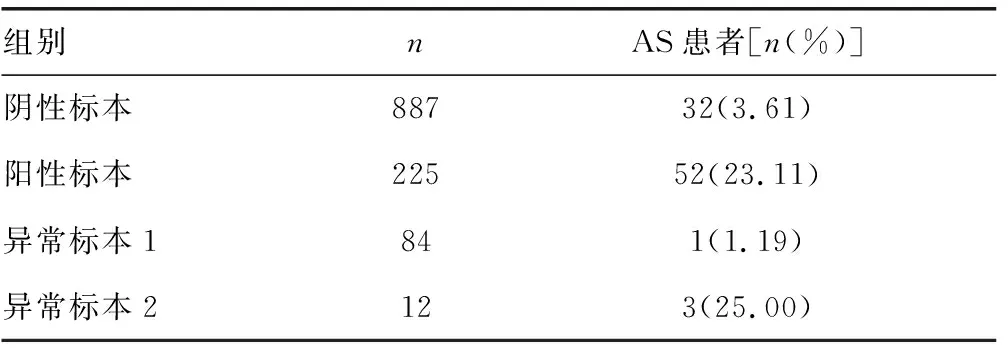
表2 各組標本中臨床診斷為AS患者所占比例
3 討 論
流式細胞術因為具有快速、靈敏度高和特異度高等特點已成為臨床常用檢測HLA-B27表達的方法,但是該方法也存在一定的不足之處[5]。有文獻報道,HLA-B27 的單克隆抗體會與其他 HLA-B 等位基因編碼的抗原發生不同程度的交叉反應,其中以 HLA-B7抗原的交叉反應最常見[6-7]。因此,采用HLA-B27-FITC/CD3-PE兩種抗體組合的試劑檢測分析CD3+淋巴細胞表達HLA-B27時,對同時表達HLA-B7抗原的標本,HLA-B27單克隆抗體會與HLA-B7抗原發生交叉反應導致一定比例的標本檢測結果呈假陽性;當采用HLA-B27-FITC/HLA-B7-PE雙抗體組合的試劑檢測分析淋巴細胞群中HLA-B7-HLA-B27+細胞的比例時,可以排除因HLA-B27抗體與HLA-B7抗原交叉反應引起的假陽性。
在HLA-B27檢測過程中,經常遇到一些可能由于溶血效果不好或細胞碎片等因素導致上機檢測時淋巴細胞群分群不清晰的標本,本研究結果發現,HLA-B27-FITC/HLA-B7-PE試劑盒檢測HLA-B27的方法會導致部分淋巴細胞群分群不清晰的陽性標本被誤判為陰性標本,因此該檢測方法對淋巴細胞群分群有較高的要求,對檢測過程中遇到分群不清晰的標本一定要進行復檢,而HLA-B27-FITC/CD3-PE試劑盒利用CD3-PE抗體進一步圈定表達CD3+淋巴細胞,可以避免淋巴細胞群分群不清晰導致的假陽性。HLA-B27-FITC/CD3-PE試劑盒檢測方法容易將HLA-B7表達的標本誤判為假陽性標本,而HLA-B27-FITC/HLA-B7-PE試劑盒可以將此類標本區分出來,但對于淋巴細胞同時表達HLA-B27抗原與HLA-B7抗原的標本檢測結果仍無法準確判斷,這類標本結果的判讀只能結合病歷資料或與臨床醫生溝通進行判斷。為了能對本研究中異常標本2結果進行準確判斷,后期筆者將收集該類標本并采用引物特異性聚合酶鏈反應(SSP-PCR)對HLA-B7和HLA-B27的表達情況進行檢測[8],然后結合臨床診斷進一步分析,為今后提高臨床AS患者的診斷率和結果的可靠性提供依據。
綜上所述,兩種HLA-B27試劑盒檢測結果均準確可靠;HLA-B27-FITC/HLA-B7-PE試劑盒能區分出HLA-B7/HLA-B27雙陽性的疑似AS患者,但檢測過程對淋巴細胞亞群分群要求較高;而HLA-B27-FITC/CD3-PE試劑盒利用CD3設門可以避免淋巴細胞亞群分群不清導致的假陰性結果的出現,但不能區分HLA-B7/HLA-B27雙陽性標本且在結果判讀中存在一定比例的假陽性。

