Gab1在胃癌組織中表達分析及通過PI3K/AKT通路調控轉移的機制研究
李拓鍵
陸軍軍醫大學第一附屬醫院健康管理中心,重慶 400038
一項全球性的調查研究顯示,2020年胃癌的新發病患者共約103萬例,占所有惡性腫瘤的5.7%,死于胃癌的患者共約78萬例,占8.2%[1]。我國胃癌發病率較高,雖然新的靶向療法、免疫療法、個性化治療等策略不斷被應用于臨床,但是胃癌的復發率和病死率仍然較高,探究胃癌發生和發展的機制是尋找新的診斷和治療靶點的重要手段[2]。Grb2相關結合蛋白1(Gab1)是細胞的骨架蛋白,參與細胞形態的維持,并且在口腔鱗狀細胞癌、肝細胞癌等疾病中具有促癌作用[3-4]。PI3K/AKT通路的激活是促進胃癌轉移的重要信號通路,并且與胃癌的復發有關[5]。近年來研究發現,Gab1也可以作為信號通路中的“放大器”,通過激活通路促進腫瘤細胞的生長并抑制其凋亡,FAN等[6]的研究顯示,Gab1可能通過激活PI3K/AKT通路抑制軟骨肉瘤細胞凋亡。然而,關于Gab1在胃癌中的表達特點及對胃癌細胞生物學行為的影響尚不清楚。本文主要分析Gab1在胃癌中的臨床意義,并分析Gab1通過PI3K/AKT通路調控轉移的機制,為臨床更好地治療胃癌提供新思路。現報道如下。
1 材料與方法
1.1材料來源 收集2015年3月至2018年3月在陸軍軍醫大學第一附屬醫院進行胃癌切除術新鮮胃癌組織及癌旁正常組織(距離腫瘤組織距離>5 cm)標本各70份。納入標準:(1)經過術后病理學檢測確診為胃腺癌;(2)入組前未經過化療、放療、靶向治療;(3)知情同意。排除標準:(1)合并其他惡性腫瘤;(2)合并其他嚴重基礎疾病。本研究經過陸軍軍醫大學第一附屬醫院倫理委員會批準。
1.2儀器與試劑 人胃腺癌細胞系AGS細胞來自美國典型培養物保藏中心。DMEM培養基、胎牛血清、L-谷氨酰胺、青霉素和鏈霉素來自美國Thermo Fisher公司。PI3K/AKT抑制劑LY294002購自中國Selleck公司。pCMV6-entry-Gab1重組質粒及相應的陰性對照質粒購自美國OriGene公司。Lipofectamine 2000試劑來自美國Thermo Fisher公司。細胞計數試劑盒-8(CCK-8)來自中國Beyotime生物技術研究所。Transwell小室及配套試劑來自美國BD Biosciences公司。PCR引物由中國Genewiz公司設計和合成。Trizol試劑來自美國Invitrogen公司。反轉錄cDNA試劑盒和SYBR Green PCR Master Mix qPCR試劑盒來自瑞士Roche公司。ABI 7500 PCR檢測系統來自美國Life technology公司。RIPA裂解緩沖液來自中國Beyotime公司。BCA蛋白測定試劑盒和ECL試劑盒來自中國Applygen公司。Gab1免疫組化染色試劑盒購自美國Abcam公司。Gab1、GAPDH抗體和二抗來自美國Abcam公司。PVDF膜來自美國Bio-Rad公司。
1.3方法
1.3.1免疫組織化學實驗檢測胃癌組織和癌旁組織中Gab1表達情況 將標本組織經過梯度乙醇脫水、透明處理后包埋至蠟塊中,冷凍后切成4 μm厚切片。將組織脫蠟并再水化。使用3%的過氧化氫甲醇溶液封閉內源性過氧化物酶活性。使用蒸鍋在95 ℃下于0.01 mol/L檸檬酸鹽緩沖液(pH=6.0)中對切片進行熱誘導的抗原回收。在切片標本中加入Gab1一抗(1∶50稀釋)并在室溫下孵育45 min,加入生物素標記的IgG抗體(1∶50稀釋)孵育30 min。滴加DAB顯色5~6 min后加入蘇木紫染色20 min。脫水透明化處理、封片。使用顯微鏡觀察染色結果。通過半定量法評估:顏色深淺為0~3分,染色范圍為0~4分,二者相乘之積作為染色強度。并根據染色強度評分的中位數,將胃癌組織分為Gab1低表達和高表達。
1.3.2細胞培養及Gab1干擾AGS細胞的建立 為與臨床標本對應,選擇胃腺癌細胞進行研究。AGS細胞在含有10%胎牛血清、2 mmol/L-谷氨酰胺、1%青霉素(100單位/毫升)和鏈霉素(100 μg/mL)的DMEM培養基中培養。37 ℃,5% CO2,相對濕度100%。細胞分為空白組、對照組、Gab1組和Gab1+LY294002組。Gab1組和Gab1+LY294002組使用Lipofectamine 2000試劑盒進行瞬時轉染,將pCMV6-entry-Gab1重組質粒轉染進入AGS細胞中,轉染48 h后收集細胞并通過qPCR和Western blot檢測轉染效率。對照組轉染等量的陰性對照質粒。空白組不進行轉染。Gab1+LY294002組細胞培養基中加入PI3K/AKT抑制劑LY294002抑制PI3K/AKT通路,LY294002的濃度為5 μmol/L。
1.3.3qPCR檢測各組細胞中Gab1 mRNA相對表達水平 通過Trizol獲得細胞中總RNA,然后檢測RNA的純度和濃度。使用cDNA試劑盒將1 μg RNA反轉錄合成cDNA(42 ℃ 60 min,70 ℃ 5 min,4 ℃保存)。使用SYBR Green PCR Master Mix進行qPCR試驗(在95 ℃ 10 min,40個循環,94 ℃ 15 s,60 ℃ 1 min, 60 ℃ 1 min,4 ℃保存)。GAPDH作為內參,通過比較循環閾值(ΔΔCt)用于分析Gab1 mRNA相對表達水平。Gab1上游引物:5′-GGT GGT GAA GTG GTC TGC TC-3′;下游引物:5′-TCG GGC TTC TTG CTT TGA CA-3′。GAPDH上游引物:5′-CAA GGT CAT CCA TGA CAA CTT TG-3′;下游引物:5′-GTC CAC CAC CCT GTT GCT GTA G-3′。
1.3.4Western blot檢測各組細胞中Gab1蛋白表達水平和AKT蛋白磷酸化水平 在液氮下將細胞研磨并使用RIPA裂解緩沖液裂解,使用BCA蛋白測定試劑盒測量總蛋白水平。使用SDS-PAGE分離等量的總蛋白(120 V下電泳90 min),隨后將蛋白轉移到PVDF膜上(50 V,120 min),在含有5%脫脂牛奶的封閉溶液中封閉。將PDVF膜與Gab1抗體(1∶500稀釋)在4 ℃孵育過夜,然后加入1∶5 000稀釋的HRP偶聯二抗在室溫下孵育1 h。使用ECL試劑盒可視化蛋白條帶,并在ImagePD軟件中使用GAPDH作為內參對蛋白條帶的灰度進行定量。
1.3.5CCK-8法檢測細胞活力 將2×104個細胞接種在96孔板(每孔100 μL),在培養第24、48和72 h加入10 μL CCK-8試劑并在37 ℃下培養2 h,通過酶標儀檢測450 nm處的吸光度(A)值。
1.3.6細胞劃痕實驗檢測細胞遷移能力 將各組細胞消化后分別接種在6孔板中,每孔1×106個細胞,然后在37 ℃,5% CO2,相對濕度100%條件下培養直至90%匯合。使用200 μL的移液槍頭從上至下輕輕劃傷細胞,將劃掉的細胞洗去。在相同條件下繼續培養24 h。在顯微鏡下測量細胞劃痕距離的百分比(兩端前緣距離/初始劃痕寬度×100%)。
1.3.7Transwell實驗檢測細胞侵襲能力 將完全培養基加入到Transwell小室的下室,將基質膠加入到上室。將3×104個細胞加入至上室培養。培養24 h后洗去未侵入下室的細胞。將細胞使用20%甲醇固定,并用0.2%結晶紫染色。在倒置顯微鏡下計數每個視野侵入下室的細胞數目。
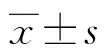
2 結 果
2.1Gab1在胃癌中的表達水平及與臨床病理參數的關系 Gab1在癌旁組織中表達水平較低,染色強度為(1.38±0.26),但是在胃癌組織中的表達水平較高,染色強度為(5.07±0.82),并且Gab1定位于細胞質,見圖1。存在淋巴轉移、存在遠端轉移、T3+T4浸潤深度、Ⅲ~Ⅳ期患者較無淋巴轉移、無遠端轉移、T1+T2浸潤深度、Ⅰ~Ⅱ期患者Gab1高表達水平所占比例更高(P<0.05),見表1。
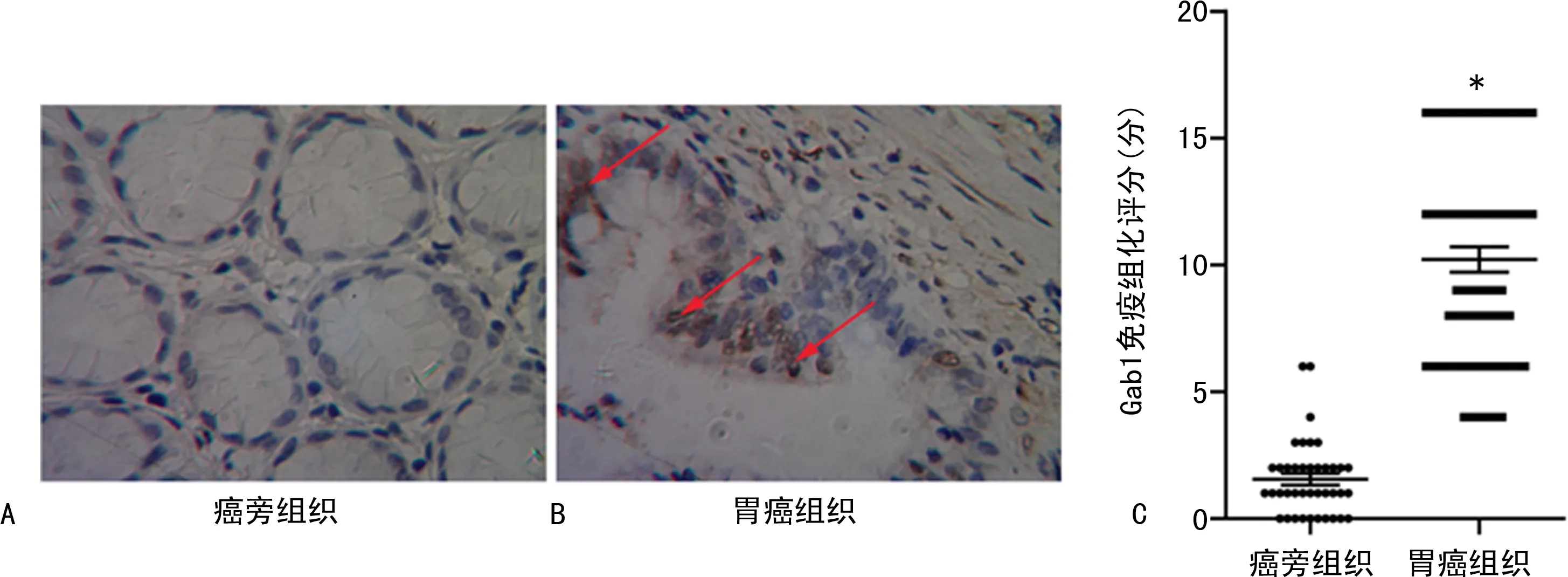
注:A、B為免疫組織化學染色檢測癌旁組織和胃癌組織中Gab1的表達,C為癌旁組織和胃癌組織中Gab1免疫組化染色評分比較;與癌旁組織比較,*P<0.05。
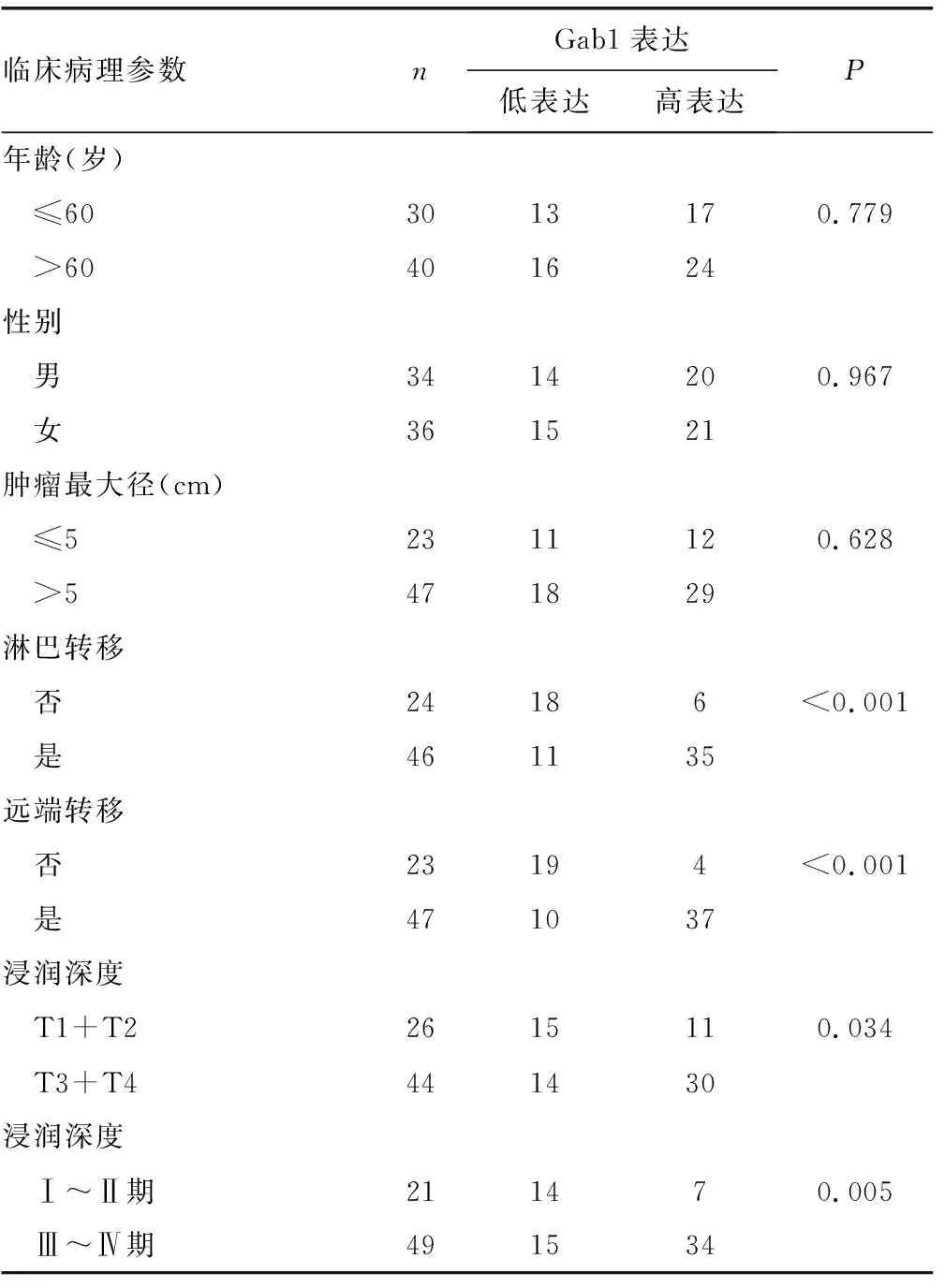
表1 胃癌患者Gab1表達水平與臨床病理參數的關系(n)
2.2各組細胞中Gab1 mRNA相對表達水平和蛋白表達水平比較 Gab1組和Gab1+LY294002組細胞中Gab1 mRNA相對表達水平和蛋白表達水平均明顯高于空白組和對照組(P<0.05),且LY294002對Gab1 mRNA相對表達水平和蛋白表達水平影響不明顯,見圖2。
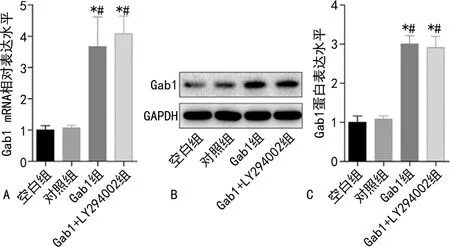
注:A為各組細胞中Gab1 mRNA相對表達水平比較;B為Western blot檢測各組中Gab1蛋白表達水平;C為各組細胞中Gab1蛋白表達水平比較;與對照組比較,*P<0.05;與空白組比較,#P<0.05。
2.3各組細胞活力比較 在培養72 h后,Gab1組的A值(0.82±0.06)明顯較對照組、空白組和Gab1+LY294002組升高(P<0.05)。LY294002會阻斷Gab1對細胞活力的促進作用,見圖3。
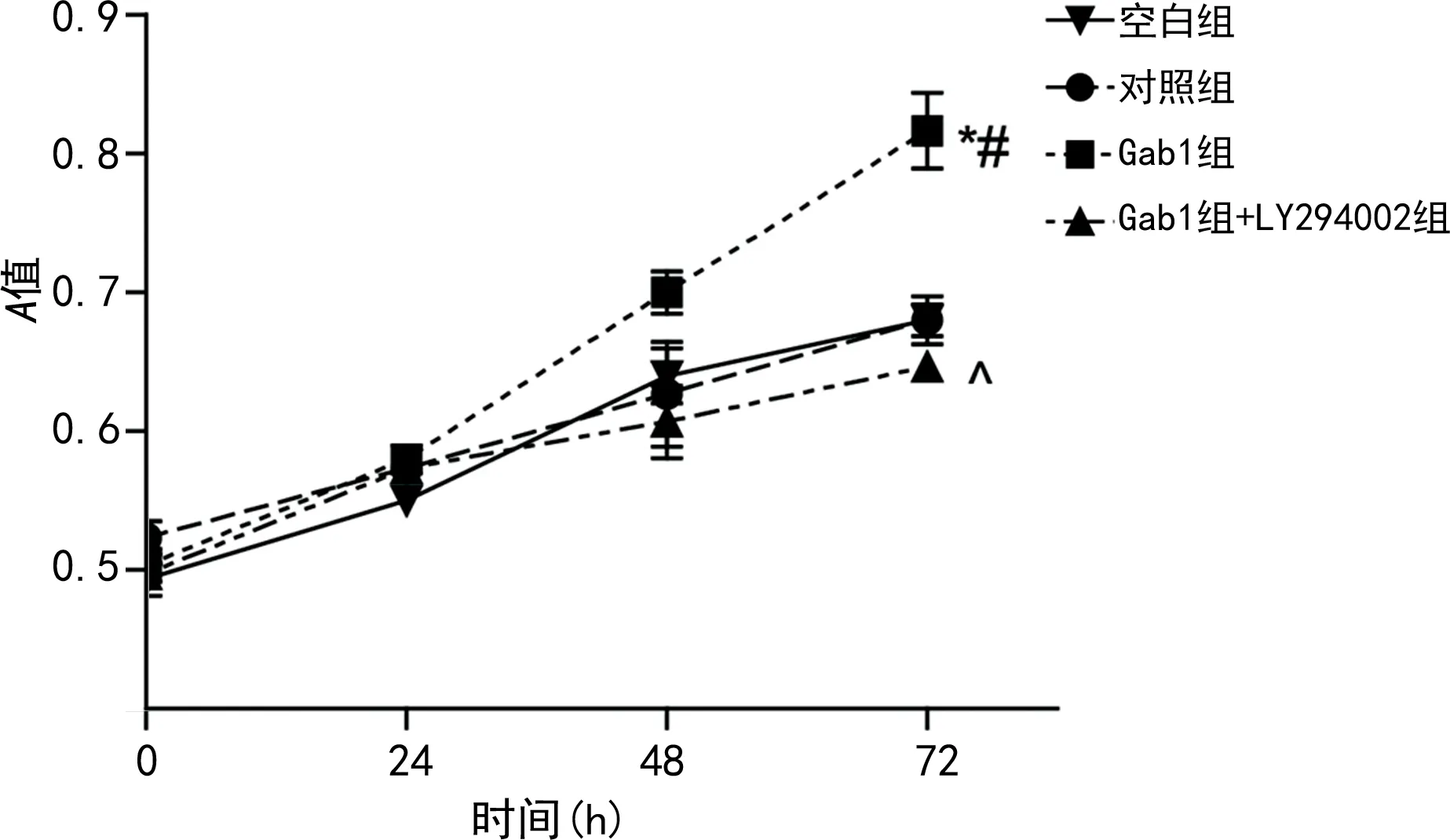
注:與對照組比較,*P<0.05;與空白組比較,#P<0.05;與Gab1組比較,^P<0.05。
2.4各組細胞遷移和侵襲能力比較 培養24 h后,對照組的劃痕寬度為0 h時寬度的(50.37%±0.12%),Gab1+LY294002組為(49.24%±0.13%),與空白組比較差異均無統計學意義(P>0.05)。Gab1組的細胞劃痕距離百分比為0 h時的(26.17%±0.09%),明顯低于空白組、對照組、Gab1+LY294002組(P<0.05)。見圖4。Gab1組侵襲細胞數目明顯高于空白組、對照組、Gab1+LY294002組(P<0.05)。見圖5。
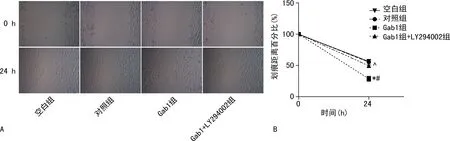
注:A為細胞劃痕實驗檢測各組細胞的遷移能力;B為各組細胞遷移能力比較;與對照組比較,*P<0.05;與空白組比較,#P<0.05;與Gab1組比較,^P<0.05。

注:A為Transwell實驗檢測各組細胞的侵襲能力;B為各組細胞的侵襲能力比較;與對照組比較,*P<0.05;與空白組比較,#P<0.05;與Gab1組比較,^P<0.05。
2.5各組細胞AKT蛋白磷酸化水平比較 Gab1組AKT蛋白磷酸化水平明顯高于空白組、對照組和Gab1+LY294002組(P<0.05),見圖6。

注:p-AKT為磷酸化AKT蛋白;A為Western blot檢測各組細胞中AKT和p-AKT蛋白水平;B為各組細胞中p-AKT/AKT蛋白相對表達水平比較;與對照組比較,*P<0.05;與空白組比較,#P<0.05;與Gab1+LY294002組組比較,^P<0.05。
3 討 論
胃癌是最常見的癌癥之一,在中國、日本、韓國等亞洲地區尤為普遍[7]。雖然最近十年胃癌發病率得到一定的控制,但是胃癌的病死率仍居高不下。手術是治療胃癌的最主要方法,但是大多數胃癌患者在確診時已經處于晚期或者出現轉移,晚期胃癌患者的5年生存率不足20%[8]。腫瘤細胞無限增殖,強大的侵襲和轉移能力是導致胃癌患者生存率低的主要原因之一,因此,探索胃癌轉移過程中涉及的機制對發現胃癌診斷和治療的潛在靶點至關重要。
Gab1屬于Gab銜接子家族,參與信號的傳導,研究已經發現Grb2在胃癌進展中發揮重要作用,Grb2-DENND1A復合物會被表皮細胞生長因子激活,從而誘導胃癌細胞遷移[9],且Grb2通過調節下游的通路參與胃癌的發生[10]。Gab1蛋白是與Grb2結合的蛋白,但是關于Gab1在胃癌中的表達特點和對胃癌細胞的調控作用尚不清楚。過往研究顯示,在橫紋肌肉瘤和滑膜肉瘤中Gab1的表達水平明顯升高,且高臨床分期(Ⅲ和Ⅳ期)的腫瘤中Gab1陽性率明顯高于低臨床分期(Ⅰ和Ⅱ期)的腫瘤,提示在肉瘤中Gab1與不良的預后有關[11]。Kaplan-Meier生存分析和Cox風險分析結果顯示,Gab1高表達的卵巢癌患者術后具有更低的生存率,Gab1的高表達與卵巢癌FIGO晚期和淋巴結轉移呈正相關,可作為預測預后的獨立指標[12]。此外,Gab1也可作為臨床預測膠質瘤預后的指標[13]。在本研究結果中,通過免疫組織化學染色發現Gab1在癌旁組織中表達水平較低,而胃癌組織中Gab1在細胞質中廣泛表達,并且進一步的研究結果顯示,在更高的臨床分期、更深的浸潤深度及存在遠端轉移和淋巴轉移患者中Gab1高表達水平患者所占比例更高,這提示在胃癌中Gab1可能參與腫瘤的發生和轉移,并且可能成為預測胃癌患者預后的標志物,但是關于Gab1與胃癌患者預后的關系還需要擴大樣本量進行長期的隨訪研究。
Gab1通過與Grb2蛋白結合參與信號的傳導,Gab蛋白與Grb2結合后,會募集PI3K/AKT等蛋白,PI3K/AKT會通過Gab1中的磷酸酪氨酸基序與Gab1相互作用,從而參與調控細胞內信號通路的傳導[14-15]。而PI3K/AKT是胃癌發生和發展中的重要通路,研究顯示PI3K/AKT通路的激活會促進一些原癌基因的表達,從而誘導細胞過度增殖并且具有高轉移性[16]。因此本研究進一步分析了過表達Gab1對胃癌細胞的遷移和侵襲的影響,以及Gab1是否通過PI3K/AKT通路發揮促癌作用。本研究通過轉染 pCMV6-entry-Gab1重組質粒以過表達Gab1,通過qPCR和Western blot驗證了轉染后Gab1 mRNA相對表達水平和蛋白表達水平明顯升高。進一步的細胞生物學實驗結果也顯示,Gab1過表達時,胃癌AGS細胞的細胞活力、遷移和侵襲能力明顯升高,而PI3K/AKT抑制劑LY294002會阻斷Gab1對胃癌細胞生長和轉移的促進作用。既往有研究發現,提高Gab1的表達水平會促進乳腺癌細胞的轉移能力[17]。也有體外研究顯示,抑制Gab1表達水平具有抑制肺癌細胞增殖和侵襲的作用[18]。本研究結果還顯示,過表達Gab1后會促進PI3K蛋白下游蛋白AKT的磷酸化,并且使用LY294002抑制PI3K/AKT后會阻斷Gab1對AKT磷酸化的促進作用。ZHANG等[19]研究顯示,Gab1會通過影響PI3K/AKT通路抑制bFGF誘導的生物學活性。本研究結果顯示,在胃癌細胞AGS中表達上調的Gab1可能通過激活PI3K/AKT通路促進細胞遷移和侵襲。但是關于Gab1通過PI3K/AKT通路調節胃癌細胞遷移和侵襲的機制仍需要進一步的體內試驗驗證。
綜上所述,Gab1在胃癌組織中高表達,且高表達水平的Gab1與胃癌的惡性表型有關。上調的Gab1表達會通過激活PI3K/AKT通路促進胃癌細胞的細胞遷移和侵襲。這提示Gab1可能成為診斷和治療胃癌的新靶點,關于Gab1調控胃癌轉移的機制值得進一步研究。

