格林-巴利綜合征患者蛋白質及血脂代謝指標分析
王利娟,楊鑫蕊,劉 杰,李斯文,周 金,張國軍△
1.首都醫科大學附屬北京天壇醫院檢驗科/北京市免疫試劑臨床工程技術研究中心/體外診斷試劑質量控制重點實驗室,北京 100070;2.首都醫科大學臨床檢驗診斷學系,北京 100069
格林-巴利綜合征(GBS)又稱急性炎癥性脫髓鞘性多發性神經病,是一種周圍神經自身免疫性脫髓鞘疾病,其臨床表現多樣,主要引起運動和感覺障礙,患者表現為急性或亞急性發病,部分可完全恢復,少數病情嚴重者可引起致死性呼吸麻痹和雙側面癱。GBS患者具體發病原因尚未完全明確,目前認為是一種自身免疫性疾病,由于病原體(病毒、細菌)的某些組分與周圍神經髓鞘的某些組分相似,機體免疫系統發生了錯誤識別,產生自身免疫性T細胞和自身抗體,并針對周圍神經組分發生免疫應答,引起周圍神經脫髓鞘[1]。GBS主要病理改變為周圍神經系統的廣泛性炎性脫髓鞘和(或)軸索損傷。神經系統中脂質以膜的形式大量存在于髓鞘當中,因此,脂質代謝與神經系統結構和功能密切相關[2]。目前,關于GBS患者相關血脂代謝指標的分布特點分析較少,而血脂水平與GBS疾病嚴重程度的相關性研究亦很少。因此,本研究通過對首都醫科大學附屬北京天壇醫院2018-2020年GBS患者蛋白質及血脂代謝指標進行分析,初步探究GBS患者蛋白質及血脂代謝分布特點及潛在臨床意義。
1 資料與方法
1.1一般資料 本研究選取首都醫科大學附屬北京天壇醫院2018-2020年住院的90例GBS患者作為GBS組,所有患者的診斷均符合GBS診斷標準[3],且均為急性起病者,排除感染、發熱的患者。同時選擇與患者性別、年齡相匹配的60例體檢健康者作為對照組,對照組近期均無感染史,無自身免疫疾病史和其他病史。GBS組中男52例,女38例;年齡17~81歲,平均(47.5±16.7)歲。對照組中男35例,女25例;年齡17~70歲,平均(44.4±15.4)歲。本研究通過首都醫科大學附屬北京天壇醫院倫理委員會批準,所有受試者均簽署知情同意書。
1.2儀器與試劑 全自動生化分析儀為日立LABOSPECT 008,其中載脂蛋白A1、載脂蛋白B購自德賽診斷系統有限公司,其余試劑購自和光診斷系統有限公司。
1.3分組標準[4]
1.3.1GBS分型診斷標準 (1)急性炎性脫髓鞘性多發神經病(AIDP)診斷標準:①常有前驅感染史,呈急性起病,進行性加重,多在2周左右達高峰;②對稱性肢體和延髓支配肌肉、面部肌肉無力,重癥者可有呼吸肌無力,四肢腱反射減低或消失;③可伴輕度感覺異常和自主神經功能障礙;④腦脊液出現蛋白-細胞分離現象;⑤電生理檢查提示遠端運動神經傳導潛伏期延長、傳導速度減慢、F波異常、傳導阻滯、異常波形離散等;⑥病程有自限性。(2)急性運動軸索性神經病(AMAN)診斷標準參考AIDP診斷標準,突出特點是神經電生理檢查提示近乎純運動神經受累,且運動神經軸索損害明顯。(3)急性運動感覺軸索性神經病(AMSAN)診斷標準參照AIDP診斷標準,突出特點是神經電生理檢查提示感覺和運動神經軸索損害明顯。(4)米勒-費舍爾綜合征(MFS)診斷標準:①急性起病,病情在數天內或數周內達到高峰;②臨床上以眼外肌癱瘓、共濟失調和腱反射減低為主要癥狀,肢體肌力正常或輕度減退;③腦脊液出現蛋白-細胞分離;④病程呈自限性。
1.3.2GBS嚴重程度評分標準 根據Hughes功能評級量表進行評估,評分≥3分定義為重型GBS,評分<3分定義為輕型GBS。
1.4方法 對照組在體檢時收集9項蛋白質指標[總蛋白(TP)、清蛋白(ALB)、ALB/球蛋白]及血脂代謝指標[三酰甘油(TG)、膽固醇(TC)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、載脂蛋白A1(APOA1)、載脂蛋白B(APOB)],GBS組從不同年齡、性別、嚴重程度、分型、治療前后(免疫球蛋白治療后3 d)等對蛋白質及血脂代謝指標進行分析,并與對照組進行比較及分析。
2 結 果
2.1GBS患者治療前后蛋白質及血脂代謝指標水平比較 GBS患者治療后血清TP水平高于治療前,而血清ALB水平、ALB/球蛋白低于治療前(P<0.05),治療前后TG、TC、HDL、LDL、APOA1、APOB水平比較差異均無統計學意義(P>0.05)。見圖1。
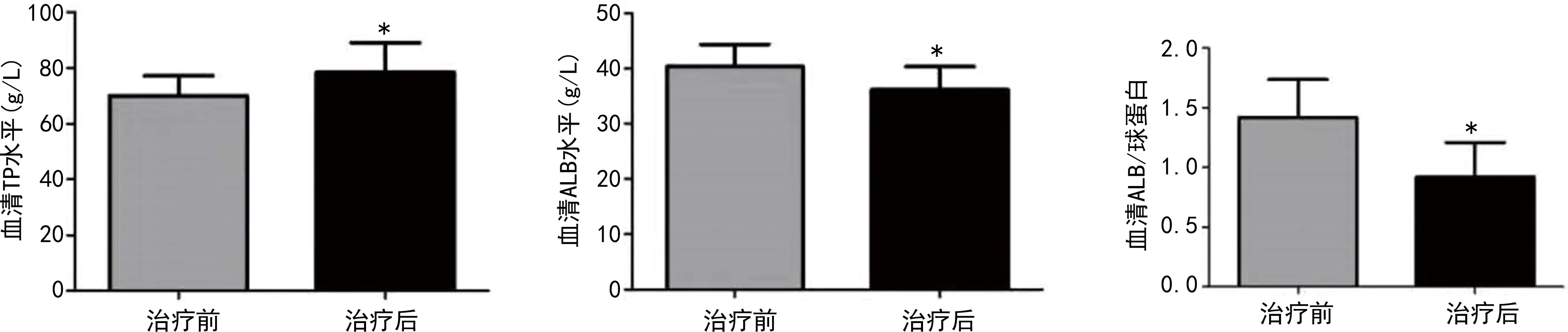
注:與治療前比較,*P<0.05。
2.2不同嚴重程度GBS患者蛋白質及血脂代謝指標水平比較 重型GBS患者共66例,輕型GBS患者共24例。輕型GBS患者血清TG、ALB水平高于重型GBS患者(P<0.05),兩組TP、ALB/球蛋白、TC、HDL、LDL、APOA1、APOB水平比較差異均無統計學意義(P>0.05)。見圖2。
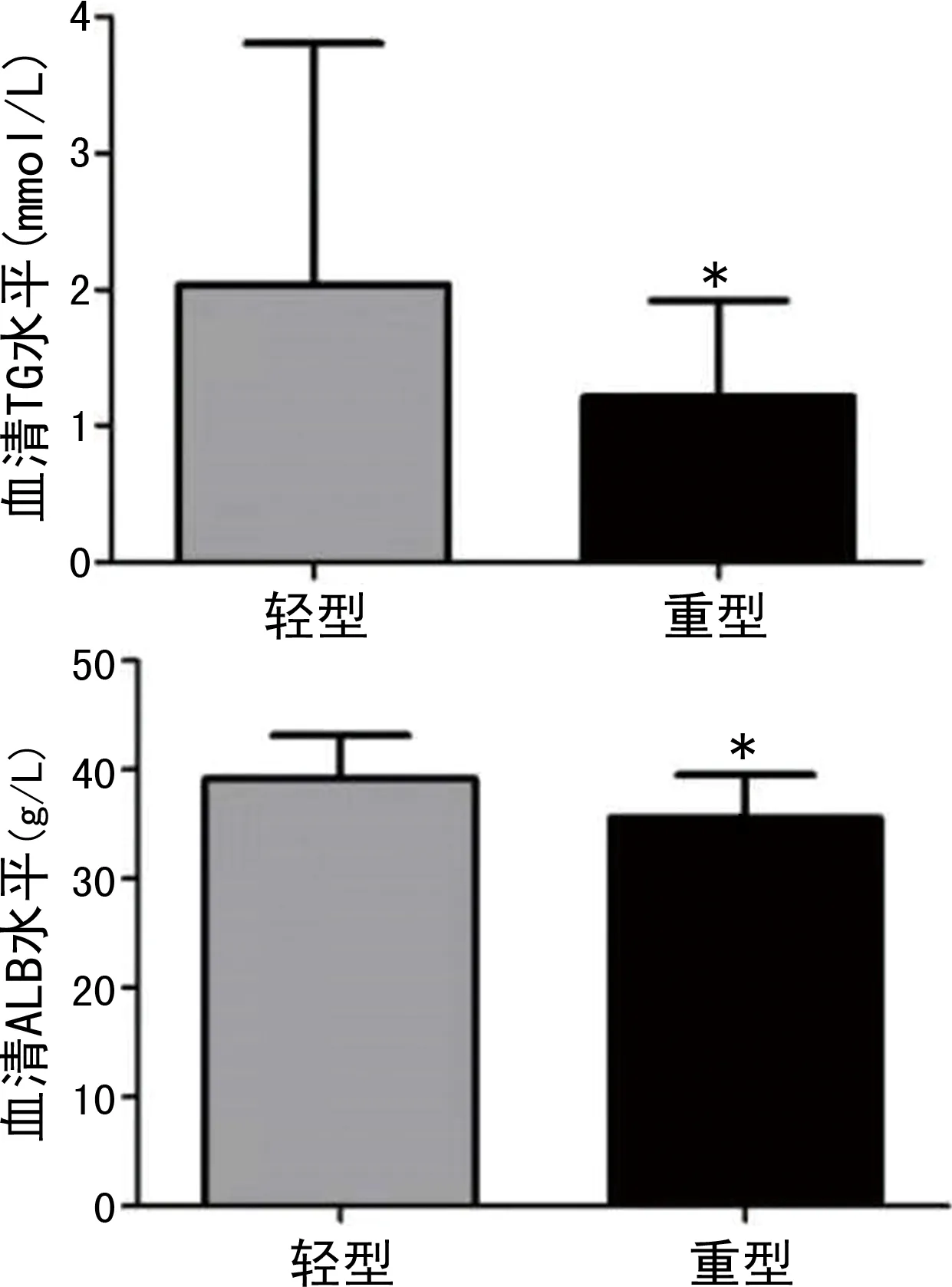
注:與輕型比較,*P<0.05。
2.3不同性別GBS患者蛋白質及血脂代謝指標水平比較 男性GBS患者血清ALB水平高于女性(P<0.05),兩組TP、ALB/球蛋白、TG、TC、HDL、LDL、APOA1、APOB水平比較差異均無統計學意義(P>0.05)。見圖3。
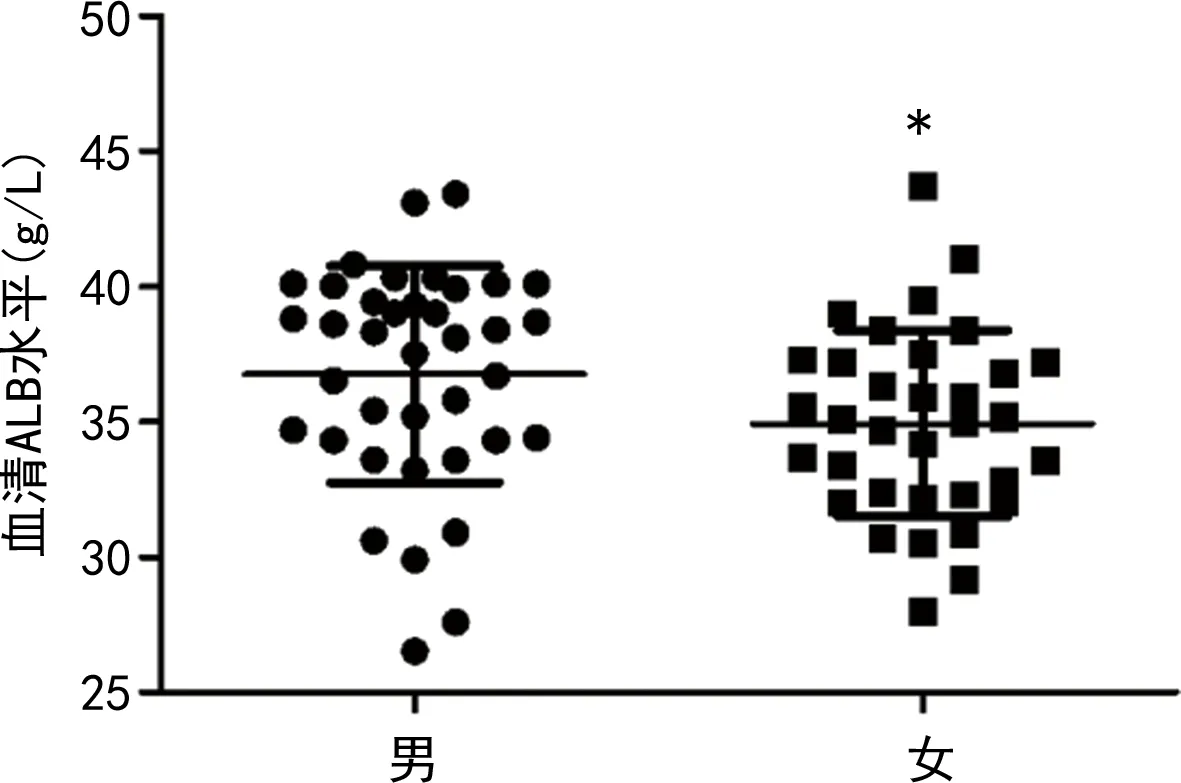
注:與男性比較,*P<0.05。
2.4不同年齡GBS患者蛋白質及血脂代謝指標水平比較 90例GBS患者以50歲為分界點,分為≤50歲和>50歲兩組,其中≤50歲組50例,>50歲組40例。≤50歲組血清APOB、TC及LDL水平均低于>50歲組,而血清ALB水平高于>50歲組(P<0.05),TP、ALB/球蛋白、TG、HDL、APOA1水平比較差異均無統計學意義(P>0.05)。見圖4。

注:與≤50歲比較,*P<0.05。
2.5不同分型GBS患者蛋白質及血脂代謝指標水平比較 90例GBS患者AMAN25例,占28%;MFS16例,占18%;AMSAN12例,占13%;AIDP37例,占41%。不同分型GBS患者血清TG水平比較差異有統計學意義(P<0.05),TP、ALB、ALB/球蛋白、TC、HDL、LDL、APOA1、APOB水平比較差異均無統計學意義(P>0.05)。見圖5。
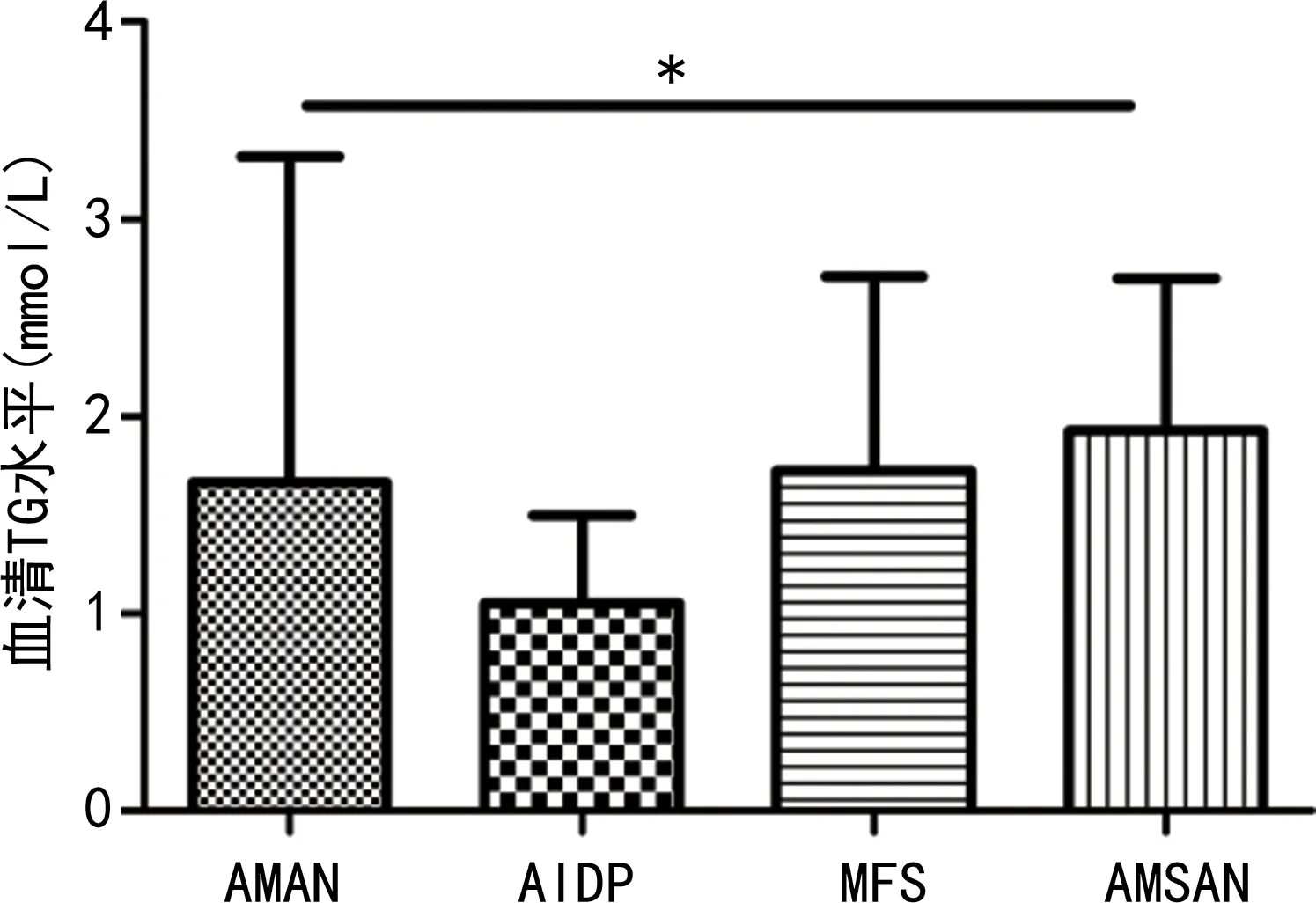
注:4組間比較,*P<0.05。
2.6GBS組與對照組蛋白質及血脂代謝指標水平比較 GBS組治療前TP、ALB、ALB/球蛋白、HDL、APOA1水平均低于對照組(P<0.05),TC、LDL、APOB水平比較差異均無統計學意義(P>0.05)。見圖6。
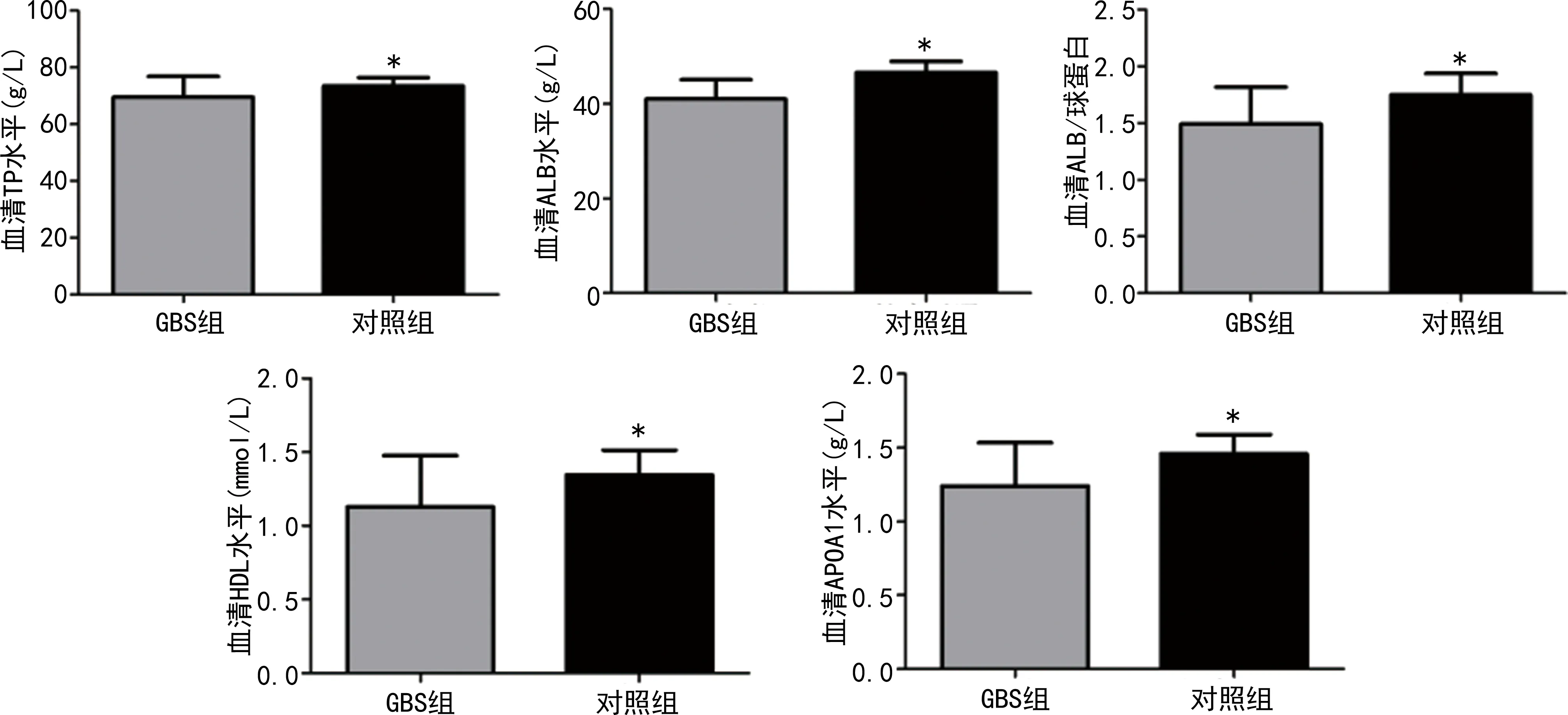
注:與GBS組比較,*P<0.05。
3 討 論
GBS是一種感染后免疫介導的周圍神經病變,多有前驅感染史,臨床上主要表現為四肢弛緩性肌無力,還可能出現感覺障礙、自主神經功能障礙等[1]。目前與GBS疾病相關實驗室指標的研究較少,因此,本研究回顧性分析GBS蛋白質及血脂代謝指標分布特征及其潛在臨床意義。
有研究表明,GBS患者血清ALB水平與Hughes功能評級量表評分呈負相關,中性粒細胞/淋巴細胞和血小板/淋巴細胞有望成為AIDP的血液標志物[5]。SU等[6]研究表明,血清ALB水平是成年GBS患者出院時預后的獨立危險因素。ETHEMOGLU等[7]發現,GBS患者的血清ALB水平明顯降低且高水平ALB是GBS患者的保護因素。FOKKINK等[8]研究發現,丙種球蛋白免疫治療后GBS患者會出現低蛋白血癥,可能與臨床癥狀的嚴重程度和預后有一定關系。本研究回顧性分析2018-2010年90例GBS患者蛋白質及血脂代謝指標分布特點,與其他學者研究結果類似,筆者發現GBS組與對照組比較血清ALB水平、ALB/球蛋白明顯偏低[6],且輕型GBS患者ALB水平較重型GBS患者更高。GBS在炎癥狀態下表現為低蛋白血癥,這可能與GBS是一種自身免疫介導的周圍神經系統急性炎性損傷性疾病有關,炎癥可改變蛋白質的分解、合成代謝狀態及血管通透性,從而影響血清蛋白質水平。腦脊液和血清ALB比值越大,血腦屏障損害越嚴重[9]。GBS疾病嚴重程度越高,神經中樞及血腦屏障損害越嚴重,炎癥越重,ALB水平越低,故血清ALB水平與GBS疾病嚴重程度呈負相關。大樣本研究結果表明,隨著年齡增長血清ALB水平逐漸下降[10-11],與本研究中≤50歲組血清ALB水平高于>50歲組的結果一致。
脂質代謝與多種自身免疫性疾病的進展、復發或預后相關,如多發性硬化、自身免疫性甲狀腺疾病、GBS等。目前,血脂代謝與GBS疾病進程及嚴重程度的關系尚不確切,本研究結果顯示,>50歲組血清TC、APOB、LDL水平高于≤50歲組,可能與高齡患者易出現高血脂有一定關系;同時發現,GBS組HDL、ApoA1水平低于對照組,且重型GBS患者較輕型GBS患者TG水平明顯降低,不同分型GBS患者之間TG水平差異有統計學意義(P<0.05)。有研究結果顯示,GBS患者較健康對照者血總膽固醇水平明顯降低,重型GBS患者較輕型GBS患者血漿中部分磷脂代謝產物水平明顯降低[12-13]。因此,GBS患者血脂水平在疾病診斷及嚴重程度預測中有一定價值,但是確切結論及機制仍需進一步研究。
GBS患者表現為低蛋白血癥及低脂血癥;重型GBS患者較輕型患者ALB、TG水平明顯降低,不同分型GBS患者TG水平有明顯差異,提示蛋白質及血脂代謝指標可能可用于輔助判斷GBS嚴重程度及分型。但是本研究的不足之處在于樣本量小(特別是根據年齡、類型等分為多組時,每組樣本量都小),無法動態觀察不同疾病階段的蛋白質及血脂代謝水平變化。因此,需要進一步擴大樣本量,得出準確結論及分析蛋白質及血脂代謝指標在GBS病理機制中的作用。

