血漿氧化三甲胺與冠心病的相關性及對冠心病患者預后的影響
劉艷琪, 鄭冠群, 陳志賢, 金驍琦, 盛曉東, 王志強
(江蘇省常熟市第二人民醫院 心血管內科, 江蘇 常熟, 215500)
冠心病(CHD)因動脈粥樣硬化病變,導致冠狀動脈狹窄、閉塞或功能性改變,進而影響冠狀動脈內血流供應,造成心肌缺血、缺氧。CHD作為嚴重危害人類健康的慢性疾病之一,給個人、家庭和社會均帶來沉重的負擔[1]。血運重建[2]、術后常規的抗血小板治療[3]均未能在真正意義上有效控制CHD患者的病死率。氧化三甲胺(TMAO)為動脈粥樣硬化的一種主要影響因素。血漿TMAO水平升高與心血管事件風險增加相關[4]。TMAO是膽堿族磷脂酰膽堿的一種腸道菌群依賴性代謝物,其相關原理為膽堿及其代謝物(如甜菜堿)的有效成分是三甲基甘氨酸,具有甲基供體作用[5-6]。腸道菌群將宿主攝入的膽堿轉化為三甲胺(TMA), TMA在肝臟被轉化為TMAO,釋放入血, TMAO進一步影響膽固醇代謝、食物膽堿或TMAO的補充劑,導致巨噬細胞表面清道夫受體(CD36和SR-A1)表達增加,促使泡沫細胞的形成,從加速動脈粥樣硬化的形成[7]。本研究探討了TMAO與CHD的相關性以及對CHD患者預后的影響,現報告如下。
1 資料與方法
1.1 一般資料
選取2019年 5 月—2020 年12月江蘇省常熟市第二人民醫院心內科住院接受冠狀動脈調查的患者324例,根據冠狀動脈影像學結果(是否確診CHD)分為對照組124例、CHD組200例(其中慢性穩定性勞力型心絞痛患者116例,缺血性心肌病患者48例,急性冠狀動脈綜合征之后穩定的病程階段患者 36例)。 根據所測的TMAO數值中位數3.14 μmol/L將CHD組分為A組(低TMAO CHD組)與B組(高TMAO CHD組)。
納入標準: CHD診斷符合《2018年穩定性冠心病診斷與治療指南》[8], 包括慢性穩定性勞力型心絞痛、缺血性心肌病和急性冠狀動脈綜合征之后穩定的病程階段,即指冠狀動脈造影顯示1支或1支以上主要冠狀動脈(指左冠狀動脈主干、前降支、回旋支、右冠狀動脈)管腔面積縮小≥51%者; 所有接受PCI的患者均符合《2016年中國經皮冠狀動脈介入治療指南 》[9]。排除標準: 嚴重感染、腫瘤、外傷、結締組織病及急性腎功能不全者。所有患者采血前均口服了冠心病二級預防藥物(包括抗血小板藥物及降脂藥物)。本研究項目獲本院倫理委員會批準,且所有患者均簽署知情同意書。
1.2 基本資料和預后情況
記錄患者的基本信息,包括年齡、性別、體質量指數(BMI)及高血壓、糖尿病、高脂血癥病史和收縮壓、心率、生化(白蛋白、尿酸、肌酐)、腦鈉肽(BNP)、TMAO、左心房內徑(LAD)、左室射血分數(LVEF)、冠狀動脈情況(部位、數量)、手術方式(支架數量)。隨訪1年內心血管不良事件(因心絞痛、心肌梗死、心衰、惡性心律失常再住院率、再次急性心肌梗死、非計劃內再次血運重建、死亡)的發生情況。
1.3 血漿TMAO測定
所有患者入院后均采集空腹靜脈血,使用含有乙二胺四乙酸的Vacutainer管,采集經橈動脈入徑采集的肝素化前血液樣品,然后立即離心,并在-80 ℃冰箱儲存。使用同位素稀釋-高效液相色譜-串聯質譜法測量血漿TMAO水平。
1.4 冠狀動脈病變測定
其中有44例復雜冠狀動脈病變造影術中,借助了美國Boston公司的iLab IVUS系統進行檢查,將IVUS導管通過冠狀動脈導絲置入靶血管遠端,然后緩慢回撤超聲導管,觀察冠狀動脈全程的二維切面圖像,并通過計算軟件計算管腔面積狹窄。
1.5 Gensini評分
采用Gensini評分對患者的冠狀動脈病變程度進行評定: ① 根據狹窄程度計分, <25%計為1分, 25%~<50%計為2分, 50%~<75%計為4分, 75%~<91%計為8分, 91%~<100%計為16分, 100%計為32分。 ② 根據分支病變確定系數,左主干×5, 左前降支近段×2.5, 左前降支中段×1.5, 左前降支遠段×1; 第一對角支、第二對角支、左回旋支各段、后側支、右冠狀動脈各段均×1。 ③ 多支病變各部位評分之和為總評分。根據Gensini評分對冠狀動脈病變程度進行分級, Gensini評分<41分為低分, Gensini評分41~64分為中分, Gensini評分>64分為高分。
1.6 統計學分析

2 結 果
2.1 2組患者一般資料比較
2組年齡、性別、吸煙占比比較,差異無統計學意義(P>0.05)。CHD組BMI及合并高血壓病、合并糖尿病、合并高脂血癥例數和TMAO水平高于對照組,差異有統計學意義(P<0.05), 見表1。
2.2 CHD影響因素的Logistic回歸分析
以CHD為因變量,以年齡、性別、BMI、合并高血壓等為自變量行Logistic回歸分析。結果顯示,高BMI、合并高血壓、高脂血癥、高TMAO水平均是CHD的危險因素(OR>1,P<0.05), 見表2。

表1 2組患者基線資料比較

表2 CHD相關因素Logistic回歸分析
2.3 CHD患者一般資料比較
B組患者的高血壓、高脂血癥、吸煙人數均多于A組。2組患者在性別、年齡、高血壓、高脂血癥、糖尿病、吸煙史、生化、心功能等資料方面比較,差異無統計學意義(P>0.05)。2組BMI比較,差異具有統計學意義(P<0.05)。見表3。
2.4 TMAO影響因素的Logistic分析
以TMAO高低作為因變量,以年齡、BMI等作為自變量行二元回歸分析。結果發現, BMI高是TMAO升高的危險因素, BMI每增加1, TMAO升高風險增加48.2%(P=0.01), 見表4。

表3 CHD患者基線資料比較

表4 患者血清TMAO水平相關因素Logistic回歸分析
2.5 術中資料
2.5.1 一般資料: 所有患者在排除禁忌證后,在局麻下橈動脈或肱動脈路徑行冠狀動脈造影手術,介入術者均具有冠狀動脈介入資質,復雜病變者協助IVUS測量管腔狹窄,植入支架后協助IVUS檢驗支架貼壁情況。A組患者術中均未發生嚴重并發癥, B組患者中有1例術中出現心跳驟停,予胸外按壓5 s后恢復正常心律。計劃內再次手術包括了僅經皮冠狀動脈腔內成形術(PTCA)擴張病變后,復查冠狀動脈造影,或擇期處理其他罪犯血管等,不包括復查罪犯血管及支架貼壁不良等技術原因復查造影。B組多支病變患者多于A組,差異有統計學意義(P<0.05)。2組在冠狀動脈病變部位、平均支架植入數量、計劃再次手術例數方面比較,差異無統計學意義(P>0.05)。A組患者Gensini評分低于B組患者,差異有統計學意義(P<0.05), 見表5。
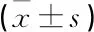
表5 CHD患者術中資料比較
2.5.2 TMAO水平與Gensini評分的相關性: Pearson法分析提示,患者血清TMAO水平與Gensini評分呈正相關(r=0.449,P<0.001), 見圖1。

圖1 患者血清TMAO水平與Gensini評分的相關性
2.5.3 TMAO與冠狀動脈病變支數相關性: 將患者分為單支冠狀動脈病變組(n=78)和多支冠狀動脈病變組(2支,n=122), 結果發現,冠狀動脈多支病變患者TMAO水平[3.31 μmol/L(IQR: 2.755~3.800)]高于單支病變患者[2.92 μmol/L(IQR: 2.285~3.325)], 差異有統計學意義(P<0.05)。見圖2。

圖2 不同支術冠狀動脈病變患者血漿TMAO濃度比較
2.6 1年內心血管不良事件發生情況
A組中有1例因心衰合并重癥感染死亡,再發心肌梗死1例。B組共發生11例非計劃內再次血運重建,其中3例因病變嚴重行外科冠狀動脈搭橋手術, 1例術中發現室壁瘤破裂死亡。B組共出現了3例支架內再狹窄,支架植入時均復查IVUS, 提示支架貼壁良好,術后患者均規范服藥,低密度脂蛋白有效控制。見表6。
2.7 生存分析
以心血管不良事件作為終點事件,采用Log-rank檢驗,結果顯示A組心血管不良事件發生例數(12例)低于B組(28例),差異有統計學意義(P=0.005)。Kaplan-Meier曲線分析顯示,與A組患者相比,B組患者隨觀察時間延長,生存率顯著下降,提示不良事件發生率高; 與A組患者相比, B組患者隨觀察時間的延長,死亡風險顯著升高,提示B組不良事件發生風險高。見圖3、圖4。

表6 CHD患者隨訪一年內心血管不良事件


3 討 論
腸道菌群被稱為人類后天獲得的第二基因庫,與心血管疾病的發生發展緊密相關[10]。腸道菌群將宿主攝入的膽堿轉化為三甲胺,三甲胺在肝臟被轉化為TMAO, 入血可通過上調參與巨噬細胞表面清道夫受體的表達水平、抑制膽固醇逆向轉運等過程參與一系列反應。此外,研究[11]證明TMAO可通過促進細胞內儲存的Ca2+釋放,增強血小板對多種激動劑的反應性,進而導致血小板高反應性。本研究結果表明,TMAO水平是引起CHD, 且影響冠狀動脈病變程度的因素之一,同時可以進一步影響CHD患者預后。
本研究中, CHD 組BMI、合并高血壓病、糖尿病、高脂血癥,吸煙占比、TMAO水平高于健康對照組,并且Logistic回歸結果顯TMAO水平可以導致CHD。動物模型實驗[12-13]證實了TMAO可以促進粥樣硬化。CHDA組和B組患者的基線資料無明顯差異,但2組BMI差異顯著, BMI是TMAO升高的危險因素。這可能是因為肥胖人群常常伴隨不規范的飲食習慣, TMAO為腸道細菌消化膽堿、肉堿等豐富營養物質時產生。有學者[14]對肥胖人群進行8周素食飲食后,其血漿TMAO下降40%。一項Meta分析[15]結果發現, TMAO濃度與BMI的增加之間呈劑量效應性關聯。TMAO導致肥胖的代謝途徑可能與黃素單加氧酶(FMO3)有關,其可以活化TMAO, 敲擊了FMO3基因的小鼠食用高脂肪、高熱量的飲食均未肥胖[16]。
本研究采用Gensini評分評價患者的冠狀動脈病變,發現低水平TMAO組患者Gensini評分低于高水平TAMO組患者。Gensini評分可以客觀反映冠狀動脈粥樣硬化的嚴重程度,且和血清總膽固醇、低密度脂蛋白膽固醇具有相關性[17], 但在該研究中校正了2組的血脂水平,通過Pearson法得出Gensini評分與TMAO水平具有相關性。這可能因為TMAO除了可以抑制巨噬細胞膽固醇逆轉外,還可以另外通過增強半胱氨酸天冬氨酸特異性蛋白酶-1(caspase-1)的活性,誘導人臍靜脈內皮細胞及載脂蛋白E基因敲除(Apo E-/-)出現炎癥,從而導致粥樣硬化[18]。另一項研究[19]分析得出,TMAO水平與冠狀動脈病變程度獨立相關。本研究發現,冠狀動脈多支病變患者TMAO水平高于單支病變患者。這一結果與相關研究[20]結果一致。目前,研究[6, 21]表明血漿TMAO水平增加可以作為CHD診斷的標志物。
由于時間限制,本研究只隨訪了1年心血管不良事件,結果顯示B組不良事件的發生率高于A組, Log-rank檢驗及Kaplan-Meier生存曲線提示TMAO高水平患者與TMAO低水平患者相比,心血管不良事件發生率升高,相對生存率逐漸下降。一項Meta分析[22]顯示,血漿TMAO濃度升高可使CHD患者發生主要不良心血管事件的風險增加58%。張亞男等[23]發現,血漿TMAO水平每升高1.0 μmol/L, 主要不良心血管事件風險增加10.2%。同時LI X S等[24]發現,急性胸痛患者的高血漿TMAO水平是30 d及7年死亡的獨立預測因子。本研究結果與上述研究結果相符,猜測可能原因為TMAO除可以促進動脈粥樣硬化之外,還可以直接激活心房自主神經節神經叢觸發房性心律失常[25]。研究[26-27]證明,在心力衰竭患者中,血漿TMAO水平明顯升高。在動物實驗[28]中, TAMO喂養的小鼠出現了嚴重的心力衰竭。因此,推薦血漿TMAO水平作為不良心血管事件風險的預測標準,可有利于臨床醫生進行早期干預。
TMAO濃度與動物蛋白、飽和脂肪、魚、雞肉和紅肉的攝入量呈正相關,與植物蛋白和堅果的攝入量呈負相關[29]。由于飲食習慣可以影響TMAO水平, TMAO有望成為CHD一級預防以及改善患者預后的新靶點。本研究仍存在一定局限性: 首先, TMAO生成與飲食相關,本研究中的患者并未嚴格統一飲食; 其次,本研究是一項橫斷面研究,難以確定TMAO 水平與CHD動脈粥樣硬化程度之間的因果關系,還需進一步探討研究。

