3D打印技術應用于復發黏液纖維肉瘤腹腔腹壁多發轉移1例報告
周 科,覃先蓬,周曉剛
(四川省醫學科學院.四川省人民醫院胃腸外科,四川 成都 610072)
患者,女,74歲,患者因“發現左下腹包塊1年余”為主訴于2021年3月20日入院。1年余前發現左下腹包塊至我院就診,于2019年11月30日全麻下行“剖腹探查術”,術后病檢回示:“腹壁包塊”梭形細胞腫瘤;免疫組化示低度惡性黏液纖維肉瘤(MFS)。6月余前偶然發現左下腹部一包塊,大小約4 cm×5 cm,質韌,無壓痛,偶伴黑便及便秘;于當地醫院就診予以對癥治療后上述包塊無明顯減小(具體用藥不詳)。為求進一步診治來我院。入院查體:腹部平坦,可見陳舊性手術瘢痕,無腹壁靜脈曲張,未見腸型及蠕動波;腹軟,全腹無壓痛、反跳痛及肌緊張;左下腹部可捫及一大小約4x5 cm包塊,質韌固定,無壓痛。肝脾肋下未觸及,肝腎區無叩痛,移動性濁音陰性,腸嗚音正常。入院診斷:腹部包塊:性質;入院后完善腹部增強CT:下腹壁見一不規則巨大腫塊影,最大徑約15.5 cm,密度不均,跨越左側腹直肌生長,向外膨突,向內形成不規則腫塊,腫塊跨越腹中線,向上達骶1椎體層面,向右、向下達恥骨聯合上方、膀胱局部受推擠,向左下達左側腹股溝區,增強掃描病灶呈明顯不均勻持續性強化(見圖1)。考慮腫瘤占位性病變,結合病史考慮纖維肉瘤復發可能大。
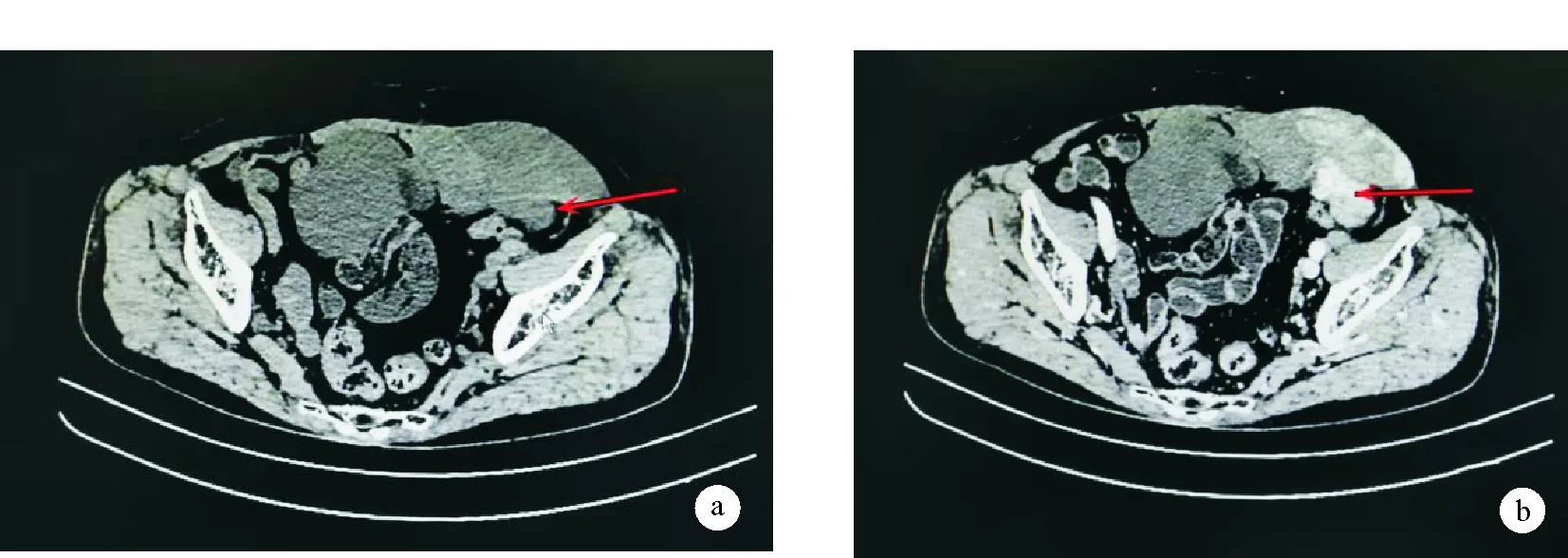
圖1 患者術前腹部CT a.平掃;b.增強
因本例患者從CT圖像判斷病變與周圍組織器官的關系不精準,手術風險大、難度高。經科室討論后決定對患者的CT影像掃描數據進行多模態精準三維重建,規劃設計出臨床所需的組織器官模擬圖像,標識出病變位置以及周圍相鄰組織的位置和結構,進而根據臨床要求采用3D打印技術,完成1∶1比例手術模型的制備(見圖2)。模型采用彩色材質,病變與周圍組織器官不同結構間層次的分界、對應關系通過不同顏色準確區分標記出來,1∶1比例清晰重現病變情況以及與周邊組織器官的結構關系。結合模型與臨床經驗可清晰地判斷:病變與腹壁軟組織廣泛浸潤,與膀胱關系密切,但與腹腔內腸管、髂血管及輸尿管之間存在間隙,判斷病變可切除。2021年3月29日患者于全麻方式下行“腹腔腹壁復發多發纖維肉瘤切除術+腸粘連松解術+腹壁整形重建術”;術中見:腹腔中度粘連,下腹壁腫瘤侵犯腹直肌,向腹腔內膨出,推擠膀胱和周圍腸管,尚未侵犯腹腔臟器,于腹壁完整切除3枚腫瘤,腹腔切除1枚腫瘤。術后患者恢復良好,無嚴重并發癥發生,順利出院;術后病理檢查:腹壁包塊,中級別MFs;術后隨訪至2021年7月,患者一般狀況良好,未發現復發及轉移。
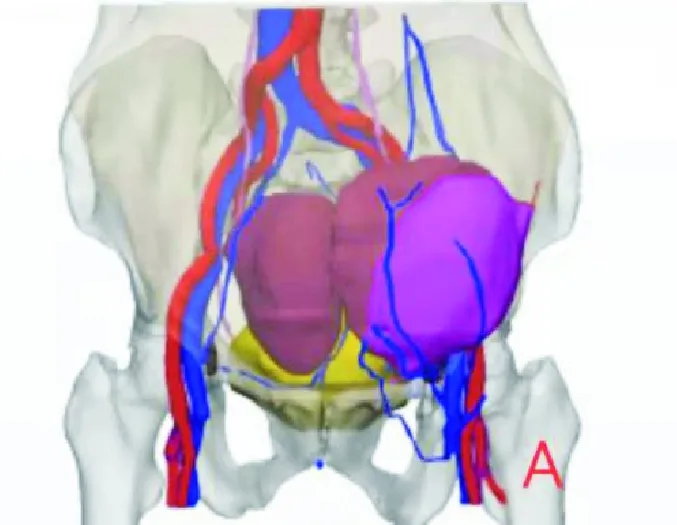
圖2 三維影像重建圖
討論MFS由 Angervall等[1]于1977年首先提出,MFS是一種源自成纖維細胞的惡性腫瘤,是由異型性不等的成纖維細胞樣細胞和黏液樣基質組成的腫瘤。MFS的病因目前尚不清楚。常見于老年人,主要累及50~70歲患者,20歲以下患者非常罕見。最常表現部位是四肢,下肢>上肢;MFS也可位于軀干和頭頸部,但在腹腔和腹膜后少見。MFS大部分表現為緩慢生長的無痛性深部軟組織腫塊。因MFS病理成分多樣化,故其瘤內密度/信號混雜;“黏液樣基質區”于CT平掃呈低密度;T1WI信號混雜,與粘液成分有關,含水量較多時呈稍低信號,粘蛋白較多時呈等或稍高信號,T2WI呈明顯高信號,增強掃多呈輕度不均勻延遲強化,少數病變可不強化[2]。總之CT及MRI僅具有一定的特征性,最終確診需依靠病理檢查結果。手術徹底切除腫塊(切除范圍包括腫瘤及周圍1~2 cm的正常脂肪和肌肉組織)是治療MFS的首選方式。如有條件盡可能行術中切緣冰凍病理檢查,若出現切緣陽性,應立即行擴大切除術[3,4]。MFS有著較高的復發率,有研究表明原發性非計劃手術和術后組織學切緣陽性是MFS預后不良的顯著相關因素[5]。R0切除和輔助放療促進了MFS的局部控制,降低腫瘤復發率[6];目前國內認為4~6周期的化療可能對預后有益,但是損傷較大。此外,擴大切除手術和/或放療后復發治療的全身性療法集中于分子靶向治療,目前已有研究表明多個分子靶點可能與MFS的治療相關[7]。
3D生物打印是以計算機三維模型為基礎,通過軟件分層離散和數控成型的方法,定位裝配生物材料或活細胞,制造醫療輔具、人工植入支架、組織器官等生物醫學產品的3D打印技術[8];未來3D生物打印可能是解決組織工程和再生醫學中人體器官短缺這一嚴重問題的方法之一[9]。當然其中還有很多困難與挑戰。
總之,MFS是一種非常少見的源自成纖維細胞的惡性腫瘤;術前相關檢查缺乏特異性,準確的病理結果和免疫組化是診斷該病的唯一途徑;MFS治療以手術徹底性切除為主,放療為輔,化療備選;MFS術后復發率較高,術后輔以放療促進了MFS的局部控制。3D生物打印技術通過多模態精準三維重建、1∶1比例手術模型的制備,可清晰重現病變組織情況以及與周邊組織的關系,以此評估手術可行性,降低手術風險。

