肺癌患者轉錄輔助因子過氧化物酶增殖體激活受體γ輔助因子1、電壓依賴性陰離子通道1表達及臨床意義
鄭金錄,張 超,李紅軒
(安徽省阜南縣人民醫院,安徽 阜陽 236300)
肺癌是一種高發病率和高死亡率的惡性腫瘤,相關研究發現接受適當治療的早期患者存活率可以增加到大約40%[1]。腫瘤的發展均涉及到細胞代謝的變化,而線粒體功能的改變有助于腫瘤細胞的代謝,更有助于轉移[2,3]。過氧化物酶增殖體激活受體γ輔助因子1α(PGC1α)廣泛參與線粒體生物合成、能量代謝和糖脂代謝等過程,研究發現在各種癌癥中PGC1α的表達升高,且與更具侵略性的癌癥和不良預后有關[4]。電壓依賴性陰離子通道1(VDAC1)是控制細胞能量、代謝平衡和細胞凋亡的線粒體蛋白,其表達降低可能導致細胞能量和代謝的抑制[5]。本研究分析肺癌患者PGC1α、VDAC1表達及其不同臨床病理中的表達相關性,并計算術后生存曲線,探尋高效的肺癌標志物,現報道如下。
1 資料與方法
1.1 一般資料選取2017年4月至2019年5月在我院就診的肺癌患者156例(肺癌組),納入標準:臨床病理學檢查確診為肺癌患者;年齡>18歲;臨床資料和隨訪資料完整,直至患者死亡或者截止隨訪時間。排除標準:嚴重肝、腎、心功能疾病患者;術前經過化療、放療治療患者;合并其它惡性腫瘤的患者;認知功能障礙或精神經病患者;免疫系統疾病患者。男96例,女60例,年齡>60歲89例,≤60歲67例,腫瘤大小>5 cm 74例,≤5 cm 82例;鱗狀上皮細胞癌103例,腺癌53例;TNM分期,T1~T4期分別有31、55、54、16例;有淋巴結轉移64例,無轉移92例;有遠處轉移31例,無轉移125例。另收集同期94例肺部良性病患者,納入標準:臨床病理學檢查確診為肺部良性疾病;年齡>18歲;臨床病理資料資料完整。排除標準:有嚴重肝、腎、腦部疾病;合并其它惡性腫瘤的患者;認知功能障礙或精神經病患者;免疫系統疾病患者。男63例,女31例,年齡>60歲59例,≤60歲35例,兩組一般資料比較差異無統計學意義(P>0.05)。
1.2 方法將石蠟包埋的組織塊切片,使用檸檬酸鹽緩沖液微波加熱20 min修復抗原。分別用鼠抗人PGC1α抗體、鼠抗人VDAC1抗體對標本進行免疫組化學(SP)染色,按照SP免疫組化檢測試劑盒要求進行染色。所有抗體和試劑盒均購自欣博盛生物科技有限公司。①著色評分:按照著色深度(棕褐色、黃色、淺黃色、無色)依次評為3、2、1、0分。②染色評分:按照陽性細胞比例<10%、10%~30%、31%~50%、>51%依次評為0、1、2、3分。將著色評分和染色評分相乘即為總得分,PGC1α、VDAC1的總得分≥5分為高表達,<5分為低表達[6]。術后隨訪復查,截止到2021年5月。
1.3 觀察指標①肺癌組及肺部良性疾病組中PGC1α、VDAC1表達水平。②PGC1α、VDAC1表達與病理特征的相關性。③PGC1α、VDAC1表達與肺癌患者生存預后的關系。④肺癌組織PGC1α、VDAC1表達的相關性。
1.4 統計學方法應用SPSS 20.0統計學軟件分析數據。計數資料以百分數(%)表示,比較采用χ2檢驗;等級資料比較采用秩和檢驗;用Kaplan-Meier法計算肺癌患者術后生存曲線;相關性分析采用Spearman等級相關。P<0.05為差異有統計學意義。
2 結果
2.1 兩組PGC1α、VDAC1表達水平比較肺癌組PGC1α、VDAC1的高表達率高于肺部良性疾病組(P<0.05),見表1。
2.2 PGC1α、VDAC1表達與臨床病理特征的相關性PGC1α、VDAC1高表達與TNM分期、淋巴結轉移、遠處轉移正相關,見表2。
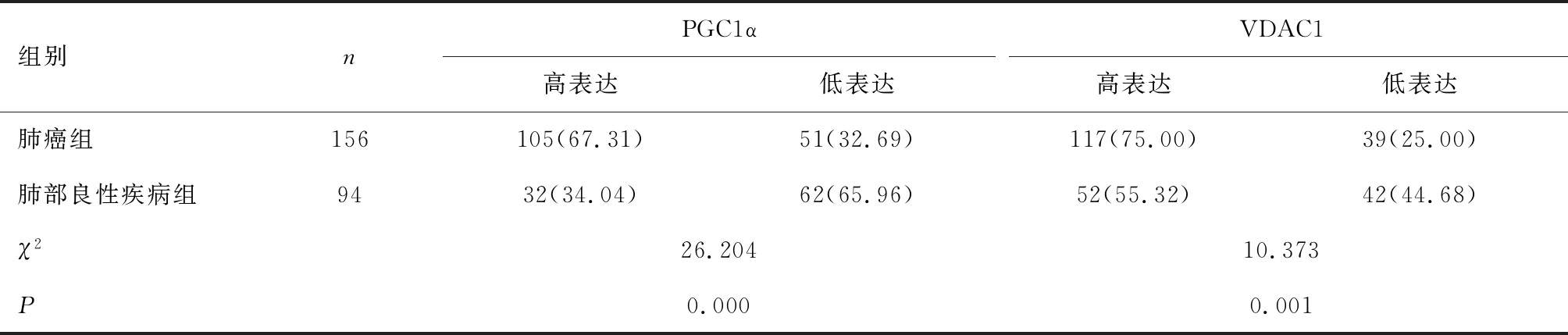
表1 兩組PGC1α、VDAC1表達水平比較 [n(%)]
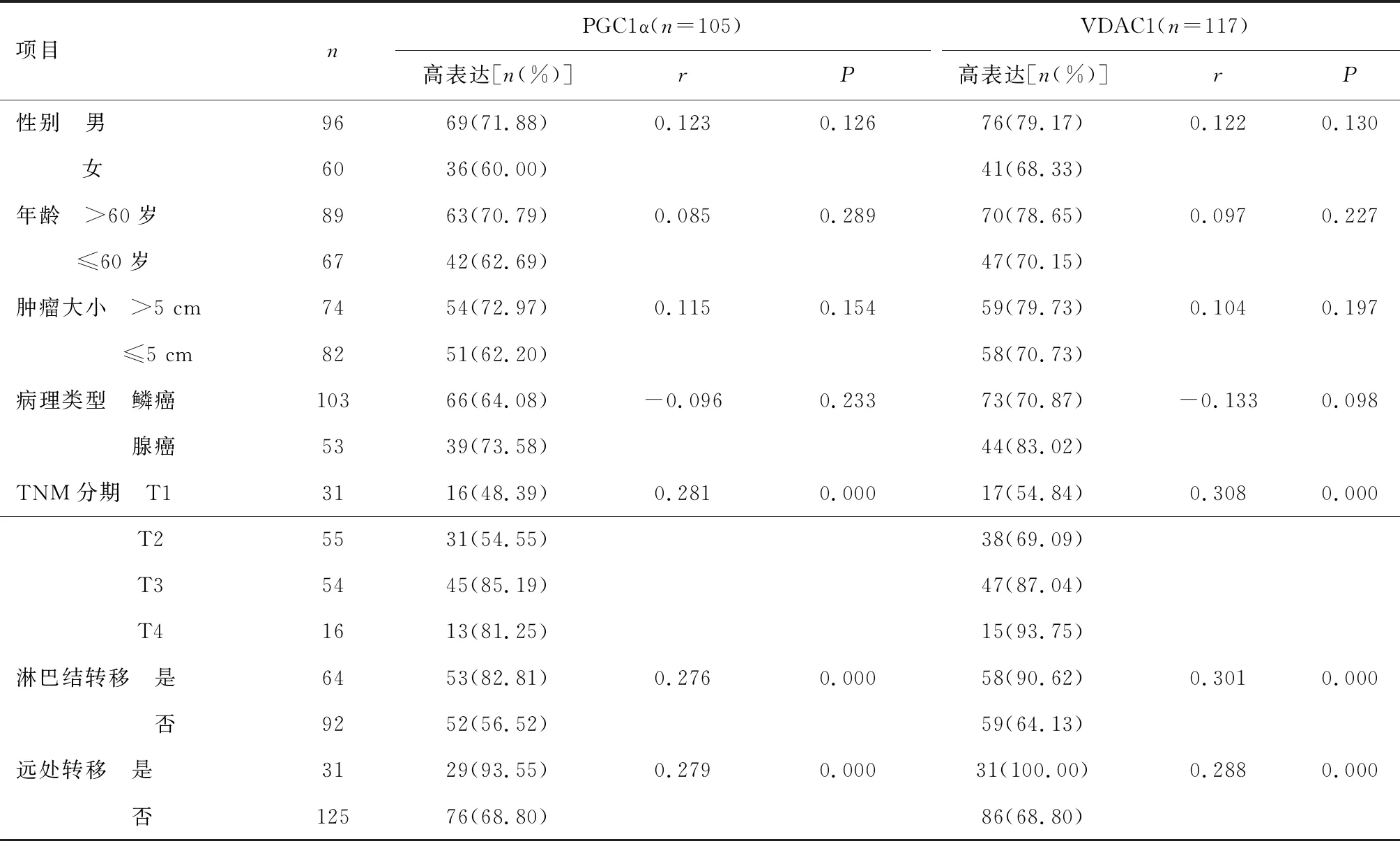
表2 PGC1α、VDAC1在不同臨床病理中的表達相關性
2.3 PGC1α、VDAC1表達與生存預后的關系生存曲線分析顯示,所有患者3年生存率為68.59%(107/156)。PGC1α、VDAC1高表達患者3年生存率均低于其低表達(P<0.05),見表3,圖1、2。
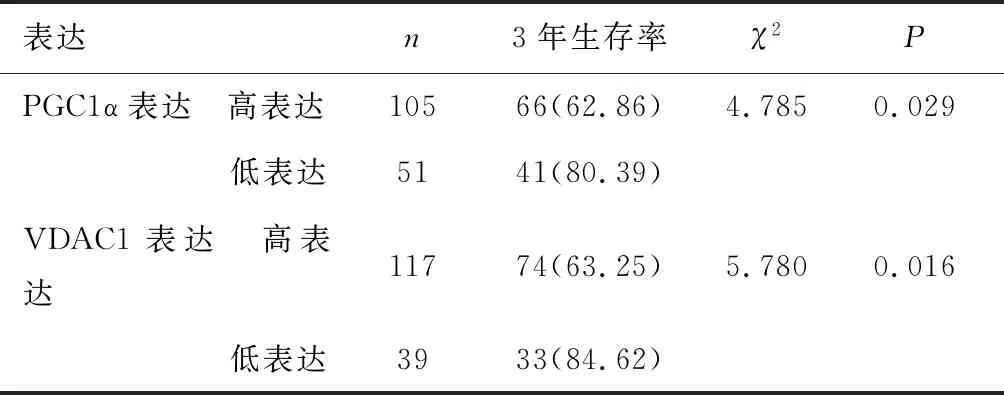
表3 PGC1α、VDAC1表達與3年生存預后的關系 [n(%)]
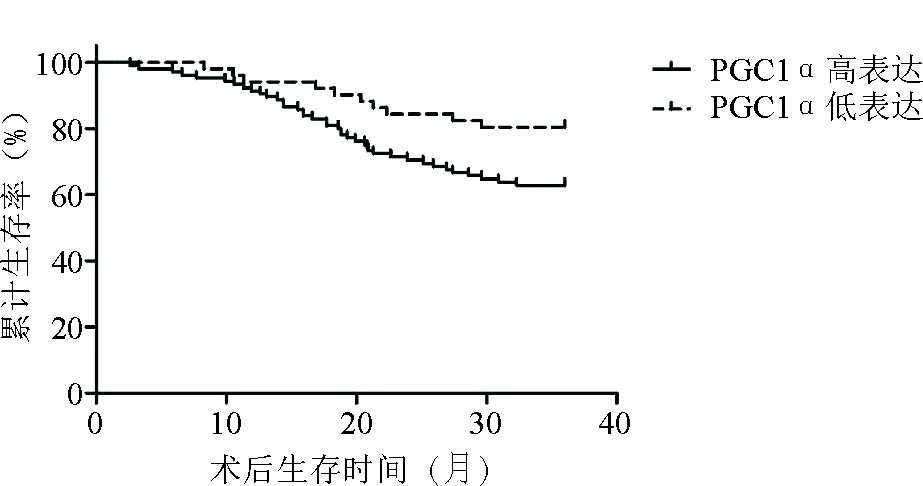
圖1 不同PGC1α表達情況與生存預后的關系
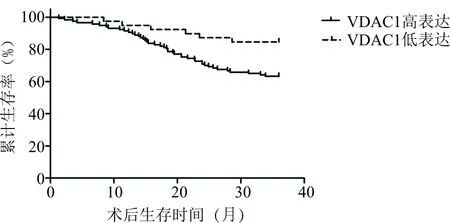
圖2 不同VDAC1表達情況與生存預后的關系
2.4 肺癌組織PGC1α、VDAC1表達的相關性PGC1α表達與VDAC1表達呈極強正相關(r=0.814,P<0.05)。
3 討論
肺癌是發病率和死亡率增長最快的惡性腫瘤之一,隨著癌細胞的生長和擴散,它們會嚴重損害患者的呼吸系統并影響氧氣交換[7]。中國國家中央腫瘤登記中心(NCCRC)發布了2015年最新全國性惡性腫瘤統計數據顯示,肺癌的發病率排名第一,且患者的5年生存率很低,只有18%[8]。據統計,超過70%的肺癌患者一發現已是晚期,并且大多數患者不適合手術治療[9]。腫瘤的發病機制和進展與主要的代謝密切相關,線粒體異常會引起能量代謝障礙,從而導致病變[10,11]。PGC1α作為線粒體生物發生和功能的主要調節因子已得到充分研究,特別是在正常組織中,并且通常被認為促進氧化代謝[12]。PGC1α的異常表達和翻譯后修飾對其作為轉錄調節因子的活性有很大影響[13]。本研究結果顯示,肺癌組PGC1α的高表達率高于肺部良性疾病組,提示PGC1α可作為肺癌標志物,其表達量越高,肺部腫瘤的惡化也越嚴重[14]。進一步研究PGC1α 表達與肺癌患者臨床特征之間的相關性,發現PGC1α高表達與TNM分期、淋巴結轉移、遠處轉移呈正相關,提示PGC1α可能參與了腫瘤細胞的增殖和侵襲。而PGC1α表達的失調可能引發代謝紊亂,導致氧化還原改變的炎癥過程,進而導致代謝綜合征的發展。以往的研究發現PGC1α可以通過增加血管內皮細胞,并促進血管生成、線粒體生物生成和氧化磷酸化,導致腫瘤血管生成、侵襲和轉移[15]。PGC1α高表達患者3年生存率低于其低表達,提示PGC1α高表達可與不良預后顯著相關。目前,關于PGC1α對多種不同類型癌癥的致瘤作用尚不清楚。根據有關研究報道,PGC1α信號軸通過增加谷氨酰胺代謝來促進癌細胞增殖和癌癥轉移[16]。但與此相矛盾的是,在前列腺癌中,PGC1α通路抑制了腫瘤轉移[17]。Wang等表明PGC1α過表達誘導的更活躍的線粒體生物發生導致活性氧(ROS)的積累,這部分是PGC1α介導的腫瘤增殖和凋亡的原因[18]。而PGC1α在體外和體內增強了索拉非尼/多柔比星的敏感性,預示著PGC1α可作為預后生物標志物。此外,最近的證據顯示PGC1α通過代謝能量學和TGFβ1介導的轉錄軸與肺纖維化密切相關。
線粒體蛋白VDAC1是代謝和能量穩態的關鍵調節因子,有助于癌細胞的代謝[19]。VDAC1作為一個通道,允許離子、核苷酸、Ca2+和其他5 kDa以下的代謝物(如丙酮酸、蘋果酸、琥珀酸、NADH/NAD等等)流出和進入線粒體,從而調控線粒體的功能[20]。肺癌組VDAC1的高表達率高于肺部良性疾病組,提示VDAC1可作為肺癌的標志物。有研究發現VDAC1參與腫瘤增殖、轉移和侵襲[21],而VDAC1在不同惡性腫瘤的預后起著有爭議的作用。例如,在子宮頸癌中,VDAC1的高表達與間質浸潤、腫瘤大小、復發率、總生存期有關,但在膽管癌中的研究與之相反[22,23]。這些相互矛盾的結果表明了VDAC1表達在不同類型癌癥中的不同影響,可能需要進一步研究探索。本研究結果顯示,VDAC1在肺癌中的高表達與TNM分期、淋巴結轉移、遠處轉移呈正相關,提示VDAC1可能參與了腫瘤生長和侵襲,與其在乳腺癌、結直腸癌、胰腺癌中的結果一致[24,25]。此外,Zhang等研究發現敲低VDAC1可以阻止癌細胞的增殖和遷移[26]。VDAC1高表達患者術后3年的生存率低于其低表達,提示VDAC1高表達與肺癌患者預后較差有關。
PGC1α通過調控線粒體生物生成促進腫瘤細胞的氧化代謝,而VDAC1促進腫瘤生長和抑制細胞凋亡,兩者均與腫瘤細胞的增殖密切相關。肺癌組織中的PGC1α表達與VDAC1表達呈極強正相關,提示PGC1α和VDAC1二者相互作用,共同促進癌細胞的增殖。
綜上所述,PGC1α和VDAC1在肺癌中高表達,可能與癌細胞的增殖和遷移密切相關,可作為肺癌診斷和不良預后的重要標志物。

