單核苷酸多態性和免疫細胞在糖尿病腎臟疾病中的研究進展
郭夢然,閔 行,葉 月,許曉雙,甄東戶
(1.蘭州大學 第一臨床醫學院 內分泌科, 甘肅 蘭州 730030; 2.蘭州大學第一醫院 內分泌科, 甘肅 蘭州 730030)
近年來,中國糖尿病腎臟疾病(diabetic kidney disease,DKD)的患病率不斷上升,由2001年的34.7%到2017年的20%~40%[1]。仍然是終末期腎臟疾病(end stage renal disease,ESRD)最常見原因及死亡原因[2]。DKD的發病涉及糖脂代謝紊亂、氧化應激、血流動力學異常、炎性因子及遺傳易感因素等。其中對遺傳易感基因的單核苷酸多態性(single nucleotide polymorphisms,SNPs)研究為預測DKD發病及進展提供新的思路,以便早期發現DKD高危人群, 對實現DKD早期預測和防治具有重要意義;再者,DKD又是一種炎性反應性疾病,最終導致結構重塑和腎臟纖維化, 其中免疫細胞的作用不可忽視,T細胞和2型固有淋巴細胞(type-2 innate lymphoid cell,ILC2)分泌細胞因子參與腎臟慢性炎性反應。這將進一步豐富DKD的病理生理機制。
1 遺傳易感基因
在慢性疾病的發病中基因與環境交互作用,有助于解釋人群易感性差異的原因,進而可以對環境與疾病、基因與疾病的關系有深入的認識,遺傳因素可以通過影響腎臟對環境因素的反應性來增加DKD的易感性[3]。確定DKD的易感基因不僅有助于從分子水平認識其發病機制,同時還可能篩選出高危人群,以利于早期診斷及防治,甚至進行基因治療。
1.1 吞噬和細胞運動性1基因(ELMO1)多態性與DKD的患病風險的關系
其位于7號染色體短臂1區4帶(7p14),編碼一種可溶性細胞質蛋白,在哺乳動物細胞凋亡和細胞吞噬過程中介導細胞骨架重排。首次在日本T2DM患者中篩選出ELMO1基因,隨后在腎小管和腎小球上皮細胞中檢測到ELMO1編碼蛋白的表達,在糖尿病小鼠的腎臟中該蛋白表達明顯升高;并且ELMO1的過量表達導致細胞外基質(extracellular matrix,ECM)基因表達增加和基質金屬蛋白酶(matrix metalloproteinase,MMP)基因表達減少[4],提示持續過表達的ELMO1會使細胞外基質蛋白過度積累,擠壓閉塞毛細血管、減少濾過面積,破壞腎臟細胞導致組織重塑,加速糖尿病性腎小球硬化的發生和發展。后來,在伊朗人群[5]、南印度人群[6]和中國漢族人群中ELMO1作為DKD易感基因的關鍵作用已得到驗證。其中ELMO1rs741301是研究最多的風險位點:證實是伊朗人群DKD易感性的重要候選基因,同樣在南印度人群與DKD顯著相關;ELMO1rs741301與馬來西亞人群[7]DKD的易感性無關,在美洲印第安人群中ELMO1rs1345365而非rs741301與DKD風險相關。在1 000人中國漢族的樣本[8]中發現ELMO1rs741301-G等位基因和rs10255208-GG基因型與DKD風險增加相關;同時發現了顯著的rs741301和飲酒之間的基因-環境相互作用組合:擁有rs741301-AG / GG基因型的飲酒者的DKD風險增加。盡管中國56個種族,但漢族人群基數大,仍具有代表性,這為進一步研究中國人群中其他風險位點和基因-環境相互作用提供了參考。
1.2 溶質載體家族12成員3/氯化鈉共轉運蛋白基因(solute carrier family 12 member 3,SLC12A3)與DKD及進展的關系
其在腎臟中特異性表達,編碼噻嗪類敏感的Na-Cl協同轉運蛋白(Na-Cl cotransporters,NCC),是遠曲小管吸收鹽的關鍵轉運蛋白[9]。全基因組關聯分析(GWAS)中SLC12A3基因是DKD的易感基因。在人類中,SLC12A3是包含26個外顯子的55 kb基因,編碼的NCC具有1 002~1 028個氨基酸殘基,其中第23個外顯子Arg913Gln次要等位基因突變(密碼子發生G→A的轉換),使得913位點的精氨酸(Arg)變為谷氨酰胺(Gln)[10]。G/ A在不同人群對DKD表現出不同的作用:日本人群中外顯子23與DKD顯著相關,突變體A與微量白蛋白尿的發展和(或)向大量白蛋白尿的進展呈負相關;而在韓國朝鮮族人群發現,突變體A與DKD發展進展呈正相關[11]。與韓國人或日本人的結果不同,SLC12A3基因的遺傳變異與白種人T2DM患者的DKD敏感性沒有顯著相關性。顯然,Arg913Gln變異對不同種族DKD發病機制的影響仍存在爭議。調查中國T2DM患者SLC12A3中 Arg913Gln變異與ESRD風險之間的關系[12],結果支持韓國人群的發現,而與日本人群相反:在對照組(未透析DKD),GA + AA攜帶者的尿白蛋白排泄率(UAER)和舒張壓明顯高于GG攜帶者,推測A等位基因可能通過增加中國T2DM患者的UAER、升高血壓來增加DKD風險;DKD-ESRD組(由T2DM引起的ESRD,接受血液透析)的GA + AA基因型頻率顯著高于對照組。這是首次在中國人群中的病例對照研究,使GA + AA基因型用于預測T2DM患者DKD-ESRD的發生和發展成為可能。
2 免疫細胞在DKD中扮演的角色
免疫過程與炎性反應相互調節,當兩者不能及時終止時,即產生病理損害[13]。免疫調節在DKD的發生和發展中所起的重要作用現在是無可爭議的。這種調節包括增加免疫細胞向腎臟的聚集、促炎性細胞因子和趨化因子的產生、免疫復合物的形成以及補體的活化[14]。許多研究證實腎臟慢性炎性反應過程中T細胞及細胞因子過度募集,同時一類可以分泌細胞因子的固有淋巴細胞(innate lymphoid cell,ILC)逐漸走入研究者的視線。
2.1 T淋巴細胞通過慢性炎性反應途徑促進DKD發生
T細胞主要分為CD4和CD8亞群,CD4細胞又根據分泌細胞因子及功能不同分為輔助性T細胞(T-helper Th1、Th2、Th17等)、調節性T細胞(T-regulatory,Treg)。DKD患者高糖狀態下招募單核細胞和T淋巴細胞到腎組織,與腎實質細胞相互作用分泌一系列促炎因子引發腎組織的慢性炎性反應和腎間質纖維化[15],誘導腎肥大和超濾,從而加速DKD的病程(圖1)。CD8細胞與胰島素抵抗:在高脂飲食的小鼠中,觀察到CD8細胞的浸潤現象先于巨噬細胞積累,一旦使用特異性抗體耗盡了CD8 細胞,則巨噬細胞浸潤、脂肪組織炎性反應和全身胰島素抵抗得到改善;還發現脂肪組織激活CD8細胞,然后促進該組織中巨噬細胞的募集和激活。這提示CD8 細胞在脂肪組織炎性反應和全身性胰島素抵抗的引發和維持中起著重要作用[16]。CD4細胞亞型在DKD中的作用: 研究發現與非DKD患者相比,DKD患者血清Th1細胞因子(IFN-γ和IL-2)水平升高,蛋白尿與IFN-γ和IL-2存在顯著的正相關,eGFR與血漿IFN-γ之間呈負相關,表明Th1細胞因子參與DKD患者的組織損傷。DKD患者血清中的Th2細胞因子(IL-10)水平升高,并且提示IL-10水平與蛋白尿之間存在相關關系[17]。DKD患者尿蛋白/肌酐與 Treg細胞比例呈負相關,T2DM和DKD患者Treg細胞水平下降,血肌酐和血尿素氮與 Treg細胞呈負相關[18],證實了Treg細胞在糖尿病及其腎臟損害中的重要作用。T淋巴細胞通過分泌多種促炎性細胞因子,激活或招募其他免疫炎性細胞參與DKD發病。不同T細胞亞型之間相互調節,一旦平衡打破就會產生組織及器官的損害,涉及調節免疫應答的分子機制,將會為治療DKD提供新的依據。
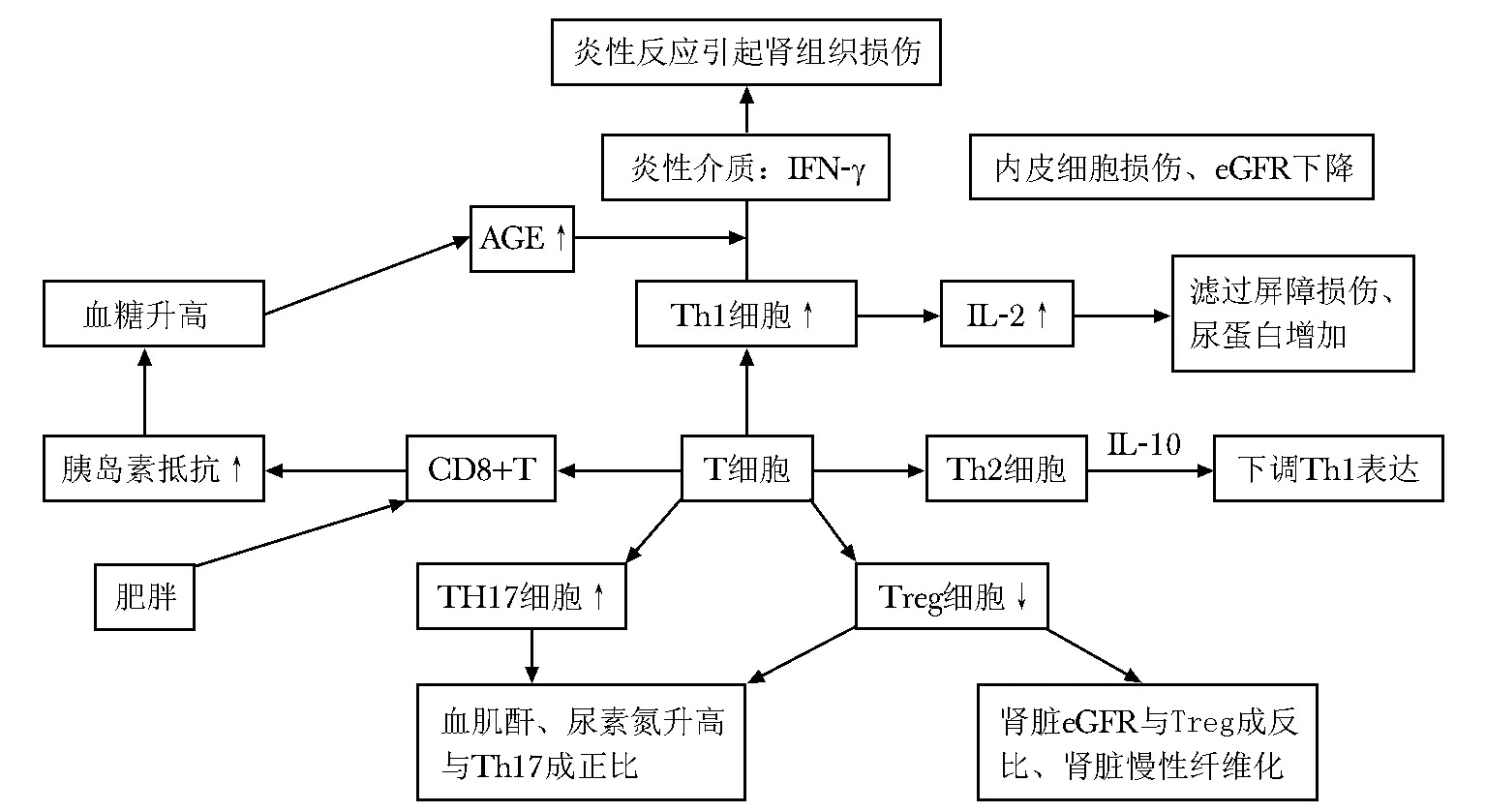
圖1 T細胞與腎臟損傷Fig 1 T cells and kidney injury
2.2 組織修復過猶不及-2型固有淋巴細胞(ILC2)
固有淋巴細胞(innate lymphoid cell,ILC)是由共同淋巴樣祖細胞發育而來的一種非B、非T細胞的新型淋巴細胞,不表達譜系發育分子(lineage,Lin-)也不表達抗原特異性受體(TCR或BCR)。ILCs細胞多為組織駐留淋巴細胞,分布于腸道、皮膚、肺臟等黏膜屏障部位,參與黏膜免疫的形成、淋巴細胞的發育、組織損傷的修復及上皮屏障的保護作用[19]。一旦其數量或功能異常,將參與炎性反應、免疫性疾病、代謝性疾病、哮喘和過敏[20]等疾病的發生發展。在T、B淋巴細胞缺陷的RAG基因敲除小鼠(recombination activating gene,RAG)中發現ILC2,ILC2受Il-33刺激后分泌細胞因子IL-4、IL-5、IL-9和IL-13等參與肝纖維化和肺纖維化[21]。
近來也發現其在腎臟疾病尤其是DKD的機制中發揮重要作用[22]。探究ILC2對腎臟影響的研究表明,與對照組的缺血再灌注損傷(ischemia reperfusion injury,IRI)小鼠相比,IL-33治療的IRI小鼠血清和腎臟中的IL-4和IL-13水平升高,并且ILC2、Treg和巨噬細胞增多;小鼠模型中離體擴增的人ILC2轉移可改善腎IRI,但長期會引起腎臟纖維化[23-24]。后來觀察到DKD患者與單純T2DM相比:ILC2百分比顯著升高、IL-5、IL-13升高、腰圍、空腹血糖、舒張壓和三酰甘油升高,推測ILC2可能通過影響血壓和脂質代謝參與糖尿病腎臟損害[25]。為探究ILC2參與DKD的途徑[26]:與對照組(無DM的健康志愿者)相比,DM組、DKD組外周血中ILC2及細胞因子IL-4、IL-5、IL-13明顯增加,IL-4刺激可以以濃度依賴性和時間依賴性的方式促進TGF-β1(transforming growth factor-β1,TGF-β1)的表達;并且觀察到晚期DKD上述指標明顯高于早期DKD。ILC2在器官纖維化中的重要作用,為延緩DKD進展提供了新的治療思路,以期應用免疫抑制及靶向藥物延緩腎臟纖維化。
3 問題與展望
ELMO1rs741301和飲酒之間的基因-環境相互作用組合,為未來研究更多基因環境組合提供參考,SLC12A3為預測白蛋白尿進展風險提供可能,盡管SNP與疾病并不是簡單“一對一”關系,但隨著對SNP研究的不斷深入,未來在明確SNP與DKD相關性的基礎上, 可對穩定的SNP進行檢測, 反映機體罹患DKD的風險。腎臟的慢性炎性反應始終是DKD的重要病理生理基礎,T細胞亞群在胰島素抵抗和腎臟炎性反應中起重要作用,ILC2細胞影響脂質代謝、參與腎臟纖維化,抑制免疫細胞可以改善胰島素抵抗、脂質代謝和腎臟炎性反應,故未來針對免疫細胞的抑制劑及靶向治療,將為治療DKD提供新的思路。

