干擾TRIAP1表達增強口腔鱗狀細胞癌細胞對順鉑敏感性實驗研究
林興偉,戚新春
(1.空軍軍醫大學第三附屬醫院急診與綜合臨床科,陜西 西安 710032;2.陜西省腫瘤醫院頭頸腫瘤科,陜西 西安 710061)
口腔鱗狀細胞癌(Oral squamous cell carcinoma,OSCC)是最常見的腫瘤之一,占口腔癌的90%[1]。盡管OSCC治療方法取得了一些進展,但其5年生存率未顯示出顯著改善[2]。順鉑(Cisplatin,DDP)通過形成DDP-DNA加合物來誘導細胞毒性,是OSCC的一線臨床化療藥物[3]。然而,獲得性耐藥大大阻礙了DDP的治療效果。研究[4]顯示細胞增殖、凋亡和上皮間質轉化等均與化療耐藥有關,化療耐藥仍然是腫瘤治療的難點,克服對DDP的耐藥性仍然是世界范圍內的挑戰。因此,研究DDP耐藥過程中的關鍵基因是探尋OSCC潛在治療靶點的新途徑。腫瘤蛋白53調控的細胞凋亡抑制劑1(Tumor protein 53-regulated inhibitor of apoptosis 1,TRIAP1)是一種進化保守的蛋白,受腫瘤蛋白53(TP53)的調控[5]。TP53是眾所周知的腫瘤抑制因子,而TRIAP1在陰莖癌、肺癌和多發性骨髓瘤等多種腫瘤中發揮促癌基因的作用,調控腫瘤細胞的增殖和凋亡等生物學過程[6-8]。并且研究[9-10]顯示:TRIAP1與卵巢癌和前列腺癌等腫瘤的放化療抵抗密切相關,Na等[11]報道TRIAP1促進OSCC細胞的增殖和遷移,但是TRIAP1與OSCC的化療耐藥是否相關未知,因此本文對TRIAP1與OSCC細胞順鉑敏感性的關系進行了研究,旨在獲得TRIAP1作為逆轉OSCC DDP耐藥有效靶點的依據。
1 材料與方法
1.1 實驗材料 OSCC細胞系Cal-27細胞,美國ATCC細胞庫;DMEM高糖基礎培養基、胎牛血清和胰蛋白酶,美國Gibco試劑公司;DDP,美國Sigma試劑公司;TRIAP1干擾慢病毒,中國上海吉凱基因試劑有限公司;RIPA裂解液,美國Thermo公司;蛋白上樣緩沖液和BCA檢測蛋白濃度試劑盒,中國上海碧云天試劑有限公司;PVDF膜,美國millipore公司;BSA試劑,中國北京索萊寶試劑公司;TRIAP1、Caspase 9、Caspase 3、P-gp、ABCG2和GAPDH抗體,英國Abcam公司;ECL化學發光試劑盒,中國大連Meilunbio?試劑公司;MTS試劑,美國Biovision試劑公司;Annexin V-PE/7AAD凋亡檢測試劑盒,中國南京凱基生物技術有限公司。
1.2 實驗方法
1.2.1 細胞培養:液氮中取出的OSCC細胞系Cal-27,快速放入37 ℃水浴鍋中進行復蘇。離心后棄掉凍存液重懸至含有10%胎牛血清的DMEM高糖培養基中。放置37 ℃、5% CO2的全濕度培養箱中培養。顯微鏡下觀察細胞狀態,及時更換新鮮培養基。細胞長滿時,PBS洗1次,加入胰酶,消化細胞進行傳代。
1.2.2 DDP-Cal-27細胞的構建:將Cal-27細胞分次暴露于濃度不斷遞增的DDP中進行耐藥誘導,當細胞能夠在含有一定濃度DDP的培養基中正常分裂時,終止DDP的遞增濃度處理。這些細胞被命名為DDP耐藥細胞Cal-27(DDP-Cal-27)。將具有相似傳代數的Cal-27細胞用作對照,并鑒定細胞對DDP的抵抗性。
1.2.3 MTS檢測DDP-Cal-27細胞對DDP的敏感性:Cal-27和DDP-Cal-27細胞以每孔2000個細胞接種至96孔板中,每組包含6個復孔,接種12 h后分別加入不同濃度的DDP(0、1.25、2.5、5、10、20、40、80 μmol/L)進行處理。培養48 h后加入20 μl的MTS試劑孵育2 h,采用酶標儀檢測細胞在490 nm處的OD值(吸光度)。不同DDP濃度組細胞存活率=(相應DDP濃度組細胞平均OD值/DDP 0濃度組細胞平均OD值)×100%。計算細胞存活率為50%時所對應的DDP濃度(IC50)。
1.2.4 Western blot法:將待檢測的細胞PBS洗3次后,加入RIPA蛋白裂解液,均勻覆蓋細胞面,冰上裂解10 min。刮刀收集細胞至EP管中,12000 r/min、4 ℃離心30 min,棄掉細胞碎片,獲得細胞總蛋白。采用BCA試劑盒測得蛋白濃度,加入上樣緩沖液,沸水中沸煮5 min后進行蛋白變性。蛋白上樣進行80 V凝膠電泳(SDS-PAGE)分離蛋白,350 mA濕轉進行PVDF膜上。8% BSA室溫孵育1 h,目的一抗4 ℃孵育過夜,二抗室溫孵育2 h,ECL試劑盒曝光蛋白條帶。Image軟件測量蛋白條帶灰度值。
1.2.5 細胞轉染:DDP-Cal-27細胞長滿時,PBS洗1次,加入胰酶,消化細胞進行計數,以1×105個細胞接種至6孔板中,分為sh-NC組和sh-TRIAP1組。貼壁12 h后,無關干擾序列慢病毒與病毒感染增強液混勻后加至sh-NC組細胞中,TRIAP1干擾慢病毒與病毒感染增強液混勻后加至sh-TRIAP1組細胞中,感染8 h后,更換新鮮完全培養基。繼續培養48 h后,采用Western blot檢測各組細胞中TRIAP1蛋白的表達,采用MTS檢測sh-NC組和sh-TRIAP1組細胞對DDP的敏感性。
1.2.6 平板克隆實驗檢測細胞克隆形成:sh-NC組和sh-TRIAP1組細胞長滿時,PBS洗1次,加入胰酶,消化細胞進行計數,以500個細胞接種至6孔板中,每組設置3個重復孔。加入IC50值濃度的DDP處理sh-NC組和sh-TRIAP1組細胞48 h。培養2周左右,肉眼可見細胞克隆團形成時,PBS洗兩次,甲醇溶液固定細胞10 min,吉姆薩染色10 min,雙蒸水洗3洗,晾干后進行細胞克隆計數。
1.2.7 流式細胞儀檢測細胞凋亡率:sh-NC組和sh-TRIAP1組細胞長滿時,PBS洗1次,加入胰酶,消化細胞進行計數,以1×105個細胞接種至6孔板中,每組設置3個重復孔。加入IC50值濃度的DDP處理sh-NC組和sh-TRIAP1組細胞48 h。加入無EDTA的胰酶消化收集細胞,PBS洗3次后,采用Annexin V-PE/7AAD染色試劑盒,加入500 μl染色緩沖液重懸細胞,并依次加入5 μl的Annexin V-PE 和5 μl AAD染色液混勻,常溫孵育10 min,流式細胞儀上機檢測細胞凋亡情況,計算各組細胞平均凋亡率。
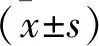
2 結 果
2.1 DDP-Cal-27細胞的構建 DDP濃度遞增法誘導建立DDP耐藥型細胞株DDP-Cal-27,并采用MTS檢測Cal-27和DDP-Cal-27細胞對DDP 48 h的IC50值,結果顯示在相同濃度的DDP作用下,DDP-Cal-27細胞的存活率顯著高于Cal-27細胞的存活率(P<0.05),Cal-27細胞的DDP IC50值為(5.77±0.96) μmol/L,DDP-Cal-27細胞的DDP IC50值為(11.63±1.58) μmol/L。與Cal-27細胞相比,DDP-Cal-27細胞的DDP IC50值增加(P<0.05)。見圖 1。

圖1 Cal-27和DDP-Cal-27細胞對DDP 48 h的IC50值
2.2 TRIAP1在DDP-Cal-27中的表達 Western blotting檢測結果顯示TRIAP1在Cal-27細胞中的相對表達量為(0.76±0.22),在DDP-Cal-27細胞中的相對表達量為(1.37±0.29),與DDP敏感性細胞Cal-27相比,TRIAP1在DDP耐藥性細胞DDP-Cal-27中的表達增加(t=2.98,P=0.024),見圖2。

注: 與Cal-27比較,*P<0.05
2.3 TRIAP1干擾慢病毒感染效果 TRIAP1干擾慢病毒感染DDP-Cal-27細胞,Western blot檢測結果顯示TRIAP1在sh-NC組細胞中TRIAP1的表達量為(0.99±0.16),在sh-TRIAP1組細胞中的表達量為(0.13±0.08),與sh-NC相比,sh-TRIAP1組細胞中TRIAP1的表達降低(t=5.58,P=0.013),見圖 3。

注:與sh-NC組比較,*P<0.05
2.4 干擾TRIAP1對DDP-Cal-27細胞DDP敏感性的影響 sh-NC組和sh-TRIAP1組DDP-Cal-27組細胞經不同濃度的DDP處理,培養48 h后MTS結果顯示在相同濃度的DDP處理下,sh-TRIAP1組細胞的存活率顯著低于sh-NC組細胞的存活率(P<0.05),sh-NC組細胞的DDP IC50濃度為(10.53±1.36) μmol/L,sh-TRIAP1組細胞的DDP IC50濃度為(8.46±0.85)μmol/L,與sh-NC組相比,sh-TRIAP1組細胞的DDP IC50濃度降低(P<0.05),見圖 4。

圖4 干擾TRIAP1對DDP-Cal-27細胞DDP敏感性的影響
2.5 干擾TRIAP1對DDP處理的DDP-Cal-27細胞克隆形成的影響 sh-NC組和sh-TRIAP1組DDP-Cal-27組細胞經DDP處理48 h后,平板克隆實驗結果顯示sh-NC組細胞克隆形成數目為(65.67±5.51)個,sh-TRIAP1組細胞克隆形成數目為(41.33±3.21)個,與sh-NC組相比,sh-TRIAP1組細胞的克隆形成能力降低(t=6.61,P=0.003),見圖 5。

注:與sh-NC組比較,*P<0.05
2.6 干擾TRIAP1對DDP處理的DDP-Cal-27細胞凋亡的影響 sh-NC組和sh-TRIAP1組DDP-Cal-27組細胞經DDP處理48 h后,流式細胞實驗結果顯示sh-NC組細胞凋亡率為(3.68±0.32),sh-TRIAP1組細胞凋亡率為(12.89±0.54),與sh-NC組相比,sh-TRIAP1組細胞的凋亡率增加(t=7.05,P=0.001),見圖 6。

圖6 干擾TRIAP1對DDP處理的DDP-Cal-27細胞凋亡的影響
2.7 干擾TRIAP1對DDP處理的DDP-Cal-27細胞凋亡相關蛋白的影響 sh-NC組和sh-TRIAP1組DDP-Cal-27組細胞經DDP處理48 h后,Western blot結果顯示與sh-NC組相比,sh-TRIAP1組細胞中凋亡蛋白Caspase 9和Caspase 3蛋白的表達增加(P<0.05),見圖 7。
2.8 干擾TRIAP1對DDP處理的DDP-Cal-27細胞耐藥相關蛋白的影響 sh-NC組和sh-TRIAP1組DDP-Cal-27組細胞經DDP處理48 h后,Western blot結果顯示與sh-NC組相比,sh-TRIAP1組細胞中耐藥相關蛋白P-gp和ABCG2蛋白表達降低(P<0.05),見圖 8。

注: 與sh-NC組比較,*P<0.05

注: 與sh-NC組比較,*P<0.05
3 討 論
OSCC是頭頸部惡性腫瘤中最具侵襲性的腫瘤之一,惡性程度較高,與5年生存率為89%的乳腺癌和99%的前列腺癌相比,OSCC患者的5年生存率是非常低的,僅為62%,在晚期患者中不到20%[2]。OSCC的治療手段包括外科手術、放射療法和化學療法,其中化學療法是OSCC患者的有效輔助療法,并取得了重大進展。但是腫瘤細胞對化療藥物的耐藥性限制了OSCC患者的治療選擇,導致OSCC患者的預后仍然較差[12]。DDP是一種烷基化化學治療劑,能夠形成DNA加合物和交聯,導致細胞G2/M檢查點的有絲分裂停滯,細胞增殖受限。基于DDP的化學療法是治療局部晚期或轉移性OSCC的標準一線療法[3]。DPP在OSCC治療中獲得耐藥性受到越來越多的關注,了解DDP耐藥的潛在分子機制并尋找OSCC的新型治療靶點具有重要意義。
化療藥物抗腫瘤治療主要是通過誘導細胞凋亡和細胞周期阻滯等發揮作用,研究報道與細胞凋亡和周期調控密切相關的TRIAP1通過在細胞質中結合熱休克蛋白70(HSP70)或抑制TP53靶基因細胞周期蛋白依賴性激酶抑制劑1(p21)來抑制細胞凋亡,同時TP53靶基因的消耗會減慢細胞周期進程[13]。因此TRIAP1可能是參與化療抵抗的重要基因之一。TRIAP1是一種長度為76個氨基酸的9 kDa小蛋白,也稱為TP53誘導的細胞存活因子或TP53CSV。TRIAP1被TP53轉錄激活,是細胞對TP53激活反應的特定途徑調節劑[5]。研究顯示TRIAP1在陰莖癌中高表達,并與高的組織學分級和局部復發率顯著相關,是患者復發和預后不良的潛在預測因子[6]。在多發性骨髓瘤中抑制 TRIAP1的表達后,細胞的凋亡增加[8]。而在卵巢癌、前列腺癌和非小細胞肺癌中TRIAP1的表達與腫瘤細胞的放化療抵抗相關[9-10,14],其中在卵巢癌中干擾TRIAP1的表達后增加卵巢癌細胞對DDP的敏感性。已有文獻報道TRIAP1促進OSCC細胞的增殖和遷移能力[11],但是TRIAP1與OSCC對DDP敏感性的關系未知。首先本文采用濃度遞增的方法誘導DDP耐藥OSCC細胞株,并采用MTS檢測DDP耐藥細胞株構建成功后,Western blotting檢測TRIAP1在DDP耐藥OSCC細胞株中的表達,結果顯示與相同傳代數的OSCC細胞Cal-27相比,TRIAP1在DDP耐藥細胞株DDP-Cal-27中的表達增加,提示TRIAP1與OSCC對DDP的敏感性有關。并進一步在DDP耐藥OSCC細胞株中感染TRIAP1干擾慢病毒,MTS和平板克隆實驗顯示抑制TRIAP1的表達后,DDP-Cal-27細胞對DDP的敏感性增加。
研究顯示TRIAP1抑制肺癌和多發性骨髓瘤細胞的凋亡[7-8],而腫瘤細胞獲性得耐藥的重要機制是規避細胞凋亡,本文采用流式細胞儀檢測發現抑制TRIAP1的表達后DDP處理的DDP-Cal-27細胞凋亡率增加,提示TRIAP1是通過調控細胞凋亡在OSCC細胞DDP耐藥中發揮作用,但其具體的機制需進一步探討。線粒體凋亡蛋白是細胞凋亡的核心,被認為在凋亡途徑的調節中起著至關重要的作用,同時也是細胞凋亡發生的重要表型[15],已有研究報道TRIAP1通過抑制細胞色素C與凋亡蛋白酶激活因子1的相互作用進而激活下游分子Caspase 9凋亡途徑,從而通過抑制細胞凋來增加細胞耐藥性[9]。Caspase蛋白家族調控的細胞凋亡途徑是重要的線粒體凋亡途徑,細胞受到凋亡刺激信號時,Caspase 9構成多聚體自身激活,并促進下游信號分子Caspase 3蛋白的激活,Caspase 3的激活是凋亡發生不可逆轉的重要標志,進而引發級聯反應[16]。本研究抑制TRIAP1的表達后,DDP-Cal-27細胞中激活的Caspase 9和Caspase 3蛋白表達增加,表明干擾TRIAP1的表達促進Caspase凋亡蛋白的激活誘導細胞凋亡的發生進而增加DDP-Cal-27細胞對DDP的敏感性。耐藥相關蛋白表達增加在腫瘤細胞耐藥中同樣發揮至關重要的作用,其中P-gp可以將藥物從細胞內泵出細胞外,以維持腫瘤細胞內的藥物濃度,降低化療療效[17]。ABCG2蛋白屬于轉運蛋白,以消耗ATP的方式將化學藥物轉運至細胞外,發揮耐藥作用[18-20]。本研究發現抑制TRIAP1的表達后,DDP-Cal-27細胞中P-gp和ABCG2蛋白的表達減少,提示TRIAP1調控耐藥相關蛋白參與OSCC細胞的DDP耐藥。
綜上所述,干擾TRIAP1的表達增加OSCC細胞對DDP的敏感性,可能是通過調控凋亡蛋白和耐藥相關蛋白發揮作用。TRIAP1是逆轉OSCC化療耐藥和治療的潛在分子靶點。

