α-突觸核蛋白與帕金森病伴發快速眼動期睡眠行為障礙相關性研究
趙曉娟,權青云,孟宏濤,張 愉
(武警陜西省總隊醫院,陜西 西安 710054)
帕金森病屬于神經系統變性疾病,好發于老年人群,該病患者的主要運動癥狀為靜止性震顫、肌強直、運動遲緩以及步態姿勢異常等[1-3]。在帕金森病患者的非運動癥狀中以睡眠障礙較為常見,據統計約有1/3的帕金森病伴發快速眼動期睡眠行為障礙(Rapid eye movement sleep behavior disorder,RBD)。RBD是一種異態睡眠,是指患者在夜間深眠狀態下伴隨的與夢境相關的快速眼動睡眠期肌肉遲緩現象消失的復雜性運動,嚴重可能傷害到患者自身甚至床伴,對患者及其家屬的生活質量產生了嚴重的威脅[4-6]。研究證實患者腦黑質多巴胺能神經元的缺失以及黑質殘存神經元內路易小體的出現是帕金森病的主要病理改變。路易小體作為帕金森病的主要診斷特征,其主要成分α-突觸核蛋白經證實與帕金森病的發生發展過程密切相關,大量研究[7-8]指出,α-突觸核蛋白的異常聚集在帕金森病的病理級聯反應中扮演重要角色。目前國內關于α-突觸核蛋白的研究主要集中在其與帕金森病的相關性研究,少見與帕金森病患者伴發RBD相關性研究,為此,本研究以70例帕金森病患者為研究對象,探討其血漿及唾液中α-突觸核蛋白表達水平與患者伴或不伴RBD之間的相關性,旨在為RBD的早期識別與防治積累數據。
1 對象與方法
1.1 研究對象 選取2019年6月至2020年11月期間我院收治的70例帕金森病患者為研究對象。根據REM睡眠行為異常問卷評分結果將70例帕金森病患者分為帕金森病伴發RBD組(PD+RBD組,n=26)、帕金森病不伴RBD組(PD-RBD組,n=44)。病例納入標準:①符合診斷標準的帕金森病患者;②年齡>60歲,性別不拘;③Hoehn-Yahr(H-Y)分期為1~4期;④同意采集 EDTA 抗凝血樣;⑤臨床資料完整者。排除標準:①繼發性帕金森病患者;②臨床癡呆量表評分≥1分者;③影像學檢測提示腦內器質性病變者;④合并惡性腫瘤患者;⑤嚴重焦慮、抑郁及精神分裂癥患者;⑥臨床資料不全者。
1.2 研究方法
1.2.1 血漿及唾液中α-突觸核蛋白含量測定:血漿及唾液樣本采集前,受試者禁食、禁水12 h、禁煙4 h、禁酒12 h,經污染的樣本需重新采集。每位患者各取唾液、血漿樣本各3 ml,唾液樣本在采集人員的指導下直接流入無菌試管,血漿樣本搜集至無菌試管內后,采用低溫高速離心機以17 000 r/min的轉速離心30 min,取上清液,置于新的干凈試管內,血清及唾液樣本均保存于-80 ℃冰箱中待測。α-突觸核蛋白表達水平采用雙抗體夾心法進行測定:將微孔板以經純化的人α-突觸核蛋白抗體進行包被,制作成為固相抗體;將α-突觸核蛋白依次加入經單抗包被的微孔內,隨后與α-突觸核蛋白抗體(經辣根過氧化物酶標記)相結合后形成抗體-抗原-酶標抗體復合物;徹底洗滌后加入底物3,3’、5,5’-四甲基聯苯胺(TMB)進行顯色;在辣根過氧化物酶的催化下TMB可被轉化為藍色,在酸的作用下轉化可最終轉化為黃色,采用酶標儀測定450 nm波長處樣品的測吸光度(OD)值,血漿及唾液中α-突觸核蛋白濃度根據標準曲線進行計算。檢測試劑購自中國博研公司,操作步驟嚴格按照說明書進行。
1.2.2 睡眠質量評估:采用Epworth嗜睡評分量表(ESS)評估兩組受試者白天過度的狀態,此量表總分為24分,具體判定標準如下:>6分,代表患者瞌睡;>11分,代表過度瞌睡;>16分,代表存在危險性的瞌睡。
1.2.3 焦慮抑郁狀態評估:分別采用漢密爾頓抑郁量表(HAMD)、漢密爾頓焦慮量表(HAMA)評估兩組受試者抑郁、焦慮狀況。HAMD評分包含焦慮/軀體化、體重、絕望感、日夜變化、認識障礙、睡眠障礙、阻滯共計7種因子,評分越高,表示患者抑郁狀況越嚴重。HAMA評分包含軀體性焦慮因子以及精神性焦慮因子兩大類,分數越高,表示患者焦慮狀況越嚴重,具體判定標準如下:≥29分,提示存在嚴重焦慮;≥21分,提示存在明顯焦慮;≥14分,提示存在焦慮;≥7分,提示可能存在焦慮;<7分,無焦慮癥狀。
1.2.4 運動功能評估:采用統一帕金森病量表Ⅲ(UPDRS Ⅲ)、Hoehn-Yahr(H-Y)分期評價兩組受試者的運動能力。UPDRS Ⅲ量表包括以下14個部分:言語表達、面部表情、手的動作震顫/姿勢震顫、靜止性震顫、手指捏合、肌僵直、手部運動能力、手部快速交替運動、腿部靈活性、姿勢、起立、步態、姿勢的穩定性、軀體少動。H-Y分期標準:1期,單邊/側身體受到影響,平衡未受影響;2期,雙邊/側受到影響,平衡未受影響;3期,平衡受到影響,患者仍能夠獨立生活;4期,患者活動能力嚴重喪失,仍能夠站立或獨立行走;5期,無他人幫助的前提下,僅能坐輪椅或臥床。
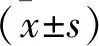
2 結 果
2.1 兩組患者一般資料比較 兩組患者性別、年齡、起病年齡等比較差異無統計學意義(均P>0.05),PD+RBD組病程明顯長于PD-RBD組,兩組比較差異具有統計學意義(P<0.05),見表1。

表1 兩組患者一般資料比較
2.2 兩組患者血漿及唾液中α-突觸核蛋白含量比較 PD+RBD組血漿α-突觸核蛋白含量明顯高于PD-RBD組、唾液中α-突觸核蛋白含量明顯高于PD-RBD組,兩組間比較差異均有統計學意義(均P<0.05),見表2。

表2 兩組患者血漿及唾液中α-突觸核蛋白含量比較(ng/L)
2.3 兩組患者睡眠狀況比較 PD+RBD組ESS評分明顯高于PD-RBD組,兩組比較差異具有統計學意義(P<0.05),見表3。

表3 兩組患者睡眠狀況比較(分)
2.4 兩組患者焦慮、抑郁狀態比較 PD+RBD組HAMD評分及HAMA評分明顯高于PD-RBD組,兩組比較差異均有統計學意義(均P<0.05),見表4。

表4 兩組患者焦慮、抑郁狀態比較(分)
2.5 兩組患者運動功能比較 兩組UPDRS Ⅲ評分比較無統計學差異(P>0.05),PD+RBD組H-Y分期明顯高于PD-RBD組,兩組比較差異具有統計學意義(P<0.05),見表5。

表5 兩組受試者運動功能比較
2.6 帕金森病患者伴發RBD相關因素Logistic回歸分析 Logistic多因素回歸分析結果顯示,病程、α-突觸核蛋白含量與帕金森患者伴發RBD顯著相關(P<0.05),見表6。

表6 帕金森病患者伴發RBD相關因素Logistic回歸分析
3 討 論
RBD是一種神經變性疾病,為帕金森病等多種突觸核蛋白病的前驅癥狀及危險因素[9]。研究表明,RBD患者5年內帕金森病的患病風險約為20%~45%,10年內患病風險高達40%~65%。國外研究團隊對貓RBD模型進行研究發現,其雙側腦橋鄰近藍斑的區域受損后可使得REM睡眠期的肌肉失張力消除,導致貓的行走等多項行為出現異常,且在隨后對其他動物的研究中也再次證實了這一現象[10]。提示RBD的發生可能與神經元通路的變性具有一定相關性。研究人員為貓的中腦腹側區域注射N-甲基-D-天冬氨酸后發現,貓出現了失眠以及頻繁覺醒等情況,1周后發生帕金森病樣震顫、肌強直以及運動功能受損,雖然上述研究指出了帕金森病與RBD之間具有一定關聯性,但尚未發現一種指標以評估帕金森病患者可能伴RBD的發生風險。
α-突觸核蛋白是一種可溶性蛋白,存在于人腦組織內,當機體處于正常狀態下時,α-突觸核蛋白不表現出細胞毒性,當基因或環境產生變化后可能導致α-突觸核蛋白出現錯誤折疊,形成寡聚體,增加纖維性蛋白含量,最終導致路易小體形成,路易小體的出現是帕金森病的一項主要特征[11-13]。α-突觸核蛋白是路易小體的主要成分,該蛋白大量沉積可能導致細胞程序性死亡最終引發帕金森病癥狀。大量研究[14-16]證實,帕金森病患者血漿α-突觸核蛋白表達水平明顯高于健康人群,且帕金森患者經治療后其血漿α-突觸核蛋白表達水平仍呈現較高水平,提示α-突觸核蛋白水平的升高與帕金森病的發病相關,且不受抗帕金森病藥物的影響。近年來,隨著檢測技術的不斷發展,研究人員在帕金森病患者血漿、腦積液以及唾液中均檢測到了α-突觸核蛋白的高表達,提示其參與了帕金森病的發生及發展。近年來,研究[17]指出腸道自主神經系統α-突觸核蛋白免疫反應在RBD中發揮重要作用。本研究對伴或不伴RBD的帕金森病患者血漿及唾液中α-突觸核蛋白含量進行了測定,發現無論是在血漿還是在唾液中,PD+RBD組受試者α-突觸核蛋白含量均顯著高于PD-RBD組,且多因素回歸分析結果顯示,α-突觸核蛋白含量與帕金森患者伴發RBD顯著相關。
除α-突觸核蛋白表達水平外,本研究還發現,PD+RBD組受試者病程、H-Y分期、ESS、HAMD及HAMA評分均明顯高于PD-RBD組,分析原因可能如下[18-21]:病程越長、H-Y分期越高,表示患者疾病越嚴重,多巴胺能藥物的使用量則更多,因此運動并發癥更為嚴重;RBD患者睡眠質量差是由于其夜間多夢、易出現肢體活動、喊叫等多種異常行為,引起睡眠中斷;此外,RBD患者存在排汗障礙、夜尿增多等自主神經癥狀,同樣可能影響睡眠質量,從而導致日間活動及覺醒,更易出現日間過度嗜睡;帕金森病患者由于疾病造成的心理壓力及應激反應導致其極易出現抑郁、焦慮等負性情緒,伴有RBD者由于睡眠質量差則可能進一步加重抑郁、焦慮癥狀。
綜上所述,血漿及唾液中α-突觸核蛋白表達量升高是帕金森病患者伴發RBD的獨立影響因素。

