肺癌靶向治療致自身免疫性疾病相關間質性肺疾病進展兩例并文獻復習
李欣 唐小葵
在晚期非小細胞肺癌的治療中,靶向治療是有特定驅動基因突變患者的一線方案,但靶向治療存在誘發間質性肺疾病(Interstitial lung disease,ILD)風險,約為0.4%~6.0%。本文報道了我科收治的兩例自身免疫性疾病相關間質性肺疾病(autoimmune diseases-related interstitial lung disease,AID-ILD)合并肺癌患者。一例為顯微鏡下多血管炎相關間質性肺疾病(Microscopic polyangiitis withinterstitial lung disease,MPA-ILD),一例為自身免疫特征的間質性肺炎(Interstitial pneumonia with autoimmune features,IPAF),均在肺癌靶向治療后發生ILD進展。結合文獻進行綜合分析,發現并發或既往存在ILD的患者,靶向治療后發生藥物相關性間質性肺疾病(Drug-induced interstitial lung disease,DILD)的風險是4~20倍。本文報道兩例AID-ILD合并肺癌患者在接受靶向治療后ILD進展的病例并進行文獻復習,旨在總結兩例患者的診治經驗,以期重視ILD的診治。
病例資料
病例1 患者男,68歲,有吸煙40余年,因“胸部CT發現右肺結節2月余”于2020年6月12日入院。查體:T 36 ℃,P 102次/分,R 20次/分,BP 139/89 mmHg(1 mmHg=0.133 kPa)。雙下肺聞及散在濕啰音及少許爆裂音,無關節變形、肌肉、耳、鼻、皮膚改變等。
我院門診胸部CT示右肺結節影伴縱隔淋巴結腫大、雙肺間質性改變(2021年5月21日,圖1~3)。于2020年06月16日行CT引導下右肺結節經皮穿刺肺活檢術,病理示:非小細胞肺癌。完善頭顱CT、腹部彩超、全身骨顯像行全身評估,未見異常。肺功能檢查:FEV1/FVC 63%,FEV1實測/預計85%,FVC實測/預計109%,DLCOS實測/預計23%,提示輕度阻塞性通氣功能障礙,彌散功能重度下降。實驗室檢查:核周型抗中性粒細胞胞漿抗體(p-ANCA)1:10,抗髓過氧化物酶抗體68.7AU/mL,抗核抗體(ANA)1 ∶100(顆粒型),ESR 99 mm/h,肌酐91 umol/L,尿蛋白+,尿隱血3+,尿紅細胞605個/μL,類風濕因子(RF)、抗ENA抗體、肌炎抗體陰性。診斷:MPA-ILD(結合ANCA陽性、間質性肺疾病、蛋白尿、血尿,達到臨床診斷)合并右肺非小細胞肺癌伴縱隔淋巴結轉移,T1N2M0,IIIA期,體能狀態(performance status,PS)評分2分。
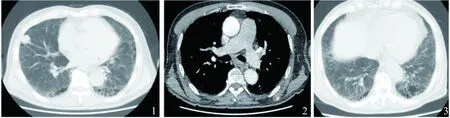
圖1~3 使用克唑替尼前查胸部CT,右肺中葉外側段不規則結節,伴縱隔淋巴結腫大;雙下肺多發網格狀、磨玻璃影
患者肺功能差,無法耐受手術。治療予以口服潑尼松片40 mg/d,患者考慮環磷酰胺可能誘發腫瘤進展,拒絕使用。在“多西他賽100 mg聯合奈達鉑120 mg”方案化療一療程后,基因檢測結果示ALK基因突變陽性,患者于2020年8月2日開始口服克唑替尼250 mg,每日兩次,服用該藥后出現腹瀉、納差、尿量減少。17天后因“咳嗽、咳痰、呼吸困難加重4天”再次入院。入院后停用克唑替尼,復查肌酐492 μmol/L,ESR 74 mm/h,復查胸部CT示右肺結節較前縮小,雙肺間質性病變較前明顯加重(2020年8月26日,圖4、5)。ILD加重考慮克唑替尼不良反應,血管炎活動、化療副作用不能除外。治療方案調整為甲強龍40mg/d聯合免疫球蛋白20 mg/d×5 d靜脈滴注抗炎及抗感染,考慮環磷酰胺有誘發感染及腫瘤進展風險,患者家屬拒絕。治療后查胸部CT示雙肺間質性病變減少(2020年9月8日,圖6、7)。由于患者MPA-ILD合并肺癌并出現繼發感染,予以有創機械通氣、血液濾過、抗感染等治療,于2020年9月14日死亡,死亡原因膿毒性休克。
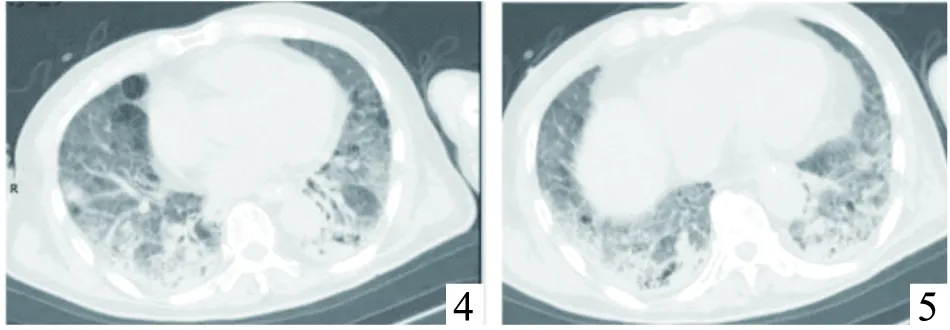
圖4~5 使用克唑替尼11天且停用13天后,胸部CT提示,右肺中葉外側段不規則結節較前縮小;雙肺網格狀影及磨玻璃影較前增多

圖6~7 停用克唑替尼22天且激素聯合免疫球蛋白治療后,胸部CT提示,右肺結節較前無明顯改變;雙肺間質炎癥較前有好轉
病例2 患者男,61歲,有吸煙史20余年,因“左側胸痛2月余”于2020年3月12日入院。查體:T 36.5℃,P 74次/分,R 21次/分,BP 148/93 mmHg。無關節變形、晨僵等。
入院胸部CT示左肺上葉塊影伴左側肺門淋巴結增大(2020年3月13日,圖8、9),雙肺輕度肺間質性改變。患者痰中找到腺癌細胞,基因檢測提示EGFR基因19-Del突變。全身骨顯像提示左側3~4肋骨腋段放射性增多,頭顱及腹部增強CT未見異常。雙肺輕度間質性改變,未進一步篩查免疫相關指標,未服用藥物。診斷:左肺腺癌伴肺門淋巴結、肋骨轉移,T4N2M1c,IVB期,PS評分2分。患者出院后長期口服吉非替尼250 mg/d,每兩月于門診復查胸部CT。肺癌療效評價為疾病穩定,隨訪過程未關注肺部間質病變。
2020年8月患者喘累、咳嗽、咳痰、胸痛加重,伴右肘關節疼痛。2020年9月復查胸部CT示左肺上葉及左側肺門塊影范圍均擴大,肺部間質性病變加重(2020年9月3日,圖10、11)。于2020年10月16日再次入院,行支氣管鏡檢查,氣管鏡灌洗液找到腺癌細胞,再次行基因檢測,未檢測到EGFR基因突變。肺功能檢查:FEV1/FVC 102%,FVC實測/預計48%,DLCOS實測/預計23%,RV%/TLC 156%,提示重度限制性通氣功能障礙,殘氣功能占肺總量明顯增高,彌散功能重度下降。實驗室檢查:RF 71.1 IU/mL,抗環瓜氨酸肽抗體301.65 U/mL,抗角蛋白抗體1 ∶10,ANA 1 ∶100(高爾基體型),抗RO-52抗體陽性,ESR120 mm/h。抗ENA抗體、ANCA陰性。結合患者右肘關節疼痛、ILD及自身免疫指標升高,診斷IPAF。治療上停用吉非替尼,靜脈滴注甲強龍40 mg/12 h。患者拒絕繼續治療,于出院1月余后死亡。
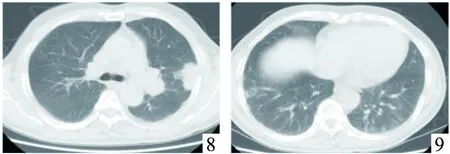
圖8~9 使用吉非替尼前查胸部CT,左肺上葉胸膜下塊影伴左側肺門淋巴結腫大;雙肺底網狀影
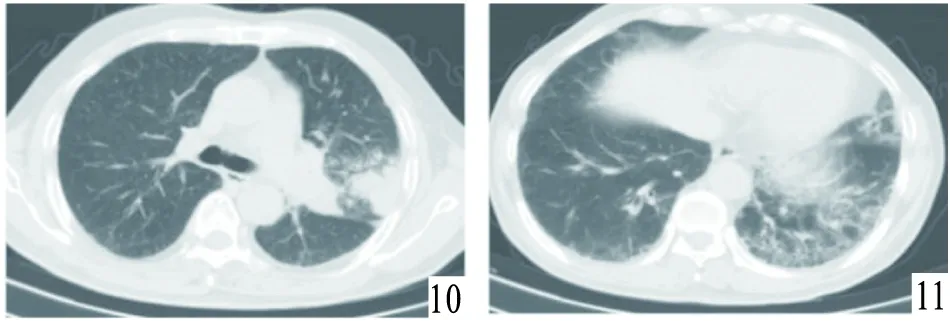
圖10~11 使用吉非替尼5余月后,胸部CT提示,左肺上葉胸膜下塊影及左側肺門腫大淋巴結,范圍均擴大;雙肺散在斑片影、網狀影,較前增多
討 論
不同種類的表皮生長因子受體酪氨酸激酶抑制劑 (EGFR-TKI)及間變性淋巴瘤激酶酪氨酸激酶抑制劑(ALK-TKI) 在全球范圍致DILD的總體發病率(如表1)所示。
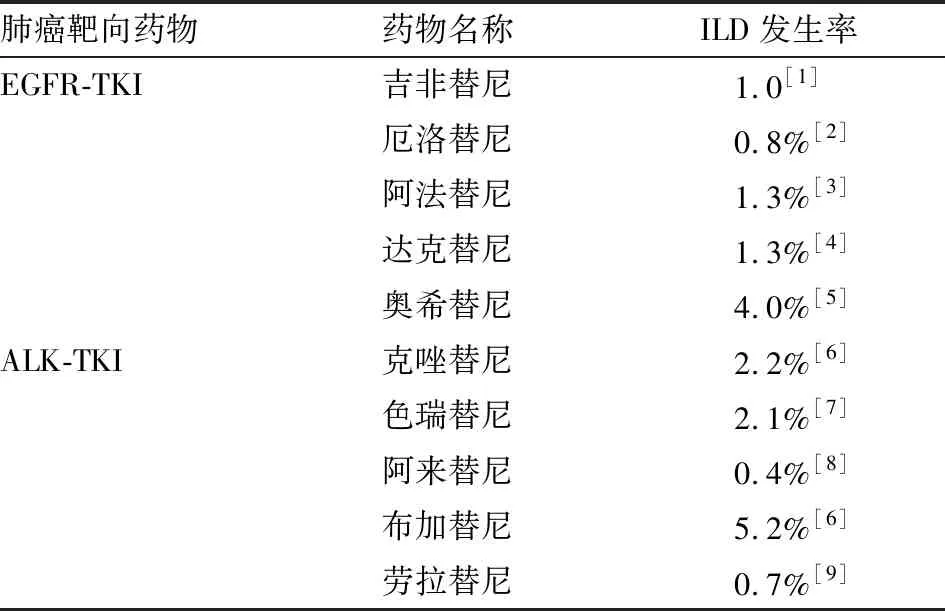
表1 不同EGFR-TKI及ALK-TKI致DILD的發生率
目前大多數的大規模臨床試驗都將合并ILD的肺癌患者排除在外,在此我們總結了國內外探討肺癌靶向治療致DILD的危險因素的臨床研究。以“吉非替尼”,“厄洛替尼”,“克唑替尼”,“間質性肺疾病”,“危險因素”等及相應的英文詞匯為關鍵詞,在中國知網、萬方、維普、PubMed等數據庫進行檢索。檢索到符合條件的臨床研究有8項(已排除樣本量較少的兩項),并對中位發病時間、DILD的發病率及危險因素進行總結(見表2)。在日本地區總體人群中,DILD的發生率在1.0%~5.9%,明顯高于全球范圍的總體發生率,這可能與遺傳易感性相關。而有ILD基礎的患者靶向治療后,DILD的發生率為10.6%~30.0%,明顯高于日本地區總體人群DILD的發生率。且8項研究都表明了并發或既往ILD是靶向治療后發生DILD的危險因素,因此有ILD基礎的患者應當謹慎選擇靶向治療。
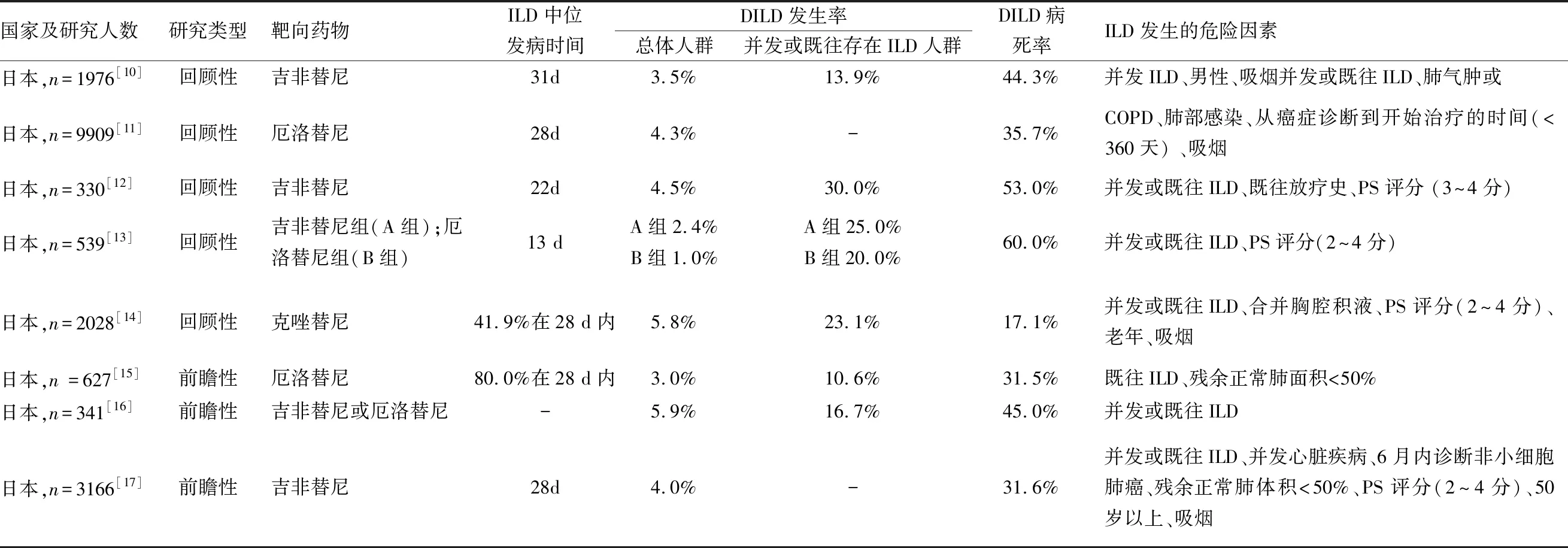
表2 關于肺癌靶向治療致DILD危險因素的研究
本文所報道病例的特殊之處在于存在自身免疫性疾病(autoimmune diseases,AID)基礎,進一步檢索了國內外關于AID-ILD合并肺癌的相關的研究,未檢索到任何文獻,目前對該類患者的診療缺乏研究。AID與惡性腫瘤存在復雜的相互關系,AID患者合并惡性腫瘤風險增加,同樣的,惡性腫瘤可能引起自身免疫紊亂從而誘導AID發生[18]。并且,與未合并ILD的患者相比,有ILD基礎的患者,患肺癌的風險更高[19]。針對AID-ILD合并肺癌患者的治療,糖皮質激素及免疫抑制劑作為AID-ILD的基礎治療用藥,存在誘發肺癌進展、感染等風險;而晚期肺癌的傳統的放療、化療及新興的靶向、免疫治療,均存在誘導ILD加重的風險[20],該類患者的治療難度大,目前治療上尚未提出循證學證據。
綜上所述,DILD是肺癌患者在靶向治療過程中的重要不良反應,與更高的死亡率相關。因此,不只關注肺癌治療,還應當重視ILD的診治,警惕ILD急性加重。目前AID-ILD總體治療仍是以激素及免疫抑制劑治療為基礎,抗纖維化藥物的作用仍在探索中[20]。對于有ILD基礎、吸煙史等的高危患者應當慎用靶向治療,并且在使用過程中密切觀察,在發生或高度懷疑ILD急性加重時,立即停藥并使用糖皮質激素,關于靶向藥物是否再啟用,需綜合考慮ILD的嚴重程度和其他治療的可用性而定[21]。目前缺乏AID-ILD合并肺癌患者的相關研究,將來仍需要更多的研究探索其治療方式。

