基于BC3NT的混合系鋰空氣電池正極第一性原理研究
王玉陽, 喻明富, 張添昱, 李 潔, 李 強, 孫 紅
(沈陽建筑大學 機械工程學院, 沈陽 110168)
1 引 言
電池技術的發展對實現一個更可持續的現代社會越來越重要[1]. 雖然鋰離子電池的研究已經取得很好的成果,但是其仍然受到能量密度的限制[2, 3]. Littauer等[4]在1976年提出了鋰空氣電池的概念,其電極反應式是:2Li+O2+2e-?Li2O2.鋰空氣電池因為理論能量密度極高,可以達到11140 Wh·kg-1,幾乎是鋰離子電池能量密度的10倍而受到了廣泛關注[5]. 它可以直接從環境中獲得O2作為反應物[6],以捕獲從陽極轉移到陰極的Li+. 雖然電池體系能量密度極高,但一些限制電池性能的問題仍需要解決,包括低功率密度、不溶性生成物易堵塞正極孔道使電池停止放電等[7]. 為了解決上述問題,He等[8]于2010年提出基于LISICON膜的混合系鋰空氣電池,吸引了大量科研人員的注意. 其反應式是:4Li+O2+2H2O?4LiOH. 鋰空氣電池按結構和電解液體系可以分為:水系鋰空氣電池、有機體系鋰空氣電池、混合系鋰空氣電池和全固態鋰空氣電池[9]. 與水系鋰空氣電池相比,混合系鋰空氣電池既克服了金屬鋰與水直接接觸的危險,又解決了正極不溶、絕緣的反應產物覆蓋電極的難題[10]. 與有機體系相比,混合系鋰空氣電池使得反應機理變得簡單,在負極鋰一側的有機電解質能夠有效降低負極鋰的副反應及保護金屬鋰[11]. 生成物LiOH具有很高的水溶性,正常情況下不會堵塞多孔正極,便于連續放電,混合系鋰空氣電池的內在優勢使其成為一種新型有前途的儲能電池系統[12]. 該電池因為一系列的優點,受到大量關注. 然而,混合系鋰空氣電池仍然有很多需要改善的地方. 比如LISICON膜在LiOH溶液中的穩定性較低,循環壽命短、成本高、倍率性能欠佳等[13]. 正極材料對混合系鋰空氣電池起著至關重要的作用,優秀的正極材料可以提高鋰空氣電池實際能量密度、電池的循環性能和降低電池的過電勢等,所以研究出性能優越的正極材料迫在眉睫.
其中,碳納米管具有很多優點,如較大的比表面積、價格低廉等,使其成為人們最常使用的正極材料之一,大量科研人員將碳納米管與金屬或者其他材料復合作為正極材料,但是成本很高,而且過程很復雜. 所以科研人員考慮讓碳納米管在有著較大比表面積的同時又能起到催化作用,需要對碳納米管進行摻雜改性,而改變這些納米管電子性質的一種方法是在其上摻雜電子給體和受體. 由于硼的原子半徑接近于碳原子的半徑,容易摻雜,它對碳納米管起到了雜質的作用[14, 15]. 于是科研人員提出了基于BXCYNZ的三方組合來合成不同類型的納米管和納米結構,其中BC3結構是他們最重要的目標[16-18]. 實驗和理論研究表明,硼摻雜可以在碳納米管中形成一維納米管結構的BC3陽極瘤,并且可以形成相對穩定性與CNT相當的BC3NT[19]. BC3NT含有C-C和B-C鍵,但沒有任何不穩定的B-B鍵,因此這些結構是穩定的[20, 21]. 研究發現,硼在碳納米管中的摻入可以有效地調整其電子性能和力學性能,這可能帶來一些新的應用[22]. 與碳納米管不同,這些納米管表現出不依賴于納米管直徑和手性的電子性質[23]. Wang等[24]已經指出,BC3單壁管具有相對穩定的性能,這種穩定性很可能與這些納米管是半導體有關,因此可能構成適合納米電子學技術的一類材料[25-27]. 事實上,目前人們認為BC3結構可以產生非常穩定的材料,在電性能方面優于傳統的碳納米管[28]. 實驗室合成的BC3NT極可能存在一些缺陷,因為容易產生缺陷是BC3NT的一大特性[29],缺陷是通過化學鍵旋轉90°得到的. Yeh等[30]分別采用實驗和第一性原理計算兩種方法論證了隨著硼含量的增加,電催化性能逐漸提高. 根據前人對摻雜硼的碳納米管及其他材料的研究,硼摻雜碳納米管繼承了碳納米管高比表面積的特點,且具有很好的催化性能,而混合系鋰空氣電池正極材料恰恰需要改善這兩個性能,所以我們恰恰可以利用這些性質來進行混合系鋰空氣電池正極的研究.
本文使用Material Studio軟件,分別以CNT、BC3NT、帶有拓撲缺陷(七元環、八元環)的BC3NT作為混合系鋰空氣電池正極材料. 使用第一性原理研究帶有拓撲缺陷的BC3NT的電子結構和對Li+擴散能壘的影響以及對氧氣吸附的性質.
2 第一性原理計算模型建立
首先建立(8,0)CNT模型,然后用B元素取代部分C元素,得到BC3NT,如圖1所示. 共128個原子,其中包括32個B原子,灰色代表C原子,紫色代表B原子. 七元環拓撲缺陷是通過將納米管中的一個鍵旋轉90°而產生的,結果是兩個具有公共鍵的七邊形和兩個被鍵分開的五邊形,如圖2(a). 同理,八元環缺陷如圖2(b)所示. 本文將帶有七元環拓撲缺陷的BC3NT用7MR表示,帶有八元環拓撲缺陷的BC3NT用8MR表示.
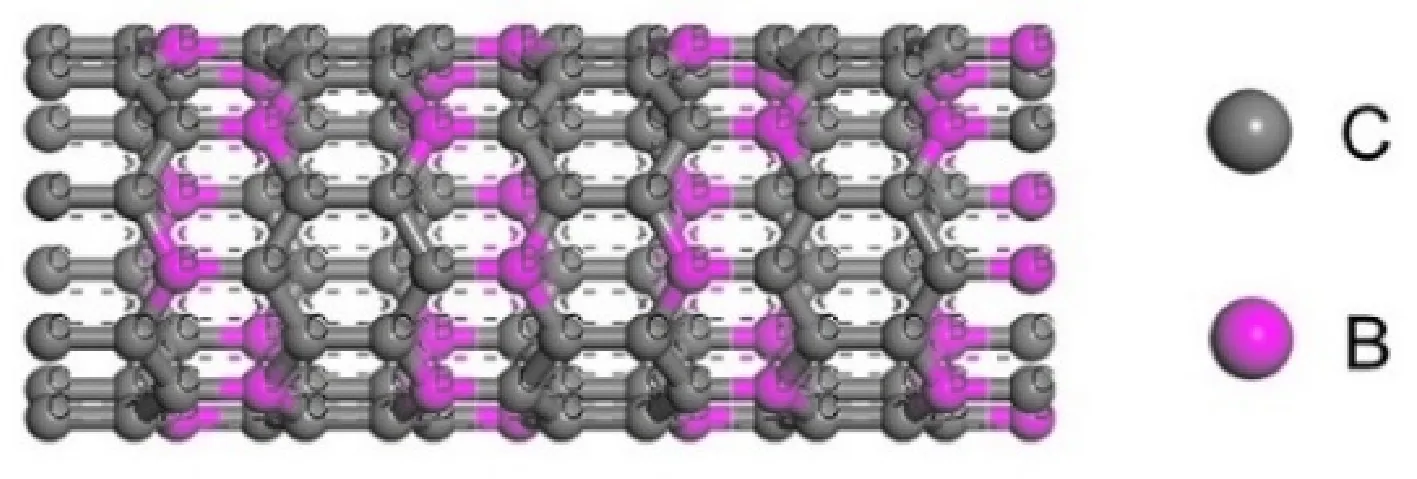
圖 1 BC3NT結構Fig. 1 Structure of BC3NT
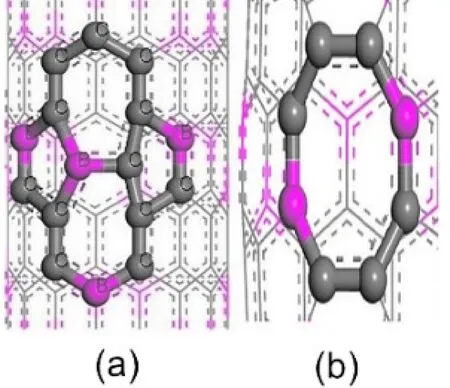
圖2 帶有拓撲缺陷的BC3NT結構:(a)7MR, (b)8MRFig. 2 BC3NT structures with topological defects:(a)7MR, (b)8MR
將納米管放在20 ?·20 ?·17.08 ?的晶胞中,建立模型如圖3所示.
圖3 納米管周期模型Fig. 3 BC3NT cycle model
通過求解薛定諤方程可以求出描述體系狀態的電子波函數:
(1)
式中,?=h/2π,h為普朗克常數,大小是4.13566743*10-15eV·s;m為電子的質量;i=1, 2, …;N為電子的編號;▽為電場梯度(V/m2);r為電子的坐標值;V(ri)為每個電子與所有原子核之間的作用能(eV);U(ri,rj)為不同電子之間的作用能(eV);Ψ(r)= Ψ(r1,…,rN);E是電子的基態能量(eV).
由于固體中存在大量的電子,直接求解薛定諤方程存在很大的困難,第一性原理的核心是采用合理的近似和簡化,提出電子波函數Ψ(r)和電子密度函數ρ(r)存在——對應的關系,通過求解ρ(r),便能間接得到Ψ(r).其中ρ(r)滿足Kohn-Sham方程:
εiψi(r)
(2)
式中,Exc[ρ]為交換關聯泛函;Vext(r)為第i個電子的總能(eV);εi為第i個電子的基態能量.
建立模型之后進行優化,優化過程能量收斂如圖4所示. 用基于密度泛函理論(Density Function Theory)的第一性原理Dmol3程序進行模擬計算,計算中自旋不受限制. 電子間交換關聯函數采用廣義梯度近似(Generalized Gradient Approximation,GGA)下的PBE泛函,為了準確描述反應物與基底間的范德華力,采用Grimme方法進行色散校正. 基組為雙數值軌道基組+p軌道極化函數DNP,總軌道截止選取4.9 ?,使得引入的基組誤差足夠小,采用全電子相對論處理金屬原子的相對論效應. 布里淵區積分采用Monkhorst-Pack形式的特殊K點方法,采用1×1×7的K點進行結構優化. 原子結構優化中的能量收斂性判據為1.0e-5Ha,Hellmann-Feynman原子力收斂判據為每個原子受力不大于0.002 Ha·?-1,最大位移為0.005 ?.
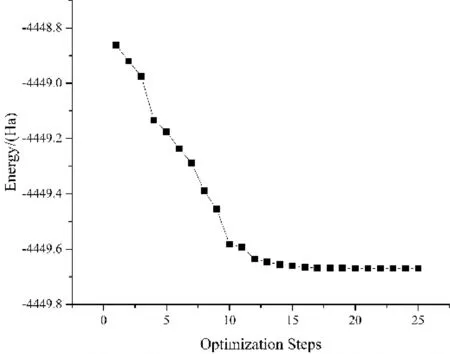
圖4 優化過程能量收斂圖Fig. 4 Energy convergence diagram of optimization process
氧氣在納米管上吸附能計算公式:
Eads=Etotal-EBC3NT-EO2
(3)
E表示優化后系統的能,Eads表示優化后系統的吸附能,Etotal表示優化后系統的總能量,EBC3NT表示BC3NT優化后的能量,EO2表示氧氣優化后的能量.
3 結果與討論
3.1 模型可靠性驗證
本文計算的氧氣在BC3NT外表面吸附能值是-3.54875157 eV,與Jalili等[31]得出的結論-3.24 eV相吻合,甚至比他們的結構更穩定,以上都表明本文的結果具有可靠性.
3.2 電子結構分析
CNT、BC3NT、7MR和8MR的能帶圖如圖5所示. 其帶隙分別是0.652 eV、0.549 eV、0.620 eV、0.330 eV. 摻雜硼使納米管能帶的帶隙減小,完美BC3NT的帶隙是0.549 eV,符合Jalili等[31]得出的結論,即完美的BC3NT是一種直接帶隙為0.5 eV的半導體. 7MR的帶隙是0.620 eV,與純BC3NT的帶隙的大小相比,雖有略微增大,但相差不大. 8MR的帶隙是0.330 eV,可以得出八元環拓撲缺陷可以很明顯降低帶隙,電子更容易躍遷到更高的軌道上,使反應活性更強. 在后三者能帶圖的帶隙處,可以很明顯看到雜質帶,這就是摻雜硼導致的,摻雜硼使嚴格的周期性勢場受到破壞,從而有可能產生能量在帶隙中的局域化電子態,這就是雜質能級. 8MR的能帶圖空帶處雜質帶比BC3NT和7MR的雜質帶要多. 說明缺陷環越大,處于激發態的電子越多,半導體導電能力增強,其電子活性就越大.

圖5 納米管能帶圖:(a)CNT, (b)BC3NT, (c)7MR, (d)8MRFig. 5 Band structures of nanotubes:(a)CNT, (b)BC3NT, (c)7MR, (d)8MR
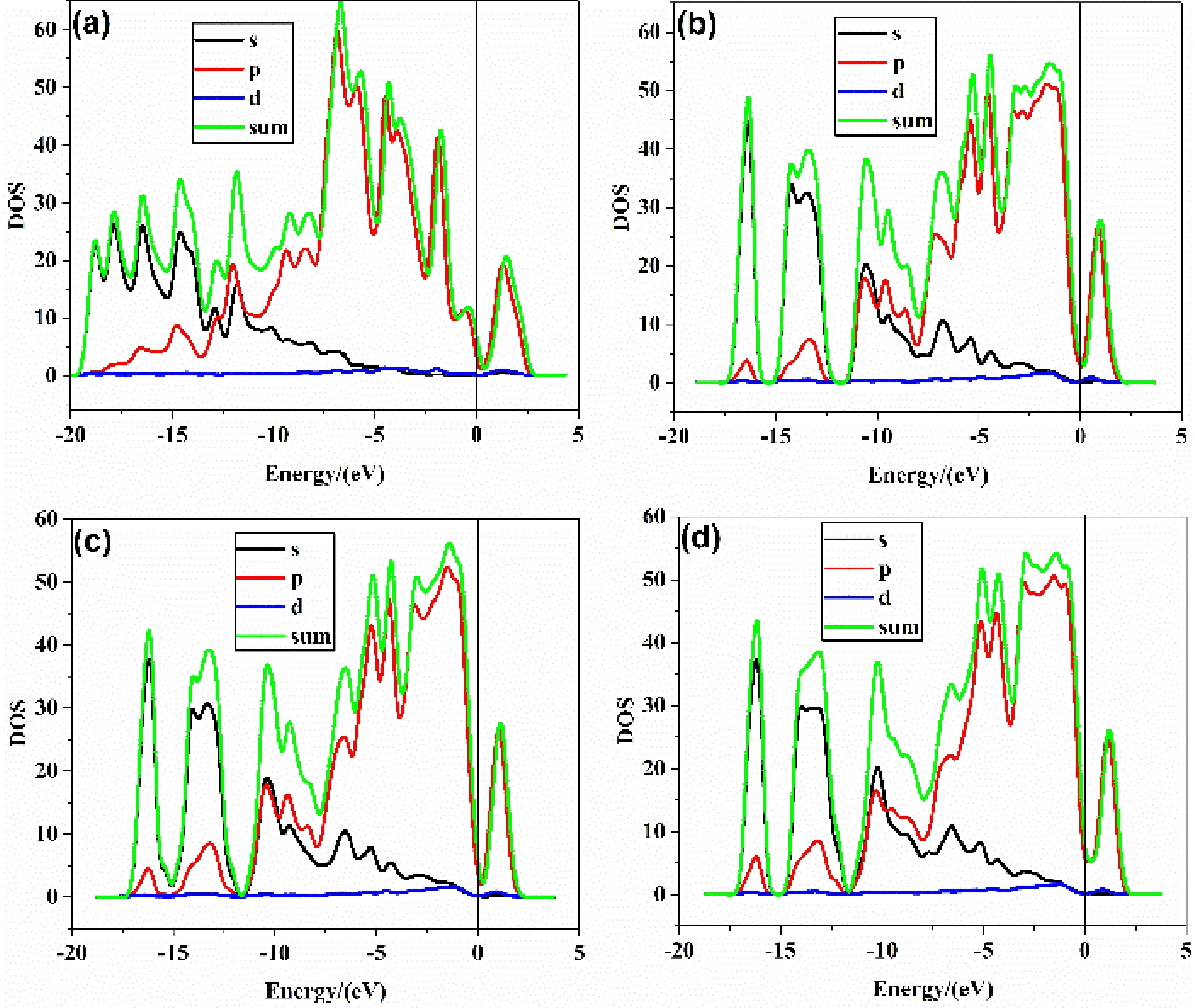
圖6 分波態密度圖:(a)CNT, (b)BC3NT, (c)7MR, (d)8MRFig. 6 Partial densities of states:(a)CNT, (b)BC3NT, (c)7MR, (d)8MR
CNT、BC3NT、7MR、8MR的態密度圖如圖6所示. 從圖中可以看出激發態的電子主要由2p軌道的電子提供,缺陷態是一種受主態. 從圖中也可得出摻雜硼之后,費米能級附近的峰高度增加,積累的電子數大幅度增多,處于激發態的電子數目增多,這些電子全部由2p軌道貢獻,說明摻雜硼之后碳納米管活性增強,對氧氣的吸附以及后續的氧還原反應有促進作用,從而提升電池性能.
BC3NT、7MR、8MR的總態密度圖如圖7所示. 在費米能級上的電子數不為0,說明摻雜硼之后的碳納米管呈現金屬性質,8MR在費米能級占據的電子數最多,而費米能級上占據的電子越多,說明越多的電子處于激發態,導電性越強,物質活性越大. 所以在本文中,8MR的電子活性最大,導電性最強,最有利于氧氣吸附以及氧還原反應的進行,其次是7MR、BC3NT.
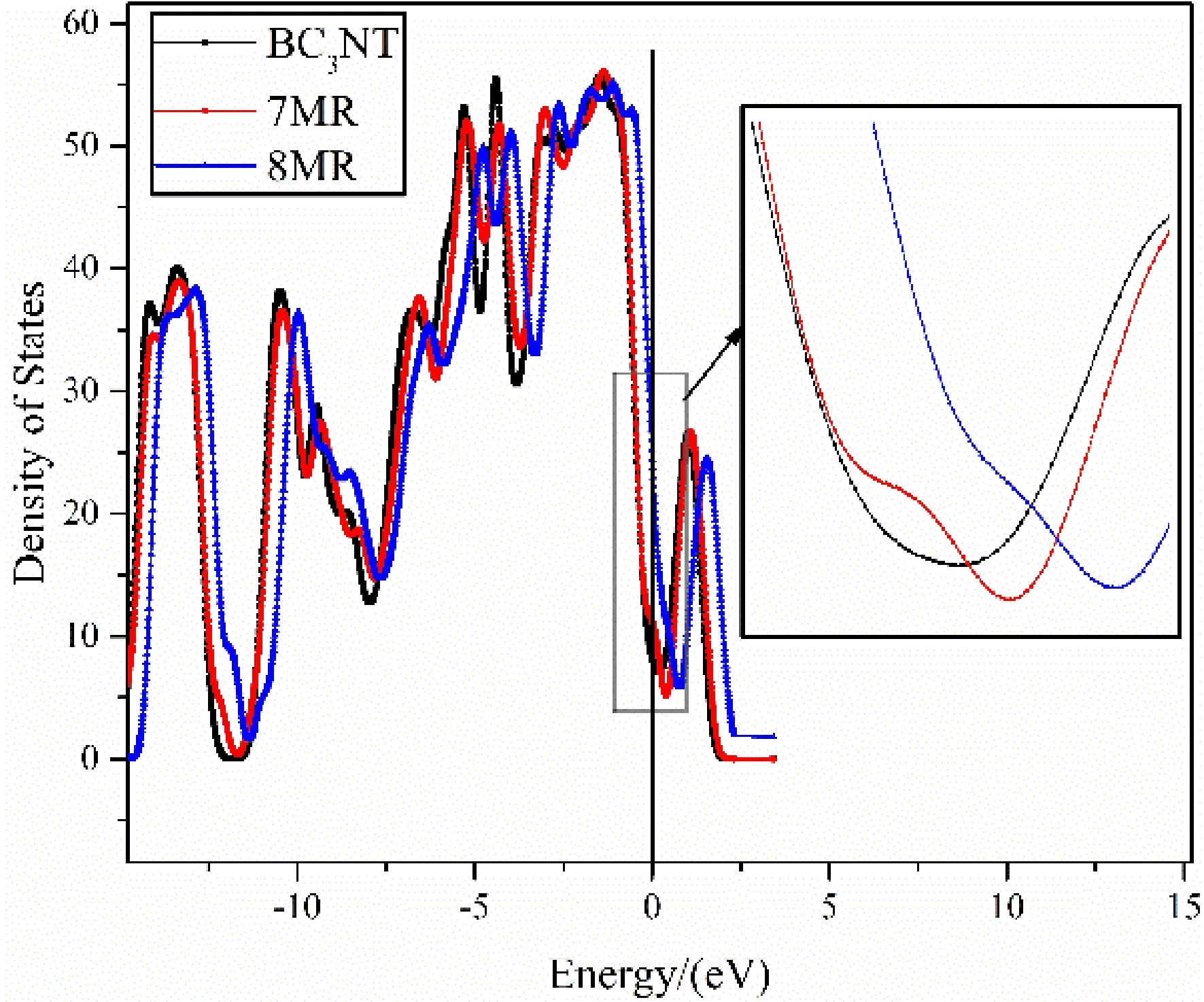
圖7 總態密度圖:(a)BC3NT, (b)7MR, (c)8MRFig. 7 Total densities of states:(a)BC3NT, (b)7MR; (c)8MR
3.3 O2吸附分析
O2可能通過三種方式來吸附在納米管上,包括吸附在頂位、橋位和空位上. 氧氣分別在CNT、BC3NT、7MR和8MR的頂位、橋位和空位上的吸附情況如圖8所示,其吸附能如表1所示. 結合圖8和表1,從計算的吸附能結果來看:對于CNT,其在橋位上的吸附能是0.5 eV,是吸熱吸附,需要條件較高,在室溫下難以進行. 在頂位和空位上的吸附能分別是-0.05 eV、-0.21 eV,由于數值大小遠遠小于0.5 eV,所以兩者都是物理吸附. 對于CNT來說,最穩定的吸附是空位吸附,但仍然是物理吸附,不利于氧還原反應進行,所以CNT只能作為電極材料,其催化性能很差.
對于BC3NT,氧氣在其頂位的吸附能是+2.17 eV,是吸熱吸附,很難發生. 氧氣在其橋位和空位的吸附能分別是-2.03 eV、-1.69 eV,都是化學吸附,比較穩定,且在橋位的吸附最穩定,有利于氧還原反應的發生,與Jalili等[31]得出的數據-2.27 eV非常接近,證明本文結果具有可靠性.
對于7MR,氧氣在其頂位、橋位和空位上的吸附能分別是-1.22 eV、-2.07 eV和-2.65 eV,都是化學吸附,是穩定的. 其中最穩定的吸附位是空位,吸附能是-2.65 eV. 從吸附圖可以看出,氧氣在7MR空位吸附后,雙鍵斷裂,變成微弱連接的單鍵,處于半解離狀態,是有利于后續氧還原反應的.
對于8MR,氧氣在其頂位、橋位和空位上的吸附能分別是-0.49 eV、-1.66 eV和-4.32 eV,都是化學吸附,是穩定的. 其中最穩定的吸附位是空位,吸附能是-4.32 eV,此時氧氣發生解離吸附,是非常有利于氧還原反應發生的.
從以上分析可以看出,O2在CNT外表面的吸附是非常不穩定的,在摻雜B的CNT外表面吸附是非常穩定的,而且隨著缺陷環的增大,吸附能越大,吸附越穩定,并且大的缺陷環使氧氣發生穩定的解離吸附,有利于氧還原反應的發生.
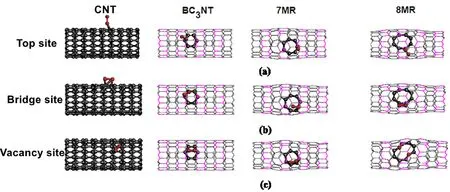
圖8 O2分別在CNT、BC3NT、7MR、8MR上的吸附:(a)頂位, (b)橋位, (c)空位Fig.8 Stable adsorption of O2 on CNT, BC3NT, 7MR and 8MR:(a)Top site, (b)Bridge site, (c)Vacancy site
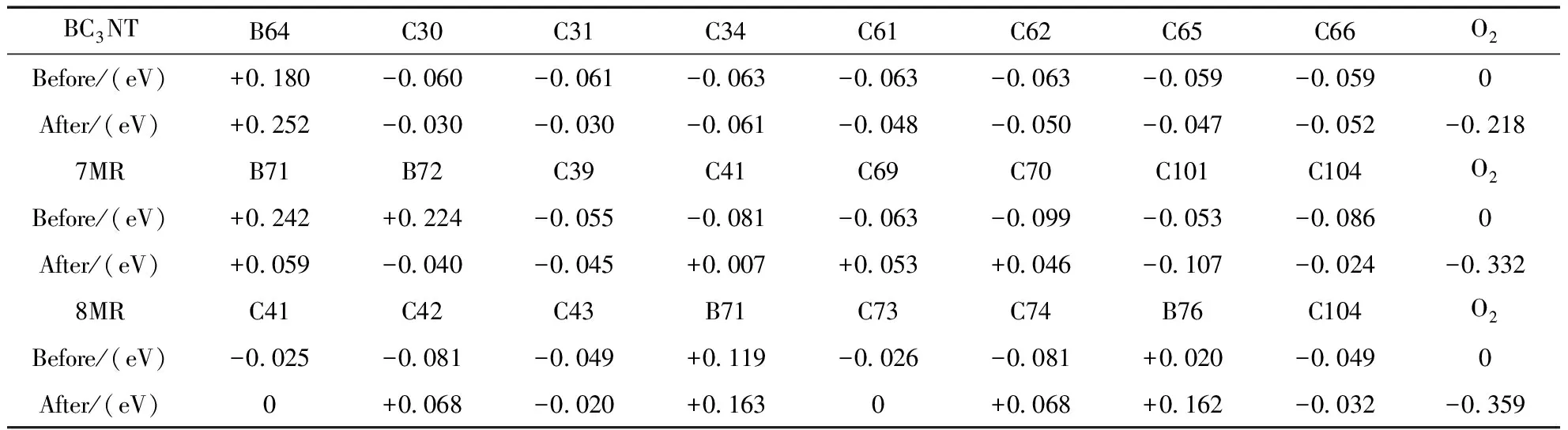
表2 電荷轉移值
CNT、BC3NT、7MR、8MR最穩定吸附O2時的帶隙如圖9,分別是0.379 eV、0.208 eV、0.071 eV、0.187 eV. 可以看出吸附O2后,納米管的帶隙都對應減小,且帶有七元環拓撲缺陷的BC3NT吸附O2之后,其帶隙大幅度減小,變為0.071 eV,金屬性非常強,具有良好的導電性,在空帶處產生很明顯的雜質帶. 眾所周知,發生電極反應的前提條件是氧氣的穩定吸附,而產生缺陷的BC3NT吸附氧氣后,活性非常大,有利于后續反應.
O2在BC3NT上吸附前后總電子密度分布如圖10(a)所示. 從圖中可以看出與碳原子相比,硼原子帶少量的電子,發生吸附后,O2帶大量電子. 氧氣吸附位點如圖10(b)所示,O2分子的一個O原子吸附于64號B原子上,氧氣總是穩定吸附于硼原子上,說明硼原子對氧氣吸引力大于碳原子.
對O2在BC3NT上的吸附進行布居分析得到吸附前后電荷變化如表2,結合圖表分析可以看出,碳相對于硼原子電負性較大,產生較大極化,所以使得硼原子帶0.180正電荷,這與Yang等[4]的結論一致. 因為氧氣在靠近BC3NT時表面帶有輕微的負電荷,所以帶正電荷的硼有利于對氧氣的吸附. 隨著吸附距離的減小,氧氣分子獲得越來越多的負電荷,與硼的作用進一步加強,最終導致穩定吸附于硼上. 而從表中吸附前后的電荷可以看出,在氧氣吸附的時候,碳原子失去部分電子,氧氣分子得到電子,而硼原子的電荷只有少量變化,所以在氧氣的吸附過程中,硼原子起到橋梁的作用,將管壁的部分電荷轉移到氧氣分子,從而更好的進行吸附,對接下來的反應起到了促進作用. 在這個過程中共向氧氣轉移電荷值是0.218 eV,這符合Jalili等[31]得出的結論.
O2在7MR上最穩定吸附如圖11所示,吸附前后的總電子密度圖如圖11(a)所示,吸附位點如圖11(b)所示.
由于帶有七元環拓撲缺陷的BC3NT會有變形發生,所以B-B鍵不在一條直線上,但是兩個B原子對氧氣的吸附力要大于純BC3NT,所以帶有七元環拓撲缺陷的BC3NT對氧氣吸附更穩定. 吸附前后電荷轉移情況如表2所示. 結合圖表我們可以得出,對于7MR吸附O2的機理與BC3NT不同,七元環上的兩個B原子各吸附一個氧原子,納米管向O2分子轉移更多的電荷,這也是7MR對O2吸附能大于純BC3NT的原因. 7MR對O2吸附的電荷轉移情況與純BC3NT大致相同,7MR吸附O2時是B原子將納米管表面的電荷轉移到O2表面,碳原子所帶電荷減少,O2分子得到更多的負電荷,B原子與帶負電的氧氣產生更強的吸附作用. 在這個過程中,O2得到電荷-0.332 eV,從電荷大小上看,7MR會將更多的負電荷轉移到O2分子表面,這也是7MR對O2分子吸附能更大的原因,這樣更有利于氧還原反應.
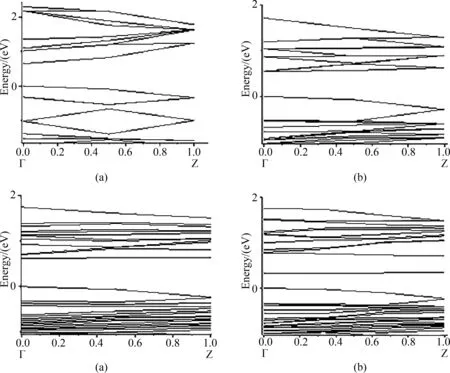
圖9 O2吸附的能帶圖:(a)CNT,(b)BC3NT,(c)7MR,(d)8MRFig. 9 Band structures of O2 adsorption:(a)CNT,(b)BC3NT,(c)7MR,(d)8MR
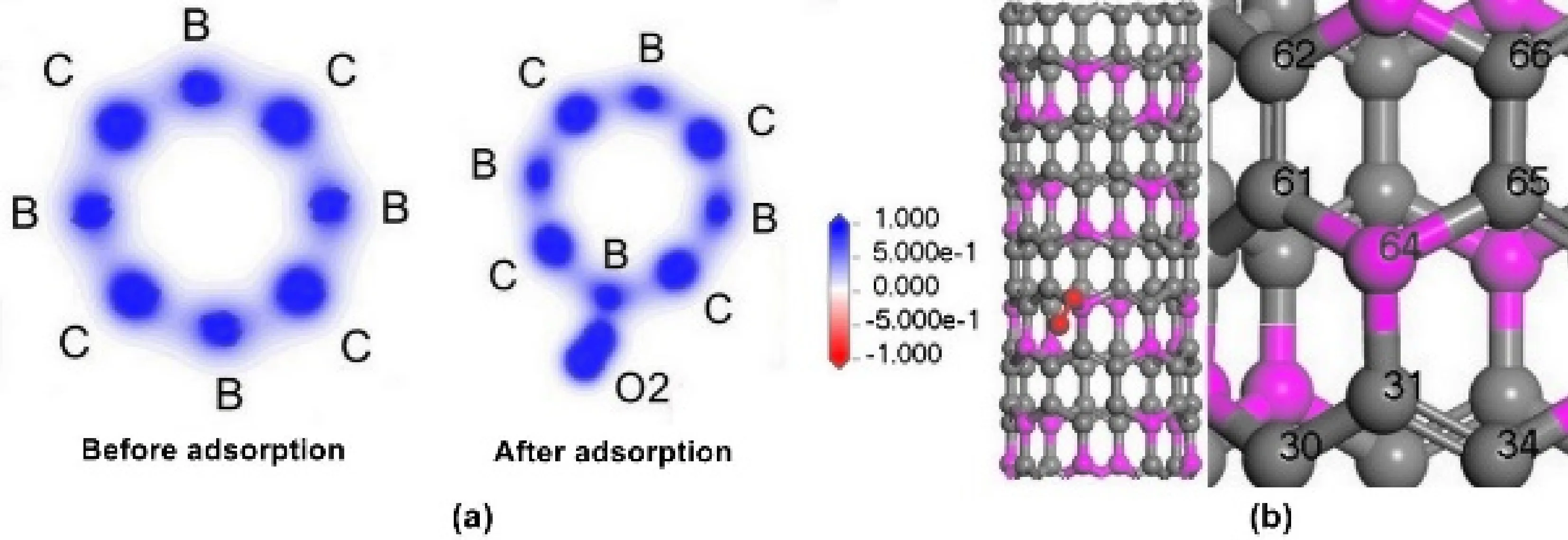
圖10 氧氣在BC3NT上最穩定吸附位點:(a)總電子密度, (b)吸附位點Fig. 10 The most stable adsorption site of O2 in BC3NT: (a)Total electron density distribution, (b)The site of adsorption
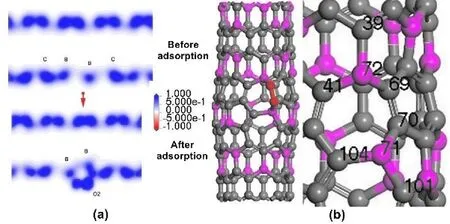
圖11 氧氣在7MR上最穩定吸附位點:(a)總電子密度; (b)吸附位點Fig. 11 The most stable adsorption site of O2 in 7MR:(a)Total electron density distribution, (b)The site of adsorption

圖12 氧氣在8MR上最穩定吸附位點:(a)總電子密度, (b)吸附位點Fig. 12 The most stable adsorption site of O2 in 8MR:(a)Total electron density distribution, (b)The site of adsorption
O2在8MR上吸附前后的總電子密度以及吸附位點如圖12所示,O2在8MR上的吸附能最大,吸附之后雙鍵斷裂,氧分子發生解離,兩個O原子分別吸附在兩個B原子上. 其中一個O原子與76號B原子和74號C原子成鍵,另一個O原子與71號B原子和42號C原子成鍵. 此時,兩個O原子成為拓撲缺陷環的組成部分,拓撲缺陷環變大. 同理,對8MR吸附O2的情況進行布居分析,得到電荷轉移情況如表2所示. O2得到負電荷-0.359 eV,主要由最近的42號和74號C原子提供. O2在8MR上吸附時得到的負電荷最多,庫倫作用最強,發生解離吸附最有利于氧還原反應.
由以上分析可以知道,BC3NT、7MR和8MR在吸附O2時,隨著缺陷環的增大,向O2轉移的電子數增多,吸附能增大,且O2在8MR上發生解離吸附,缺陷環越大,越有利于氧還原反應的進行.
4 結 論
本文將B元素摻雜到CNT中得到BC3NT,利用BC3NT易產生缺陷的特點,使其作為混合系鋰空氣電池正極材料. 分析了缺陷的引入對BC3NT電子性質的影響以及氧氣在BC3NT及其缺陷上的吸附性能. 研究發現:
(1)氧氣在摻雜硼的碳納米管上吸附更加穩定,且隨著拓撲缺陷環的增大吸附能越大,在7MR、8MR上分別發生半解離、完全解離吸附,更有利于氧還原反應的進行.
(2)通過布居分析進一步研究電荷轉移情況,隨著缺陷環的增大,轉移的電荷越來越多,氧氣與納米管的庫倫作用越來越強.
(3)綜合來看,摻雜硼的碳納米管是很好的正極材料,同時起到催化劑的作用,其產生的拓撲缺陷環既會提升導電性能,又能使氧氣更穩定地吸附,更有利于氧還原反應.

