孕期缺氧對子代肺動脈血管功能的影響及其機制
趙 夢,李 歡,吉冰玉,徐 婷,高芹芹
許多成人疾病的發生,其病因往往可以追溯至兒童、嬰幼兒甚至胎兒期。近期大量研究[1-2]表明:孕期多種不良因素(母體、遺傳或環境)均不同程度影響宮內胎兒發育,這為成年后患心血管等疾病埋下“病根”。在胎兒發育晚期,肺循環經歷了一系列的結構和功能變化,胎盤的氣體交換轉變為肺的氣體交換,因此肺循環特別容易受到缺氧的影響。孕期宮內缺氧是胎兒發育過程中最為常見的不良因素[3-4]。已有大量研究[5-9]表明,孕期缺氧可影響子代冠狀動脈、腦動脈、腎動脈等血管的功能。而孕期缺氧對子代肺動脈的影響及其機制知之甚少。該研究主要圍繞孕期缺氧對成年雄性子代大鼠肺動脈血管功能的影響及機制進行探討。
1 材料與方法
1.1 實驗動物Sprague-Dawley(SD)大鼠清潔級,雌性大鼠體質量240~260 g,雄性大鼠體質量280~300 g,由蘇州大學醫學部實驗動物中心提供,生產許可證號:XCYK 2002-2008,使用許可證號:SYXK 2002-0037。
1.2 主要試劑硝普鈉(sodium nitroprusside, SNP)、乙酰膽堿(acetyl choline, ACH)、苯腎上腺素(phenylephrine, PE)、2-氨基乙基聯苯基硼酸酯(2-aminoethyl diphenylborinate, 2APB)、硝苯地平(nifedipine, NIFE)和5-羥色胺(5-hydroxytryptamine, 5-HT)購于美國Sigma公司。
1.3 主要儀器Chart 7 Powerlab購自澳大利亞AD Instruments公司;Myograph System購自美國Radnoti LLC公司;熒光PCR儀、NanoDrop購自上海賽默飛世爾科技有限公司;ML-IICB數字智能測氧儀購自北京航天鵬誠儀器儀表有限公司。
1.4 常用緩沖液HEPES緩沖液:氯化鈉16.58 g、氯化鉀0.7 g、HEPES 4.76 g、EDTA 0.38 g、葡萄糖1.98 g、磷酸二氫鉀0.32 g、七水硫酸鎂0.84 g、二水氯化鈣0.82 g,單蒸水定容到2 000 ml,用氫氧化鈉調節pH值至7.35~7.45。
1.5 實驗方法
1.5.1動物模型制備 將SD雌性和雄性大鼠飼養在同一房間里,室內溫度設為22℃,每天各12 h光照和黑暗,并提供標準飼料和水。取3月齡雄性和雌性大鼠1 ∶1進行交配。交配一晚后檢查雌性大鼠是否有陰道栓。如果有陰道栓,說明雌性大鼠成功受孕,記為妊娠的第1天。將受孕成功的雌性大鼠隨機分為兩組。其中一組在正常條件下飼養(21% O2),直至分娩,作為對照組;另一組在妊娠第10天置于缺氧箱中飼養(10.5% O2和89.5% N2),至妊娠第21天,作為缺氧組。缺氧箱每天打開1次用于替換墊料、食物和水,用鈉石灰來吸收呼吸作用產生的水和二氧化碳。缺氧組和對照組孕鼠生下胎鼠,待子代斷奶后,繼續將雄性后代養至4月齡進行動物實驗。
1.5.2血管實驗 用4%水合氯醛將雄性子代大鼠麻醉后固定于托盤上,快速取出肺臟,立即浸泡在HEPES緩沖液中;在顯微鏡下輕柔地分離出肺動脈,將肺動脈剪成3 mm左右的血管環,置于冰上備用;在血管浴槽中加入5 ml 37℃ HEPES緩沖液,在顯微鏡下,用兩根鋼絲將肺動脈血管環固定于血管浴槽中的螺絲上;將血管浴槽與Powerlab轉換器連接,向血管浴槽中持續通入適量的氧氣;在電腦上打開Chart 7軟件,將血管的張力調整至生理狀態,并讓血管環穩定30 min。以60 mmol/L氯化鉀200 μl刺激血管,當血管收縮強度達到最大時,用37℃ HEPES緩沖液沖洗3遍,待血管穩定后再重復刺激2次。當收縮反應達到最大值后,記錄并計算血管的平均收縮強度。用37℃ HEPES緩沖液沖洗3遍,待血管張力穩定至基線后,以50 μl 10-4mol/L的5-HT誘導血管收縮達到平臺后,立即加入累積濃度梯度的ACH(10-9~10-4mol/L)和SNP(10-9~10-4mol/L);或用累積濃度梯度PE(10-9~10-4mol/L)刺激肺動脈血管環;或孵育L-型鈣離子通道(L-type calcium channels,LTCCs)阻斷劑NIFE或三磷酸肌醇(Inositol-1,4,5-trisphosphate, IP3)受體阻滯劑2APB后,觀察離體肺動脈血管環對累積濃度梯度PE的收縮反應。
1.5.3RT-PCR檢測肺組織中mRNA水平 使用TRIzol試劑提取肺動脈RNA,并使用NanoDrop分光光度計定量。用Takara逆轉錄試劑盒對RNA進行逆轉得到cDNA。以GAPDH為內參,使用SYBR Green Supermix Taq試劑盒,RT-PCR檢測成年子代雄性大鼠肺動脈腎上腺素能α1A受體(ADRA1A)、腎上腺素能α1D受體(ADRA1D)、腎上腺素能α2B受體(ADRA2B)、腎上腺素能α2C受體(ADRA2C)、腎上腺素能β1受體(ADRB1)、腎上腺素能β2受體(ADRB2)、腎上腺素能β3受體(ADRB3)、Cav1.2、T型鈣離子通道(Cav3.2)的mRNA水平。以GADPH為內參,基因表達的相對定量采用2-△△Ct法計算得出。
1.5.4Western blot檢測 取30 mg肺動脈血管組織研磨成粉末,將粉末轉移到1.5 ml EP管中,加入RIPA裂解液,置于冰上,反復靜置斡旋數十次;待管內無明顯沉淀,置95 ℃水浴鍋中加熱15 min。配制濃縮膠和分離膠,取上清液進行SDS PAGE凝膠電泳。以β-actin作為內參,檢測灰度值,對Cav1.2蛋白的表達水平進行定量分析。

2 結果
2.1 ACH和SNP介導的肺動脈舒張反應缺氧組成年子代雄性大鼠的肺動脈血管環對ACH介導的舒張效應與對照組比較,差異無統計學意義(F=0.220 8)(圖1A);缺氧組肺動脈血管環對SNP介導的舒張效應與對照組比較,差異無統計學意義(F=0.502 5)(圖1B)。
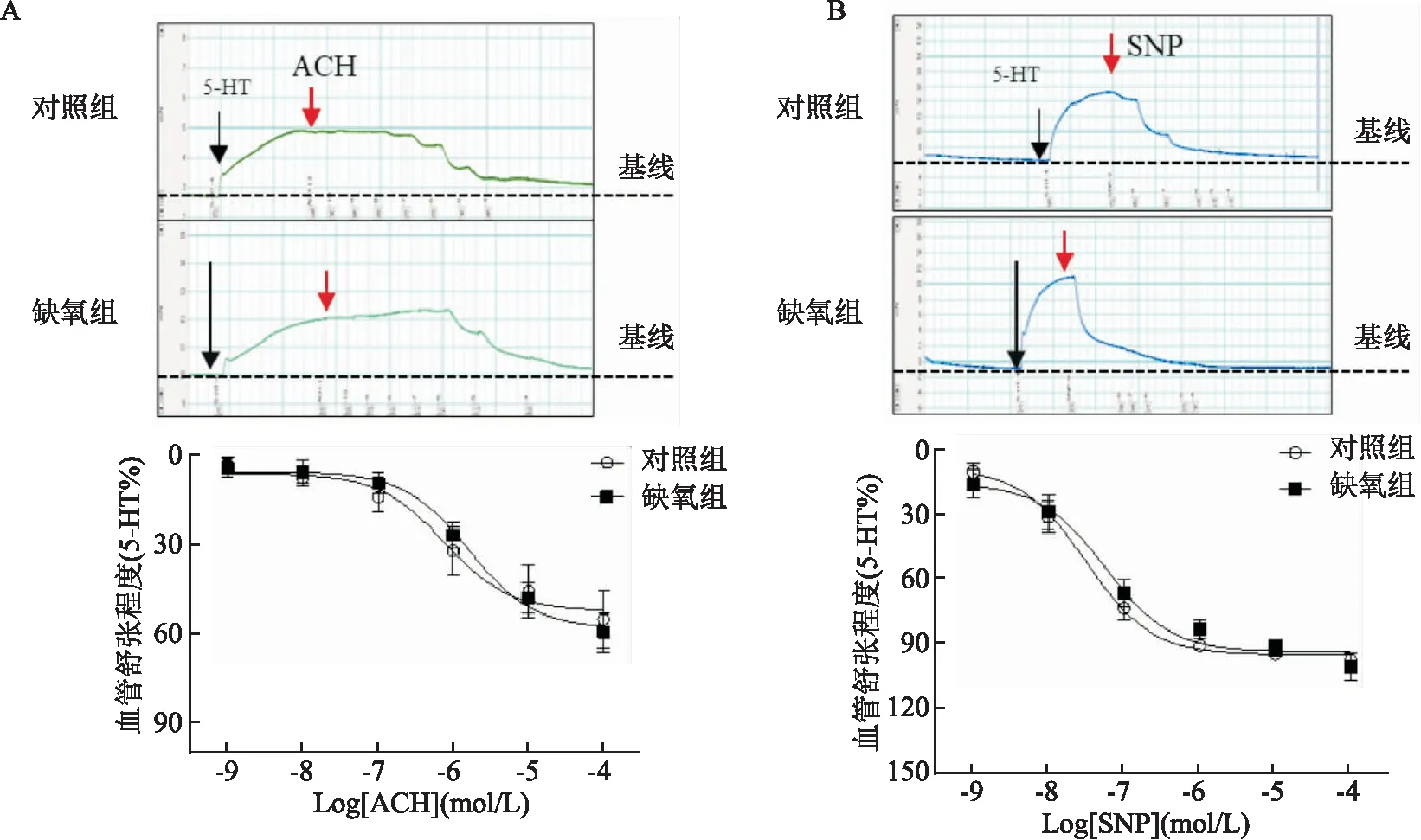
圖1 ACH和SNP介導兩組子代肺動脈的舒張反應A:累積濃度ACH誘導的舒張反應;B:累積濃度SNP介導的舒張反應
2.2 PE介導的肺動脈收縮反應肺動脈對苯腎上腺素均有劑量依賴性收縮反應,缺氧組PE引起的肺動脈收縮強度低于對照組(F=4.077,P<0.001)(圖2A),對PE介導的最大收縮反應低于對照組(P<0.001)(圖2B);兩組肺動脈最大收縮強度分別達到KCL引起的收縮強度的(14.28±2.572)%和(6.320±0.712)%(t=4.212)(表1)。

圖2 PE介導兩組子代肺動脈的收縮反應

表1 肺動脈對不同累積濃度PE反應的比較
2.3 PE介導的肺動脈收縮反應與LTCCs有關用NIFE阻斷LTCCs后,肺動脈對PE引起的收縮反應均減弱,且敷藥后兩組之間的收縮強度沒有差異(圖3A);孵育NIFE后,缺氧組PE引起的肺動脈最大收縮效應與對照組之間差異沒有統計學意義(圖3B);兩組肺動脈最大收縮強度分別達到KCL引起的收縮強度的(2.77±0.608)%和(1.96±0.234)%(表2)。用2APB阻斷IP3受體后,PE引起的肺動脈的收縮反應均減弱,且敷藥后兩組比較,缺氧組仍低于對照組(F=2.342,P<0.05)(圖3C);孵育2APB后,缺氧組PE引起的肺動脈最大收縮效應仍低于對照組(P<0.05)(圖3D);兩組肺動脈最大收縮強度分別達到KCL引起的收縮強度的(8.96±0.980)%和(3.23±0.362)%(表2)。
2.4 肺動脈中PE受體、Cav1.2和Cav3.2的mRNA水平與對照組相比,缺氧組肺動脈血管PE的A型受體[ADRA1A(t=0.873 8)、ADRA1D(t=0.402 7)、ADRA2B(t=1.165)和ADRA2C(t=0.609 4)]和B型受體[ADRB1(t=0.268 2)、ADRB2(t=0.4053)和ADRB3(t=0.656 9)]的mRNA水平沒有變化(圖4);缺氧組肺動脈血管Cav1.2的mRNA表達水平低于對照組(P<0.001,t=4.859),而Cav3.2的mRNA表達在兩組之間沒有差異(t=0.1624)(圖4)。

圖3 PE介導兩組子代肺動脈血管收縮與LTCC和2APB的關系

圖4 肺動脈血管PE和LTCCs相關受體mRNA的表達情況與對照組比較:***P<0.001
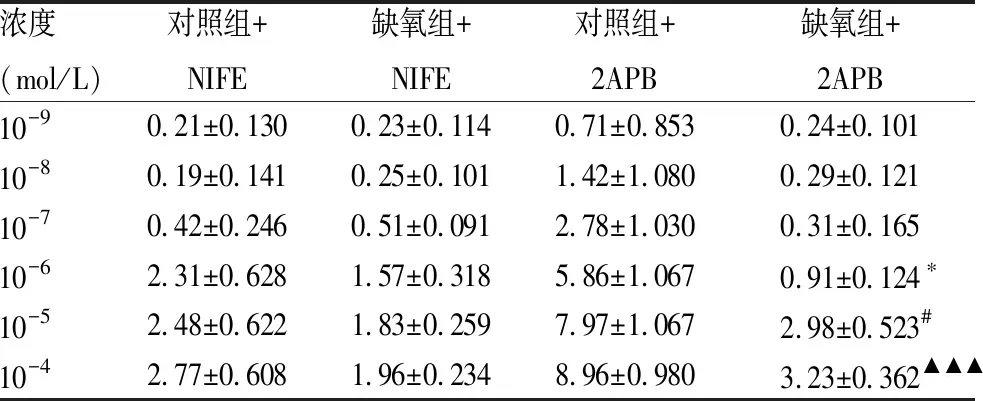
表2 肺動脈對孵育NIFE或2APB后不同累積濃度PE反應的比較
2.5 肺動脈血管中Cav1.2的蛋白水平與對照組比較,缺氧組肺動脈血管中Cav1.2的蛋白水平降低(P<0.01,t=5.313)(圖5)。
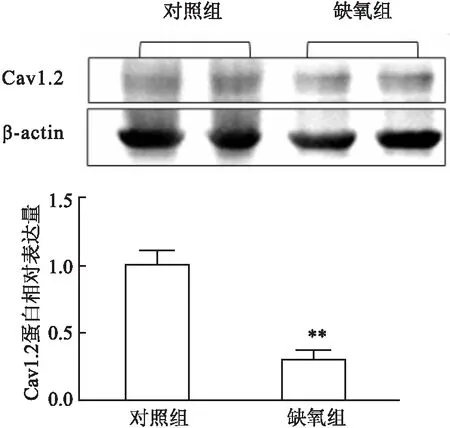
圖5 肺動脈血管Cav1.2的蛋白表達情況與對照組比較:**P<0.01
3 討論
本研究表明孕期缺氧可導致成年雄性子代大鼠肺動脈血管對苯腎上腺素引起的收縮反應減弱,且此收縮反應減弱主要與Cav1.2表達下調有關,而與胞內鈣釋放通路和苯腎上腺素受體的表達無關。孕期缺氧并不影響成年雄性子代大鼠肺動脈血管的舒張功能。
腎上腺素能受體廣泛分布于外周血管參與血管張力的調節。本研究顯示孕期缺氧成年子代肺動脈對苯腎上腺素介導的收縮減弱與其受體無關,可能由平滑肌細胞內的其他收縮機制引起的。血管平滑肌細胞胞內Ca2+濃度,在血管收縮中起著關鍵作用[10]。在阻力血管中,胞內Ca2+濃度升高主要有內質網Ca2+釋放和外Ca2+內流介導完成。IP3Rs是一種廣泛表達于內質網膜上的Ca2+釋放通道,本研究顯示通過抑制血管環IP3Rs后,缺氧子代肺血管環對苯腎上腺素的收縮反應仍明顯減弱,這說明孕期缺氧導致子代肺血管收縮功能減弱與內質網IP3Rs介導內Ca2+釋放無關。細胞外Ca2+進入細胞內主要通過電壓門控Ca2+通道,其中LTCCs家族中Cav1.2通道對調節平滑肌細胞Ca2+濃度至關重要[10]。本研究表明通過抑制血管環LTCCs后,缺氧子代肺血管環對苯腎上腺素的收縮反應與對照組間無明顯差異,這說明孕期缺氧導致子代肺血管收縮功能減弱與細胞膜LTCCs介導外Ca2+內流有關。
肺動脈平滑肌細胞內鈣穩態的破壞被認為是肺動脈高壓發病的一個重要觸發因素[11-12]。在以往的研究[12]中缺氧可導致子代肺動脈血管LTCCs表達上調。本研究顯示孕期缺氧下調子代大鼠肺動脈中Cav1.2的表達。肺循環作為一個高流量和低壓力的系統,旨在優化氣體交換過程,因此這一差異可能是機體的保護效應:Cav1.2下調極有可能是對缺氧誘導的高收縮的代償性保護,從而提高肺循環血流量。
本研究表明孕期缺氧降低成年雄性子代大鼠肺動脈血管的收縮能力。這與以往提出的急性缺氧引起肺動脈高壓、肺動脈收縮增強截然不同[12]。此外,以往的研究[5-8]發現,孕期缺氧可導致成年子代腸系膜、腎動脈及大腦中動脈的收縮功能增加,而本研究顯示孕期缺氧導致子代肺血管收縮降低,這說明孕期缺氧對子代血管功能的影響因血管類型的不同而不同。本研究創新性的從離子通道水平揭示孕期缺氧導致子代肺血管功能障礙的機制;研究結果提示應加強孕期發生缺氧胎兒出生后的隨訪,也為產前孕期缺氧子代心血管疾病的臨床治療提供實驗支持。

