水稻側根突變體Oslrd2的表型分析和基因克隆
朱俊兆 陳宇杰 呂沈陽 陳星月 楊愈之 鄭文娟 朱世華 丁沃娜,*
(1 寧波大學科學技術學院, 浙江 寧波 315212;2 寧波大學海洋學院,浙江 寧波 315211)
根系是植物獲取養分、水分以及穩固植株的重要器官。根系構型(root system architecture, RSA)具有高度可塑性,在植物物種之間和物種內部存在很大的差異[1]。側根(lateral roots, LRs)是RSA的一個重要組成部分,起源于中柱鞘細胞[2]。LRs在根系中占有較高的比重,提供大部分根系養分吸收的能力[3]。在水稻根系中,LRs約占總根系長度的97%、總根系體積的30%和總根系表面積的78%[4]。因此,側根的發生發育一直是水稻根系發育研究的重要方向。
目前,在水稻中已分離并遺傳鑒定了一些側根發育相關的突變體,其中已克隆的許多基因與生長素信號通路相關[5]。如生長素輸入載體OsAUX1[6],生長素信號負調控因子IAA基因OsIAA3[7]、OsIAA11[8]和OsIAA13[9],生長素輸出載體OsPIN2[10]等。OsAUX1的T-DNA插入突變體和RNAi敲除轉基因植株側根的起始均減弱[6];OsIAA3基因的突變體對生長素不敏感,側根數量顯著減少[7];OsIAA11基因突變后中柱鞘細胞分裂缺陷,阻斷了側根原基的起始[8];OsIAA13控制水稻側根啟動,突變體Osiaa13側根數量顯著減少[9];OsPIN2通過調控生長素分布參與側根形成[10]。此外,水稻復制起始識別復合體亞族基因OsORC3[11]、銨轉運體OsAMT1[12]、肌醇多磷酸激酶OsIPK2[13]、親環蛋白基因OsCYP2[14]等都對水稻側根的起始發育起著重要作用。還有少數水稻側根突變體如RM109[15]、hts1[16]和k209[17]的基因尚未克隆。
本研究以從甲基磺酸乙酯(ethyl methyl sulfonate, EMS)誘變的秈稻品種Kasalath突變體庫中篩選得到的側根突變體Oslrd2(Oryzasativalateralrootdefective2)為材料,對其進行表型和遺傳分析、圖位克隆、候選基因測序及轉基因互補驗證,旨在為深入解析水稻側根發生發育的分子機制奠定基礎。
1 材料與方法
1.1 試驗材料
從EMS誘變的秈稻(indica)地方品種Kasalath突變體庫(種子來源:寧波大學科學技術學院植物分子生物學實驗室)中篩選獲得水稻側根突變體Oslrd2,連續自交得到穩定遺傳的純合株系。將Oslrd2突變體和粳稻野生型品種Nipponbare(種子來源:寧波大學科學技術學院植物分子生物學實驗室)雜交,F1代自交產生的F2代用于遺傳分析和圖位克隆。在所有的溶液培養試驗中,植物生長環境由溫室控制,具體條件為:12 h光照周期(30℃)/12 h黑暗周期(22℃)、光照強度3 000 lux、相對濕度70%。
1.2 表型分析
野生型(wild type, WT)與突變體幼苗使用《國際水稻所標準營養液配方》[18]進行溶液培養,對培養7 d的幼苗進行表型測量,包括主根長、苗高、不定根長、側根數和側根長,對野生型及突變體分別隨機統計10株。
將溶液培養21 d的水稻幼苗轉移至大田土培,待成熟時選取生長狀況良好且無病害的野生型和突變體,對全株拍照,并記錄株高、分蘗數、每穗實粒數等農藝性狀,對野生型及突變體分別隨機統計10株。
1.3 側根原基形成的觀察
取溶液培養3 d的野生型和突變體Oslrd2主根,參考Wang等[19]的方法進行亞甲基藍染色:將切下的根固定在4℃的無水乙醇∶冰醋酸(3∶1,v/v)溶液中24 h以上,取出后用蒸餾水沖洗5 min,用0.01%的亞甲基藍對根進行染色。體視鏡觀察側根原基的發生情況。
取溶液培養5 d的野生型和突變體Oslrd2主根,按照以下方法進行解剖觀察:蒸餾水沖洗后,截取主根伸長區到成熟區的區段,用解剖針剝去表皮和大部分皮層,使側根原基顯露出來。將處理后的根系置于載玻片上,添加一滴水合氯醛透明劑(4 g水合三氯乙醛、1 mL甘油、2 mL H2O),蓋上蓋玻片于顯微鏡下觀察并采集圖像。
1.4 突變基因的圖位克隆
1.4.1 分子標記的選擇和設計 根據Gramene網站(http://www.gramene.org/)中已公布的簡單重復序列(simple sequence repeat, SSR)分子標記,選擇水稻12條染色體上的多態性SSR引物,對OsLRD2突變基因進行初定位。確定突變基因所在染色體大致位置后,逐步擴大群體,以粳稻Nipponbare和秈稻Kasalath間的序列差異為基礎,設計該區間內具有多態性的插入缺失標記(insertion-deletion, InDel),進行精細定位。
1.4.2 基因定位 取Kasalath、Nipponbare、F1和F2分離群體的水稻葉片,使用水稻基因組DNA快速微量提取法(TPS法)[20]提取DNA。篩選F2分離群體具有側根突變性狀株系的DNA,后通過PCR擴增靶基因。PCR總體系為20 μL:2×Es Taq MasterMix 10 μL,ddH2O 7.0 μL,10 μmol·L-1上游引物1.0 μL,10 μmol·L-1下游引物1.0 μL,模板DNA 1.0 μL。PCR程序為:94℃預變性4 min;94℃變性30 s,55℃退火30 s,72℃延伸30 s,30個循環;72℃終延伸5 min。再用聚丙烯酰胺凝膠電泳(SDS-polyacrylamide gel electrophoresis, SDS-PAGE)檢測PCR產物,通過硝酸銀染色后鑒定帶型,分析突變位點和分子標記的連鎖關系,驗證疑似連鎖的標記。根據水稻基因組數據庫網站(http://rice.plantbiology.msu.edu/cgi-bin/gbrowse/rice/)和EST數據庫(http://www.ncbi.nlm.nih.gov/)分析定位區間內的候選基因,測序驗證其突變位點。
1.5 轉基因互補驗證
根據OsLRD2基因編碼區序列(coding sequence, CDS),設計分別包括XbaⅠ和KpnⅠ酶切位點(下劃線表示)的上下游引物:OsLRD2-F(5′-A A AG G T A C CC G C C A T G A G G G A G T G C AT-3′)和OsLRD2-R(5′-A A AT C T A G AA G A T A G A A G C C C A C A C G G A C AG-3′)。以野生型葉片的cDNA為模板進行PCR擴增,PCR總體系為50 μL:2×PCR buffer for KOD FX 25 μL,ddH2O 10 μL,2 mmol·L-1dNTPs 10 μL,10 μmol·L-1上游引物1.5 μL,10 μmol·L-1下游引物1.5 μL,模板DNA 1.0 μL,1.0 unit·μL-1KOD FX DNA Polymerase 1.0 μL。PCR程序:94℃預變性2 min;98℃變性10 s,55℃退火30 s,68℃延伸90 s,30個循環;68℃終延伸5 min。將擴增得到的CDS片段與超表達載體pCAMBIA1300連接,通過農桿菌將已構建好的超表達載體導入突變體Oslrd2成熟胚誘導的愈傷組織中,經過植物組織培養分化成苗。選擇生長情況良好且根系表型正常的轉基因植株進行繁種,獲得純合株系后進行表型分析。
2 結果與分析
2.1 突變體Oslrd2的表型鑒定
對培育7 d的野生型(WT)和突變體Oslrd2幼苗進行表型觀察(表1),發現Oslrd2的地上部和根系發育均存在缺陷,苗高只有野生型的45.52%(圖1-A),主根和不定根的長度都受到明顯抑制,分別只有野生型的73.65%和51.34%(圖1-B)。Oslrd2側根的生長存在嚴重缺陷,體視鏡觀察并測量發現Oslrd2的側根長度只有野生型的9.04%(圖1-C~D、表1),側根數目也極顯著減少,只有野生型的36.49%。
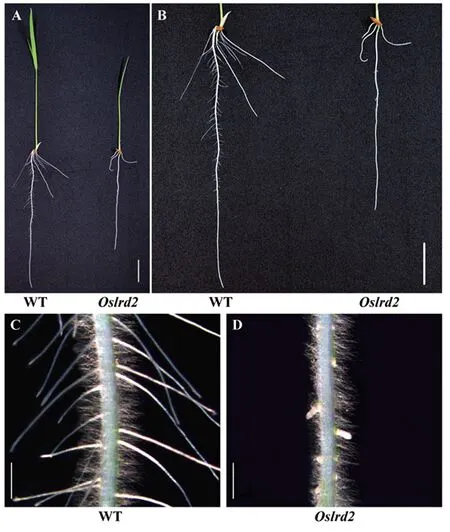
注:A:WT和突變體Oslrd2全株表型,標尺為2 cm;B:WT和突變體Oslrd2根部表型,標尺為2 cm;C:WT主根的體視鏡照,標尺為1 mm;D:突變體Oslrd2主根的體視鏡照,標尺為1 mm。Note: A: Seedlings of the WT and Oslrd2, bar=2 cm. B: The root of the WT and Oslrd2, bar=2 cm. C: The primary root of the WT under the stereoscope, bar=1 mm. D: The primary root of Oslrd2 under the stereoscope, bar=1 mm.圖1 野生型和突變體Oslrd2水培7 d幼苗表型Fig.1 The phenotype of 7-day-old hydroponic seedlings of the WT and mutant Oslrd2
進一步通過亞甲基藍染色方法對生長3 d的側根原基進行觀察(圖2-A、B),發現突變體Oslrd2側根原基的數量較野生型明顯減少,只有野生型的63.40%(圖2-C),表明Oslrd2側根數目的減少與側根原基發生相關。
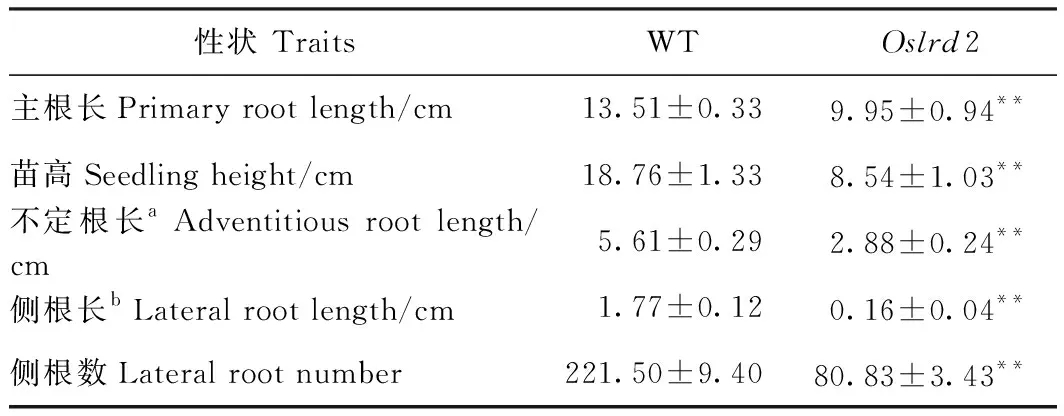
表1 野生型和突變體Oslrd2水培7 d幼苗表型比較Table 1 Characteristics of 7-day-old hydroponic seedlings of the WT and mutant Oslrd2
2.2 突變體Oslrd2側根原基的解剖觀察
通過解剖學方法對野生型和突變體Oslrd2生長5 d的側根原基進行觀察(圖3-A、B)。野生型的側根原基在整個發育過程中細胞排列較為緊密,細胞大小均一,連貫性較好,且較為圓潤(圖3-A);而突變體Oslrd2的側根原基隨著發育進程推進,形狀逐漸不規則,膨脹較為明顯,形成側根的直徑比野生型粗,側根原基的細胞排列混亂(圖3-B),側根的伸長受到明顯抑制。
2.3 突變體Oslrd2的農藝性狀分析
比較成熟期農藝性狀可知,Oslrd2的株高只有野生型的52.97%(圖4-A、C、E),葉片寬度明顯變窄(圖4-B);有效穗數、每穗實粒數和千粒重都顯著或極顯著降低,分別為野生型的26.09%、30.08%和85.21%(圖4-E);突變體種子長度與野生型相比無明顯差別,但寬度較野生型窄(圖4-D)。
2.4 突變體Oslrd2的遺傳分析
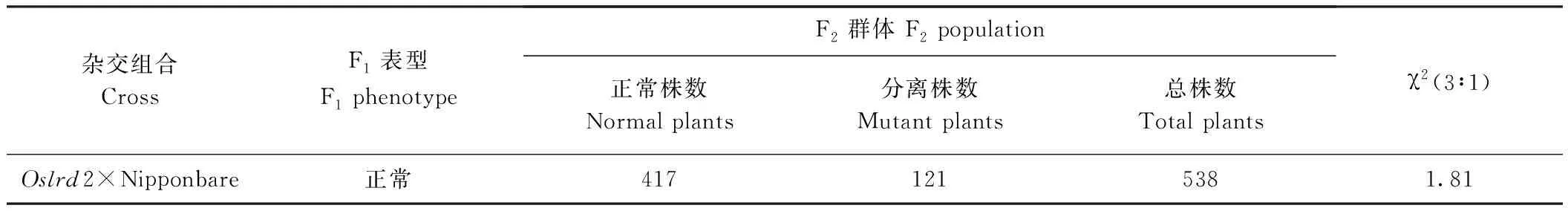
表2 突變體Oslrd2的遺傳分析Table 2 Genetic analysis of mutant Oslrd2
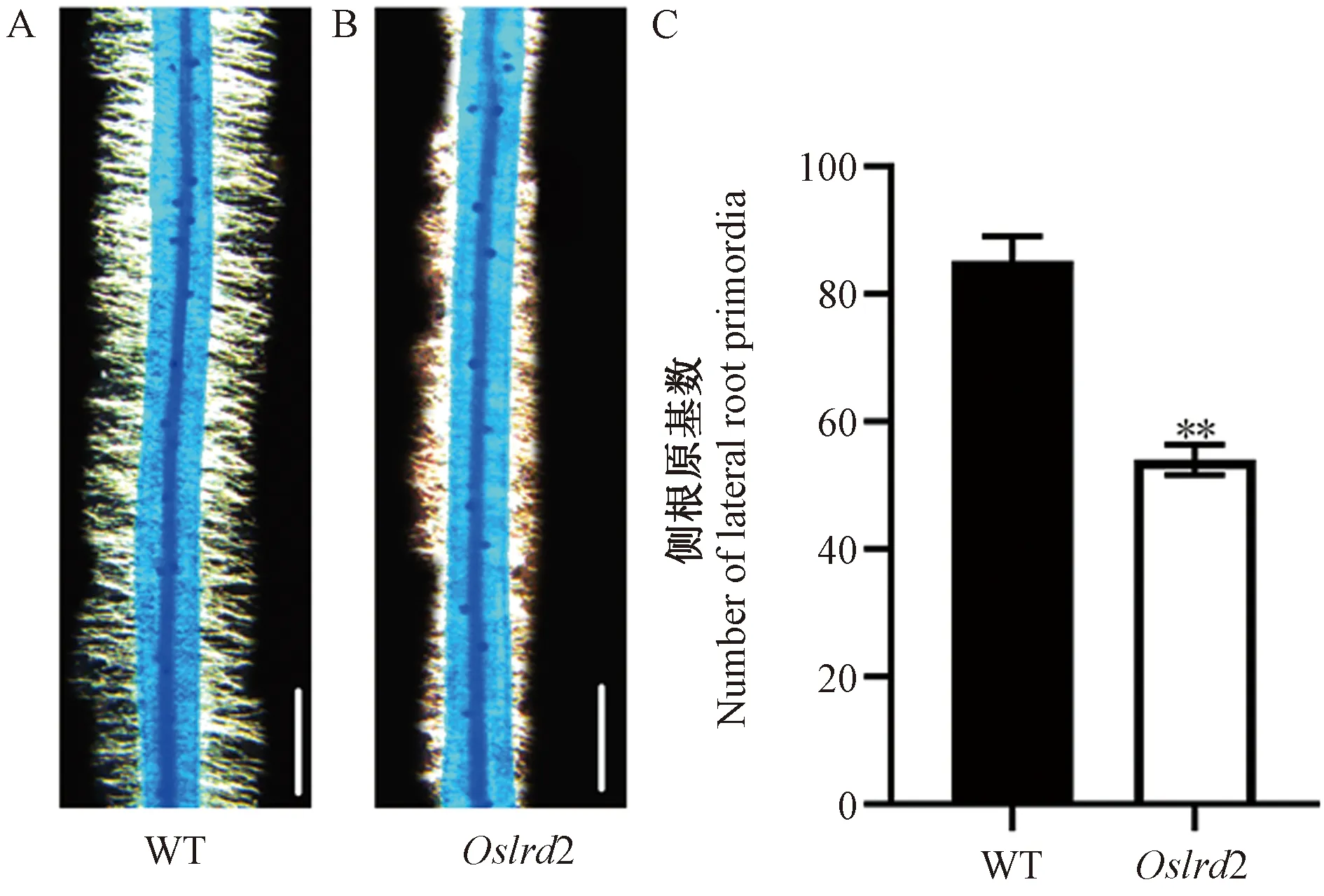
注:A:3 d苗齡的WT側根原基形成圖,標尺為1 mm;B:3 d苗齡的突變體Oslrd2側根原基形成圖,標尺為1 mm。C:WT和突變體Oslrd2側根原基數比較。*表示在0.05水平上差異顯著; **表示在0.01水平上差異極顯著。Note: A: Lateral root primordia formation of 3-day-old WT, bar=1 mm. B: Lateral root primordia formation of 3-day-old Oslrd2, bar=1 mm. C: Comparison of lateral root primordia between the WT and Oslrd2. * indicate significant difference at 0.05 level. ** indicate significant difference at 0.01 level.圖2 野生型和突變體Oslrd2水培3 d幼苗的側根原基觀察Fig.2 Lateral root primordia of 3-day-old hydroponic WT and mutant Oslrd2 seedlings
2.5 OsLRD2基因的圖位克隆
利用Kasalath、Nipponbare、F1和F2分離群體,通過水稻12條染色體上均勻分布的SSR引物對OsLRD2基因進行初步定位,將突變基因定位在第11條染色體上SSR標記RM120與RM3701之間。在此區間內設計4對多態性的InDel標記(InDel 1~4,附表1),同時擴大群體到1 330個,最終將突變基因鎖定在InDel 3和InDel 4之間約10 kb的區間內(圖5-A)。候選基因測序發現,基因號為LOC_Os11g14220的CDS序列中1 176 bp處(位于第4個外顯子)缺失了一個胞嘧啶(C)以及在1 179 bp處的胞嘧啶(C)突變為腺嘌呤(A)(圖5-B),導致氨基酸序列中第392位的天冬氨酸(D)變成了谷氨酸(E)和第393位的異亮氨酸(Ⅰ)變成終止密碼子TAA,導致翻譯提前終止(圖5-C),編碼產物只有392個氨基酸。LOC_Os11g14220基因編碼α-微管蛋白,DNA全長2 885 bp,CDS全長1 356 bp,編碼451個氨基酸,含4個外顯子和3個內含子。經過生物信息學分析發現該基因含有兩個結構域:Tubulin和Tubulin_C(圖5-C),其中的Tubulin屬于Tubulin/FtsZ 家族的GTP酶結構域,在第49~第246位氨基酸區間,是核苷酸結合位置。Tubulin_C屬于Tubulin/FtsZ家族的C末端結構域,包含第248~第393位氨基酸區間,是微管結合蛋白結合的位置,突變體Oslrd2的突變位點在此結構域中。
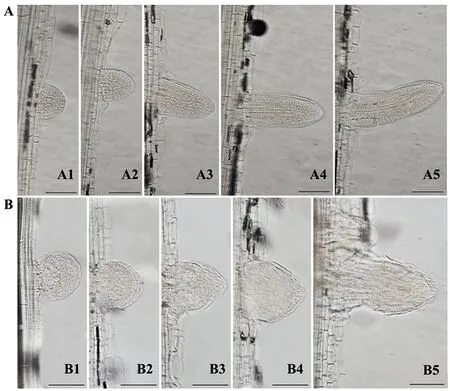
注:A:5 d苗齡的WT側根原基,A1~3為未突破主根表皮的側根原基,A4為側根原基頂端剛剛突破主根表皮,A5為開始伸長的側根,標尺為100 μm;B:5 d苗齡的突變體Oslrd2側根原基,B1~3為未突破主根表皮的側根原基,B4為側根原基頂端剛剛突破主根 表皮,B5為開始伸長的側根,標尺為100 μm。Note: A: Lateral root primordia at 5-day-old WT. A1~3 are the lateral root primordia that have not broken through the primary root epidermis, A4 is the lateral root primordium whose top just broke through the primary root epidermis, A5 is the lateral root that begins to elongate, bar=100 μm. B: Lateral root primordia of 5-day-old Oslrd2, B1~B3 are the lateral root primordia that have not broken through the primary root epidermis, B4 is the lateral root primordium whose top just broke through the primary root epidermis, B5 is the lateral root that begins to elongate, bar=100 μm.圖3 野生型和突變體Oslrd2的側根原基形態觀察Fig.3 Morphology of lateral root primordia in the WT and mutant Oslrd2
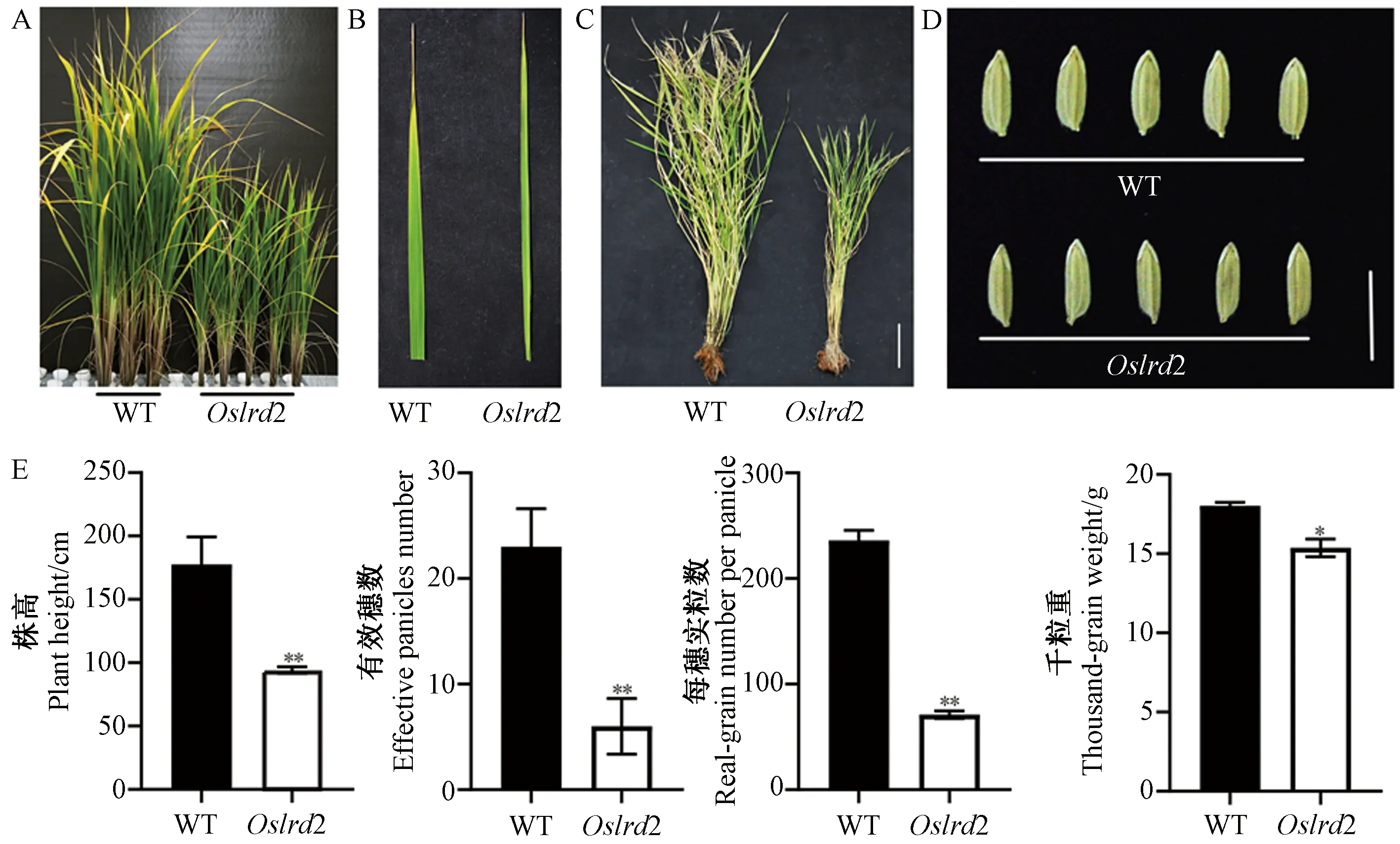
注:A:WT和突變體Oslrd2水培50 d地上部表型;B:WT和突變體Oslrd2水培50 d葉片表型;C:WT和突變體Oslrd2大田成熟全株,標尺為15 cm;D:WT和突變體Oslrd2種子形態比較;E:WT和突變體Oslrd2成熟期農藝性狀比較。*表示在0.05水平上差異顯著;**表示在0.01水平 上差異極顯著。Note: A: The aboveground part of 50-day-old hydroponic WT and Oslrd2 seedlings. B: The leaf of 50-day-old hydroponic WT and Oslrd2 seedlings. C: Mature plants of the WT and Oslrd2 cultivated in soil, bar=15 cm. D: Seeds of WT and Oslrd2, bar=1 cm. E: Agronomic traits of the WT and Oslrd2 at the maturation stage. * indicate significant difference at 0.05 level. ** indicate significant difference at 0.01 level.圖4 野生型和突變體Oslrd2成熟期表型Fig.4 The phenotype of the WT and mutant Oslrd2 at the maturation stage
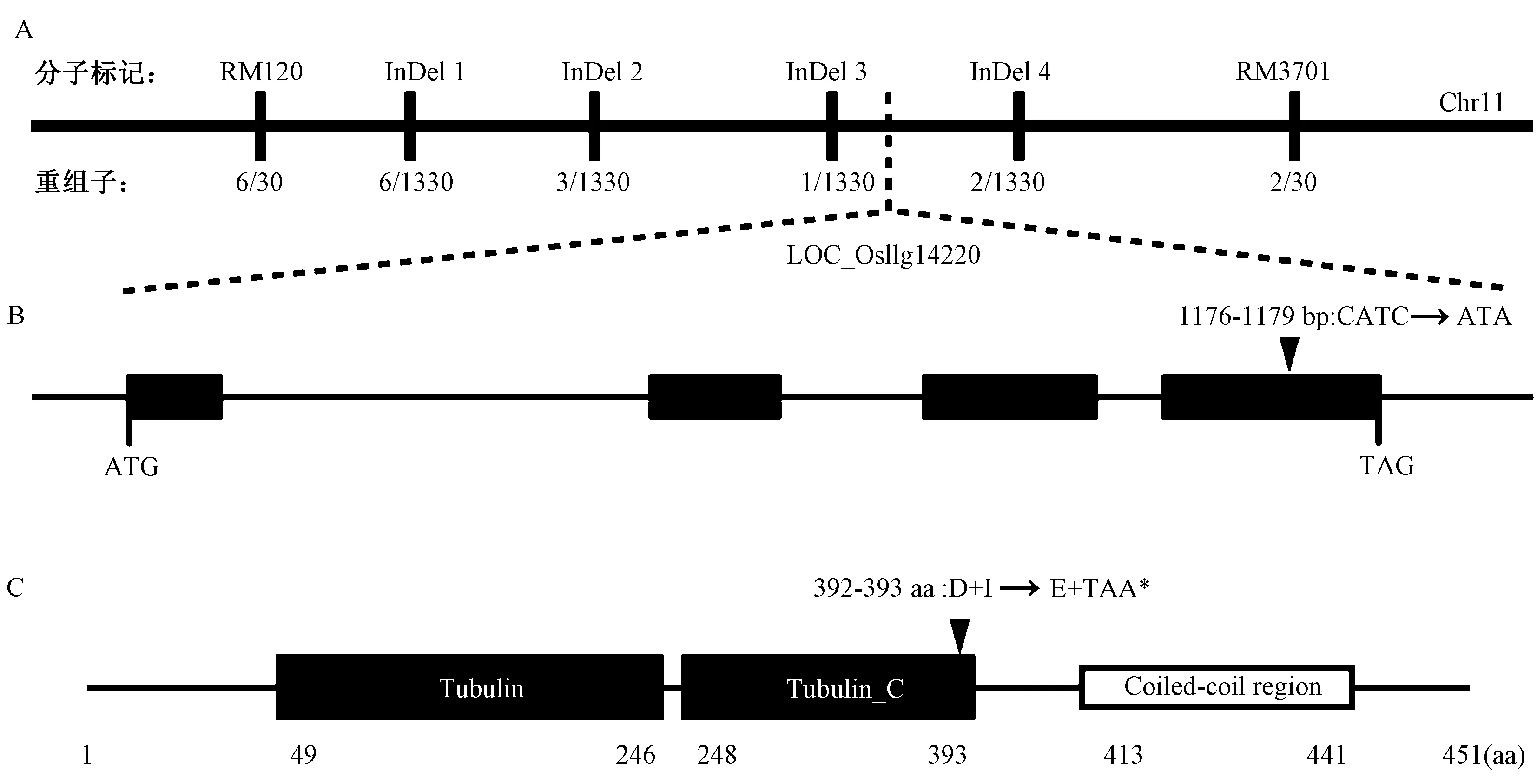
注:A:OsLRD2在11號染色體上的精細定位;B:OsLRD2基因結構,黑框代表外顯子;C:OsLRD2結構功能域,黑色框代表結構域,白色框代表盤繞線圈區域。Note: A: The fine mapping of OsLRD2 on chromosome 11. B: The gene structure of OsLRD2, black boxes represent exons. C: The structure and functional domain of OsLRD2, black boxes represent domain, and the white box represents Coiled-coil region.圖5 OsLRD2基因的圖位克隆Fig.5 The map-based cloning of OsLRD2
2.6 OsLRD2基因的互補驗證分析
為了進一步證明突變體的突變表型是由OsLRD2基因突變導致的,對突變體Oslrd2進行了轉基因回復驗證。構建的含有OsLRD2基因的超表達載體,經農桿菌介導侵染突變體Oslrd2誘導的愈傷組織并成功獲得轉基因回復株系,經過繁種并篩選獲得純合植株,純合的轉基因水稻的地上部和根系表型與野生型一致(圖6-A),體視鏡觀察側根數目和長度均為正常(圖6-B)。逆轉錄PCR(reverse transcription PCR, RT-PCR)分析結果表明,陽性轉基因植株中OsLRD2基因的表達增強(圖6-C)。上述結果證明突變體Oslrd2的突變表型是由OsLRD2的突變引起的。
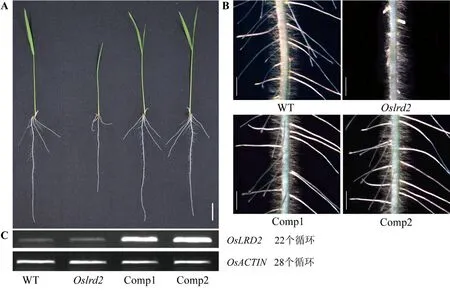
注:A:WT、突變體Oslrd2和兩個轉基因回復株系(Comp1、Comp2)的全株表型,標尺為2 cm;B:WT、突變體Oslrd2和兩個轉 基因回復株系(Comp1、Comp2)主根的體視鏡照,標尺為1 mm;C:RT-PCR分析結果。Note: A: Seedlings of the WT, Oslrd2, and two lines of transgenic plants (Comp1 and Comp2) in the Oslrd2 mutant background, bar=2 cm. B: The primary root of the WT, Oslrd2, and two lines of transgenic plants(Comp1 and Comp2) under the stereoscope, bar=1 mm. C: RT-PCR analysis result.圖6 OsLRD2 轉基因回復結果Fig.6 Transgenic complementation analysis of Oslrd2 result
3 討論
微管(microtubules, MTs)是細胞骨架的核心組成部分,參與細胞的形狀構成、運輸、運動和分裂[21]。MTs是真核細胞骨架的主要組成部分,由α和β微管蛋白異質二聚體組成,在聚合和解聚合之間相互轉換[22]。微管束形成是真核生物間期和有絲分裂微管系統有序排列的重要機制[23]。在植物生長發育過程中,MTs參與植物生長和形態建成的控制和重構[24]。雖然MTs的基本結構和動態特性在真核生物中是保守的,但植物已經進化出幾種獨特的微管系統控制植物特異的細胞分裂和擴張方式,從而影響細胞形態發生和分化[25-26]。本研究克隆的OsLRD2基因編碼一個α-微管蛋白,該基因突變后造成水稻側根原基的細胞排列混亂,側根的伸長受到明顯抑制(圖3);此外,葉片和種子寬度均變窄(圖4-B、D)。表明α-微管蛋白參與水稻細胞分裂過程,控制細胞膨脹的方向,在細胞擴張生長過程中起重要作用。
在水稻中,已報道的α-微管蛋白基因的功能研究較少。目前已有研究如水稻TID1基因[27]編碼α-微管蛋白,突變體Tid1-1表現為矮化和扭曲生長,葉片和莖呈螺旋狀生長,莖尖分生組織細胞數量增加,根細胞伸長受抑制,根尖分生組織細胞擴大,根部縮短;SRS5[28]編碼的α-微管蛋白調控了水稻種子細胞的伸長,突變體srs5與野生型相比,種子更短更圓,穗更短且植株表型半矮化;Liu等[29]通過CRISPR基因編輯技術對α-微管蛋白同源基因OsTubA2進行精確堿基編輯,形成一個點突變,突變后的水稻植株具有二硝基苯胺類除草劑抗性。
通過分析發現,上述三種α-微管蛋白基因TID1、SRS5、OsTubA2和本研究中的OsLRD2為同一個基因位點,但突變方式和對應性狀不同。TID1基因編碼的蛋白第56個氨基酸由蘇氨酸(T)突變為異亮氨酸(I)和第180個氨基酸由絲氨酸(S)突變為苯丙氨酸(F)都造成水稻葉片螺旋生長[27]。SRS5編碼的第308位氨基酸由精氨酸(R)突變為亮氨酸(L),導致外稃細胞長度減少,種子表現為小而圓[28]。TID1和SRS5都為單一氨基酸改變,本研究克隆的OsLRD2涉及多個氨基酸改變,其中第392位的天冬氨酸(D)突變為谷氨酸(E)和第393位的異亮氨酸(I)突變為終止密碼子(圖5-C)。OsLRD2突變后嚴重影響側根原基發生和側根伸長(圖1),但突變體Oslrd2的葉片正常,未出現螺旋生長的表型(圖4-B),其種子長度正常,寬度變窄(圖4-D)。以上結果表明α-微管蛋白基因的不同突變方式,會造成水稻不同的性狀改變。
目前水稻側根發育的分子生物學研究已取得較大進展,但對水稻側根的發生和發育的調控機制尚缺乏系統的認識。本研究對Oslrd2的表型和遺傳分析、圖位克隆、候選基因測序及轉基因互補驗證等試驗證明OsLRD2基因所編碼的α-微管蛋白是水稻側根起始生長和伸長所必需的。本研究為α-微管蛋白調控水稻生長發育的作用機制提供了一個新的認識。
4 結論
本研究從水稻側根突變體Oslrd2中克隆得到一個編碼α-微管蛋白的OsLRD2基因。通過亞甲基藍染色和解剖觀察發現突變體Oslrd2側根原基數目減少,且原基和側根的形態發生膨脹變形,表明OsLRD2突變抑制了水稻側根原基的發生和側根突破表皮,導致側根數目減少以及長度變短。成熟期農藝性狀統計發現,突變體Oslrd2的株高、有效穗數、每穗實粒數、千粒重等重要的農藝性狀都受到影響,表明OsLRD2基因與水稻產量密切相關。

附表1 用于OsLRD2基因定位的分子標記序列Supplementary table 1 Molecular markers and primers used to map OsLRD2

