細胞穿透肽增強氨基糖苷類抗生素殺菌作用的方法
石舒婷 王妍
摘 要:為驗證細胞穿透肽能否增強氨基糖苷類抗生素殺菌作用,選用具代表性的3種氨基糖苷類抗生素(妥布霉素、卡那霉素及鏈霉素)處理平臺期大腸桿菌。在特定抗生素處理濃度和處理時間下,進行平臺期大腸桿菌殺傷效果組間比較,用ANOVA算法分析試驗結果差異性;并使用NPN染色法探究細胞穿透肽增強氨基糖苷類抗生素殺菌作用機制。結果表明:細胞穿透肽預處理可以極顯著增強妥布霉素、卡那霉素及鏈霉素殺滅平臺期大腸桿菌,且細胞穿透肽對大腸桿菌細胞外膜造成輕微破壞。
關鍵詞:氨基糖苷類抗生素;多肽;耐藥
中圖分類號:S 858.28?? 文獻標志碼:A?? 文章編號:0253-2301(2022)01-0012-06
DOI: 10.13651/j.cnki.fjnykj.2022.01.003
Method of Enhancing the Bactericidal Action of Aminoglycoside Antibiotics by Cell Penetrating Peptides
SHI Shu-ting, WANG Yan*
(Fujian Provincial University Key Laboratory of Cellular Stress Response and Metabolic
Regulation/College of Life Science, Fujian Normal University, Fuzhou, Fujian 350108, China)
Abstract: In order to verify whether the cell penetrating peptides could enhance the bactericidal action of aminoglycoside antibiotics, three representative aminoglycoside antibiotics (tobramycin, kanamycin and streptomycin) were selected to treat Escherichia coli at plateau phase. Under the specific antibiotic treatment concentration and treatment time, the killing effect of Escherichia coli at plateau phase was compared between groups, and the differences of experimental results was analyzed by using the ANOVA algorithm. Then, the NPN staining method was used to explore the mechanism of cell penetrating peptides enhancing the bactericidal action of aminoglycoside antibiotics. The results showed that the pretreatment with cell penetrating peptides could extremely significantly enhance tobramycin, kanamycin and streptomycin to kill Escherichia coli at plateau phase, and the cell penetrating peptides could slightly damage the cell outer membrane of Escherichia coli.
Key words: Aminoglycoside antibiotics; Polypeptide; Drug resistance
自Fleming[1]發現第一種抗生素(青霉素),其在人類社會健康和經濟發展中占有重要地位[2],在農業和畜牧養殖業發展中亦擁有不可磨滅的功績。近年來,隨著臨床和養殖業中抗生素的廣泛應用,細菌耐藥問題在全球范圍內引起高度關注[3],找到解決細菌耐藥問題的方案至關重要[4]。
目前,全球對細菌耐藥采用的防治對策大致可歸結為三類:一是建立健全監管機制,控制抗生素濫用:世界衛生組織[4]及其成員國已制定相應計劃及政策[5];二是加快新型抗生素研發:包括針對抗MDR革蘭氏陰性菌的新型四環素、多粘菌素[6]、darobactin[7]等[8]。新型抗生素雖已取得臨床前良好試驗效果,然至今尚未獲得批準上市,且新型抗生素研發速度總體呈現下降趨勢[9];三是改善抗生素治療措施:包括抗生素聯合給藥[10]、“老藥新用”[11]以及改變抗生素處理條件[12]。傳統抗生素使用已有大量研究數據支持,其重新使用可能是應對細菌耐藥問題的有效方法。部分氨基糖苷類抗生素(妥布霉素、卡那霉素及鏈霉素)擁有豐富臨床研究數據,其殺菌機制主要是通過與細菌核糖體30 s亞基結合[13],使其發生讀碼錯誤。
近來,學者們陸續發現一些具有穿透細胞膜或核膜能力的氨基酸序列,其序列長度一般不超過30個氨基酸,統稱為細胞穿透肽[14]。經改造和修飾,細胞穿透肽甚至可以攜帶多種物質運送至細胞內特定位置。故利用細胞穿透肽破膜改變細菌藥物主動外排機制,可以降低細菌耐藥性,增強氨基糖苷類抗生素殺菌。本研究選用1種只含13個氨基酸的細胞穿透肽,命名為CMP[15]。CMP能夠破壞細菌細胞外膜,提高胞內抗生素濃度水平。通過使用CMP預處理平臺期大腸桿菌,可以增強傳統氨基糖苷類抗生素(妥布霉素、卡那霉素及鏈霉素)殺菌效果,即使用更低濃度氨基糖苷類抗生素和更短處理時間達到與以往相同甚至更好的殺菌效果。此方法極大減少氨基糖苷類抗生素使用濃度和作用時間,符合當前應對細菌耐藥防治策略趨勢。
1 材料與方法
1.1 試驗材料
本研究選用大腸桿菌K12 BW25113菌株,細胞穿透肽(CMP)序列:KFFKFFKFFKGSG(杭州丹港生物科技有限公司,多肽經過嚴格質量檢測,含質譜分析報告和HPLC分析報告,多肽純度在80%以上。)
1.2 主要試劑及試驗溶液
LB液體培養基(每1 L水包含10 g蛋白胨、10 g氯化鈉、5 g酵母粉)、LB固體培養基(每1 L水包含10 g蛋白胨、10 g氯化鈉、5 g酵母粉、10 g瓊脂)、0.01 mol·L-1 PBS溶液(每1 L水包含8 g氯化鈉、0.2 g氯化鉀、1.44 g磷酸氫二鈉、0.24 g磷酸二氫鈉)、超純水,以上溶液均經過高壓滅菌鍋121℃,30 min濕熱高壓滅菌。其中LB固體培養基滅菌完成后,倒入無菌培養皿中待其凝固即可使用。
妥布霉素(25 mg·mL-1)、卡那霉素(50 mg·mL-1)、鏈霉素(100 mg·mL-1),以上氨基糖苷類抗生素儲液均用超純水配置,并使用0.22 μm濾膜過濾除菌。
NPN熒光染料儲液(1 mmol·L-1),超純水配置,避光保存。
1.3 抗生素對平臺期大腸桿菌殺菌效果檢測
從-80℃冰箱挑取保藏的BW25113大腸桿菌,37℃,220 r·min-1,搖床過夜活化,之后1∶1000接種至含有20 mLLB液體培養基的搖瓶中,搖床37℃,220 r·min-1,培養至平臺期(16~24 h)。取500 μL細菌置于EP管中,13000 r·min-1離心3 min,吸取上清(舊LB)置于無菌器皿內,用500 μL0.01 mol·L-1 PBS溶液重懸菌體,靜置5 min,再次離心去上清。
用500 μL超純水重懸菌體,各個處理樣品中加入CMP(終濃度10 μmol·L-1)混勻,室溫下靜置處理5 min,離心去上清。加入舊LB培養基,移至玻璃搖菌管中并加入抗生素,搖床37℃,220 r·min-1振蕩處理,每1、3、5 h取樣50 μL,離心去上清,加入500 μLPBS重懸清洗5 min,再次離心去上清,用50 μLPBS重懸,進行10倍濃度梯度稀釋。將稀釋好的菌液滴于正常LB平板上測試細菌存活情況。
1.4 細胞穿透肽(CMP)對大腸桿菌外膜破壞檢測
從-80℃冰箱活化菌株BW25113,1∶1 000轉接至LB液體培養基中,搖床(37℃,220 r·min-1)培養至平臺期。取100 μL菌液置于EP管中,13000 r·min-1,3 min離心去上清,將沉淀重懸于相同體積的PBS中,靜置5 min,再次離心去上清,后用同體積超純水重懸沉淀,將CMP(終濃度為10 μmol·L-1)加入處理,同時向細菌溶液中加入等量PBS作為空白對照組處理5 min。離心去上清,將沉淀重懸于同體積PBS中。而后用PBS將菌液稀釋至約為1×108 CFU·mL-1。移至黑色EP管,將5 μL NPN熒光染料(終濃度10 μmol·L-1)添加到黑色EP管中,避光孵育,使用紫外熒光分光光度計在激發波350 nm和發射波長420 nm條件下,0、5、10 min監測NPN熒光強度。
2 結果與分析
2.1 細胞穿透肽(CMP)增強氨基糖苷類抗生素對平臺期大腸桿菌的殺菌效果
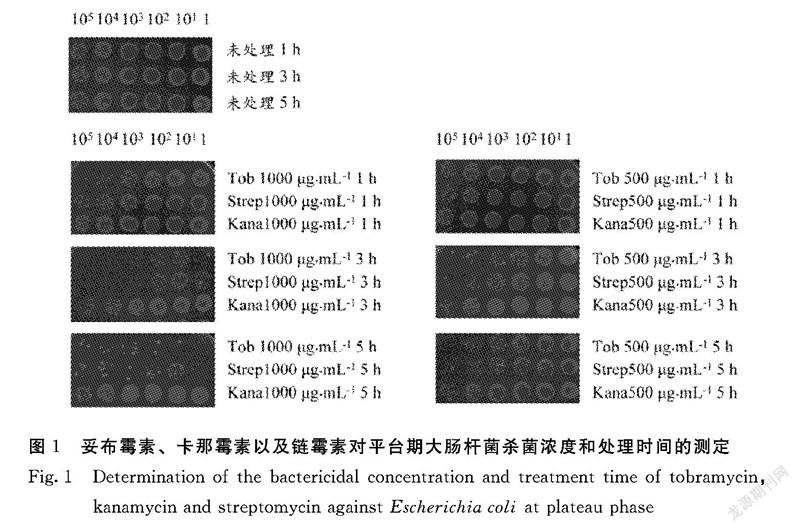
2.1.1 妥布霉素、卡那霉素以及鏈霉素對平臺期大腸桿菌殺菌濃度和處理時間測定 首先,本研究將平臺期大腸桿菌用妥布霉素(Tob)、卡那霉素(Kana)以及鏈霉素(Strep)進行單獨殺菌處理,處理終濃度為1000 μg·mL-1和500 μg·mL-1,由圖1可知:除卡那霉素終濃度為500 μg·mL-1時處理平臺期大腸桿菌1、3和5 h均沒有殺菌效果外,其余2種抗生素在處理平臺期大腸桿菌3 h和5 h后都對細菌造成2~4個數量級殺傷效果。
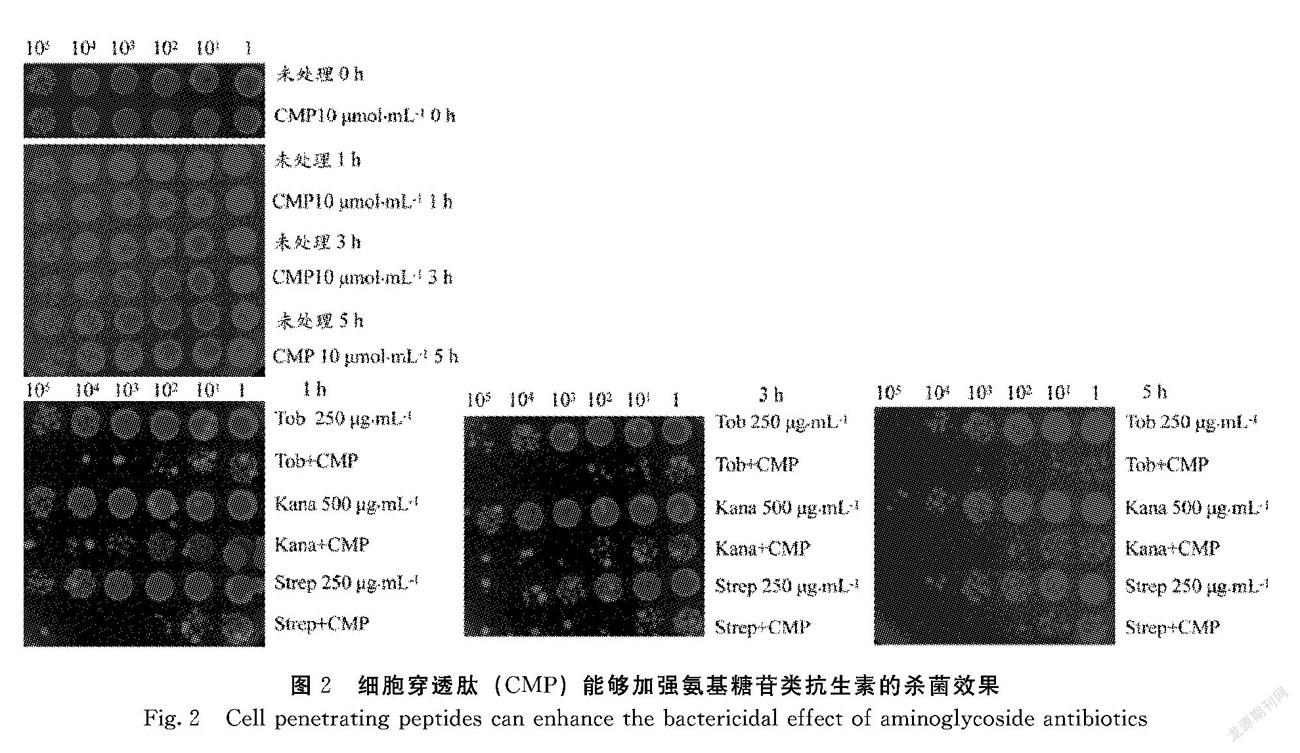
2.1.2 細胞穿透肽(CMP)能夠加強氨基糖苷類抗生素殺菌效果 根據上述結果,將卡那霉素處理終濃度定為500 μg·mL-1,妥布霉素和鏈霉素處理終濃度下調至250 μg·mL-1。根據以往試驗結果,細胞穿透肽(CMP)預處理終濃度為10 μmol·L-1。由圖2可知,單獨使用終濃度10 μmol·L-1CMP處理平臺期大腸桿菌,在1、3和5 h內均無殺傷效果,故排除CMP自身殺菌情況。CMP預處理后,細菌在1 h便被終濃度為250 μg·mL-1妥布霉素殺傷4~5個數量級,相同濃度下單獨妥布霉素處理組沒有表現出對細菌殺傷。在3、5 h時,單獨妥布霉素處理組對細菌表現2個數量級殺傷,但CMP預處理組在3、5 h時對細菌表現出4個數量級殺傷。卡那霉素和鏈霉素殺菌情況亦是如此。
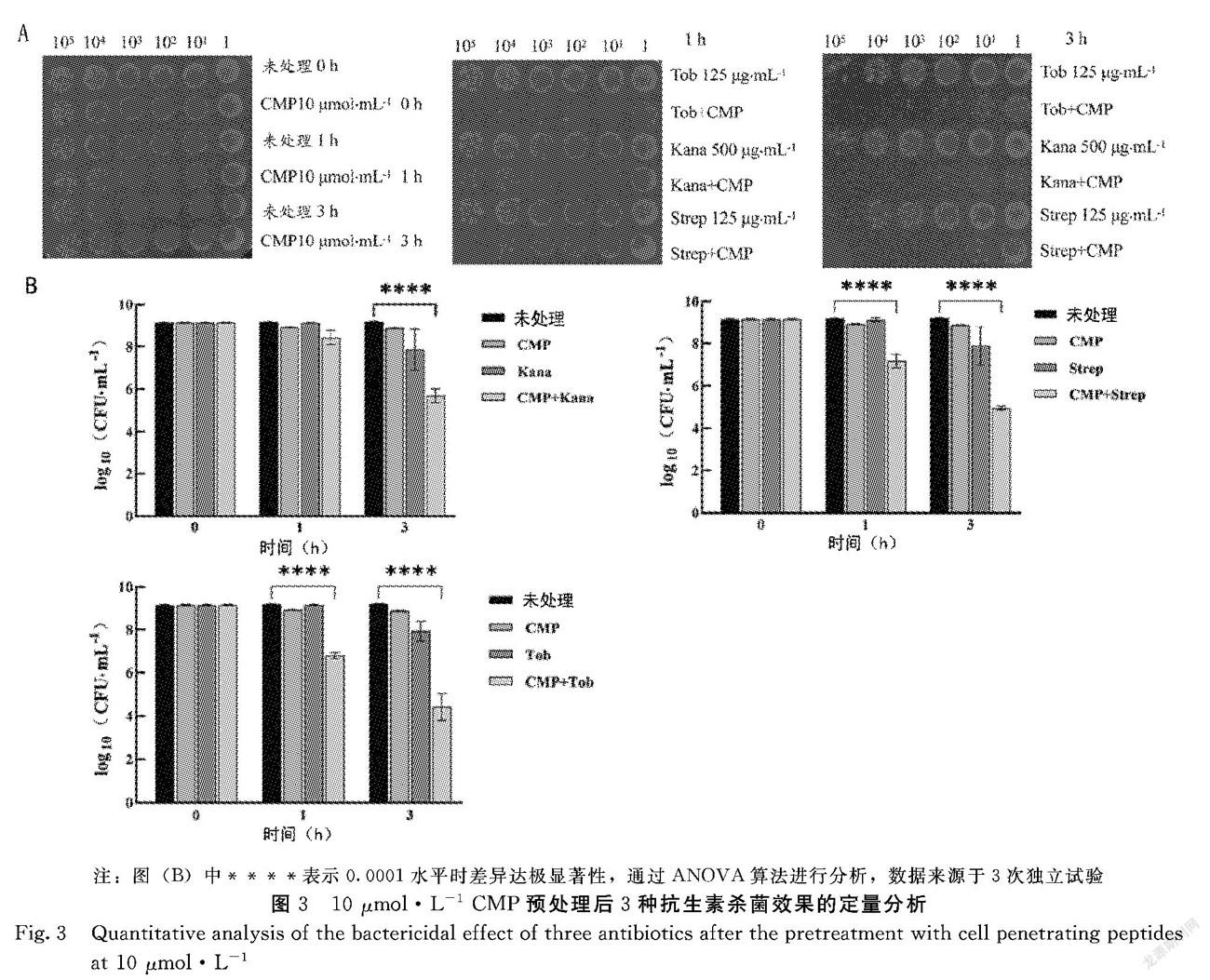
2.1.3 特定濃度細胞穿透肽(CMP)處理后氨基糖苷類抗生素殺菌效果的定量分析 綜上,優化試驗條件,進行3次獨立試驗完成定量分析。3次獨立試驗所使用CMP預處理終濃度為10 μmol·L-1,妥布霉素終濃度為125 μg·mL-1,卡那霉素終濃度為500 μg·mL-1,鏈霉素終濃度為125 μg·mL-1,取樣時間為1、3 h。圖3A為其中1次試驗表型結果展示,圖3B是3次獨立試驗所得數值定量統計分析。由圖3B可知,與試驗對照組相比,CMP預處理組的3種抗生素均表現出對平臺期大腸桿菌更強的殺菌作用。在1 h內,CMP預處理情況下,妥布霉素殺4個數量級、鏈霉素殺2個數量級、卡那霉素殺1個數量級;在3 h內,CMP預處理情況下,妥布霉素和鏈霉素表現出對平臺期細菌4個數量級殺傷,卡那霉素亦達到對細菌3個數量級殺傷。根據試驗結果得出結論,CMP預處理可以促進氨基糖苷類抗生素殺菌作用,并且效果極其顯著。
2.2 CMP通過破壞細胞膜增加傳統氨基糖苷類抗生素殺菌效果
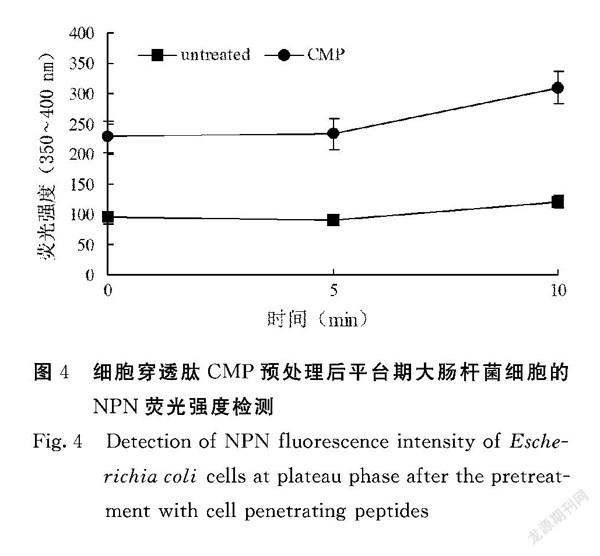
利用NPN熒光染料對CMP處理過的細菌進行染色,以驗證CMP是否破壞細胞膜。由圖4可知,起始時(0 min)CMP預處理組熒光強度高于對照組,在隨后5、10 min檢測中,NPN熒光強度一直呈上升趨勢,且數值增加幅度大;反觀對照組,熒光強度初始處于較低狀態,隨2次監測強度略微上升,不排除部分細菌自然發生一個外膜損傷造成上升現象。由此可得,CMP預處理造成細菌外膜破壞,且該破壞是輕微不致死的,不破壞細胞膜生物結構。
3 結論與討論
抗生素發展應用與細菌耐藥性產生,是一種密不可分的關系,細菌耐藥性隨抗生素廣泛應用而愈演愈烈[16],新藥研發難以跟上細菌自身耐藥性發展的腳步[17]。本研究從促進傳統抗生素殺菌效果的理念出發,利用細胞穿透肽CMP對細菌進行短時間預處理,增強氨基糖苷類抗生素殺菌效果。以妥布霉素為例,單獨抗生素處理的平臺期大腸桿菌,在妥布霉素終濃度為1000 μg·mL-1處理1 h的條件下被殺滅2個數量級,而經CMP預處理的細菌,終濃度為125 μg·mL-1妥布霉素處理相同時間,被殺滅3~4個數量級。在相同處理時間內,抗生素濃度下降8倍之多,且殺菌效果不減反增。其余2種抗生素亦展現此種增效現象。本試驗結果表明,通過細胞穿透肽預處理是一種有效增強氨基糖苷類抗生素殺菌的方法。通過熒光染料NPN發現CMP輕微破壞細胞外膜,故推測其增強抗生素殺菌效果的機制是通過破壞細菌藥物主動外排機制,提高胞內抗生素水平,從而展現更強的殺菌效果。
從生態學看來,現代抗生素臨床及農業畜牧業等方面的廣泛應用[18]為細菌創造一個與自然進化相似且更為苛刻嚴峻的生存環境[19],此種情況頻繁發生勢必增加細菌耐藥性基因的進化速度、傳播速度以及富集速度[20]。因此,在達到相同殺菌效果的同時,迂回降低抗生素處理濃度,減緩細菌耐藥情況發生,特別是對于早期開發的一些經典抗生素,通過對其殺菌方法“回爐重造”,讓經典抗生素再一次為人類所用,于當今細菌耐藥性問題而言不失為一種頗有前景的解決方法。
參考文獻:
[1]FLEMING A.On the antibacterial action of cultures of a penicillium, with special reference to their use in the isolation of B.inflfluenzae[J].Bulletin of the World Health Organization, 1929, 79 (8): 780-790.
[2]胡永飛,朱寶利.細菌耐藥專刊序言[J].生物工程學報 2018, 34(8): 1201-1204.
[3]杜鵑,謝峻,鄭穎城,等.《抗生素耐藥:全球監測報告 2014》解讀與反思[J].華南國防醫學雜志, 2014, 28(8): 814-817.
[4]WEINER L M, WEBB A K, LIMBAGO B, et al.Antimicrobial-Resistant Pathogens Associated With Healthcare-Associated Infections: Summary of Data Reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2011-2014[J].Infection Control & Hospital Epidemiology,2016, 37(11): 1288-1301.
[5]KITANO H, TEISHIMA J, SHIGEMURA K, et al.Current status of countermeasures for infectious diseases and resistant microbes in the field of urology[J].International Journal of Urology, 2019, 26(12): 1090-1098.
[6]OTSUKA Y.Potent Antibiotics Active against Multidrug-Resistant Gram-Negative Bacteria[J].Chemical & Pharmaceutical Bulletin,2020, 68(3): 182-190.
[7]YU I, MEYER K J,IINISHI A, et al.A new antibiotic selectively kills Gram-negative pathogens[J].Nature, 2019, 576: 459-464.
[8]ZHANEL G G, LAWSON C D, ZELENITSKY S, et al.Comparison of the next-generation aminoglycoside plazomicin to gentamicin, tobramycin and amikacin[J].Expert Review of Anti-infective Therapy, 2012, 10(4):459-473.
[9]LEVIN, STUART.The crisis in antibiotic resistance[J].Infectious Diseases in Clinical Practice,1993, 2(1): 53.
[10]FASS R.Comparative in vitro activities of beta-lactam-tobramycin combinations against Pseudomonas aeruginosa and multidrug-resistant gram-negative enteric bacilli[J]. Antimicrobial Agents and Chemotherapy,1982, 2(1):1003-1006.
[11]CHEN F, DI H, WANG Y, et al.Small-molecule targeting of a diapophytoene desaturase inhibits S.aureus virulence[J].Nature Chemical Biology, 2016, 12(3):174-179.
[12]ZHAO Y, LV B, SUN F, et al.Rapid Freezing Enables Aminoglycosides To Eradicate Bacterial Persisters via Enhancing Mechanosensitive Channel MscL-Mediated Antibiotic Uptake[J].mBio, 2020, 11(1).
[13]鄭衛.氨基糖苷類抗生素研究的新進展[J].國外醫藥抗生素分冊,2005,26(3):10.
[14]VIVè E, BRODIN P, LEBLEU B.A truncated hiv-1 tat protein basic domain rapidly translocates through the plasma membrane and accumulates in the cell nucleus[J].Journal of Biological Chemistry, 1997, 272(25):160-170.
[15]TINCHO M B, MORRIS T, MEYER M, et al.Antibacterial Activity of Rationally Designed Antimicrobial Peptides[J].International Journal of Microbiology, 2020(2):1-9.
[16]鐘艾玲, 田敏, 劉艷全, 等.氨基糖苷類抗生素的耐藥機制研究進展 [J].中國抗生素雜志, 2019, 44(4): 5.
[17]BLAIR J, WEBBER M A, BAYLAY A J, et al.Molecular mechanisms of antibiotic resistance[J].Nature Reviews Microbiology, 2015, 13(1): 42-51.
[18]李昕,曾潔,王岱,等.細菌耐藥耐受性機制的最新研究進展[J].中國抗生素雜志,2020,45(2):113-120.
[19]DISSMANN E, IGLAUER E.Clinical causes of bacterial resistance in pulmonary tuberculosis[J].Der Tuberkulosearzt, 1961, 15: 233.
[20]LEVIN-REISMAN I, RONIN I, GEFEN O, et al.Antibiotic tolerance facilitates the evolution of resistance[J].science, 2017, 355(6327): 826-830.
(責任編輯:柯文輝)
收稿日期:2021-12-05
作者簡介:石舒婷,女,1996年生,碩士研究生,主要從事細菌耐藥研究。
通信作者:王妍,女,1987年生,博士,副教授,主要從事細菌外膜蛋白生成研究(E-mail:wangyan@fjnu.edu.cn)。
基金項目:福建省科技廳基金青年創新項目(2018J05056)。
3488501908250

