化學實驗題解答策略
——明確實驗目的,分析實驗原理,正確解答問題
劉 影 李 康 陳 誠
(安徽省宿州市宿城第一中學)
化學是以實驗為基礎的自然科學,化學實驗不僅是化學教學中非常重要的組成部分,也是現在高考中考查的重點和難點.常見的考查題型有物質制備型實驗題、物質性質驗證型實驗題和探究型實驗題.這類題不論以什么形式呈現,解題的基本策略大同小異.解題時要先明確實驗目的,即通過這個實驗,我們想達到什么目的(不外乎是制備某種物質、驗證或探究某種物質的某種或某些性質等).在明確實驗目的的基礎上,結合自身知識體系和題目中所給信息,分析出實驗原理.也就是說,為了達到上述實驗目的,采取什么樣的方法(實驗原理通常以反應方程式的形式呈現).在明確原理的基礎上,再去分析各裝置或操作的作用,進而正確解答問題.在這一策略中,明確實驗目的是根本,分析實驗原理是靈魂,在完成前述活動的基礎上,正確解答問題就水到渠成了.
在解答實驗題時,一定不能本末倒置,不能開始就去分析甚至去猜裝置的作用、操作的目的等,這樣往往既浪費時間,也不能正確解答.本文分類展示各題型解答過程,希望可以給學生提供一些幫助.
1 制備型實驗題
該類題型的實驗目的通常是為了制備某一物質,實驗原理基本為制取該物質的化學反應方程式.常見實驗過程為實驗原料的預處理(凈化、粉碎等)→物質制備→凈化除雜→物質收集→尾氣處理.裝置的選擇也是圍繞這一過程,為了實現這一過程而確定的,通常有發生裝置、除雜裝置、收集裝置和尾氣處理裝置.
這種題型較經典,考查難度通常不大,對于一些陌生物質的制備,結合題目所給信息,利用這一解題策略,可以輕松應對.
例1無水四氯化錫(SnCl4)可用于制作導電玻璃,導電玻璃廣泛用于液晶顯示屏、薄膜太陽能電池基底等.可用圖1所示裝置制備四氯化錫(部分夾持裝置已略去).有關信息如表1所示.
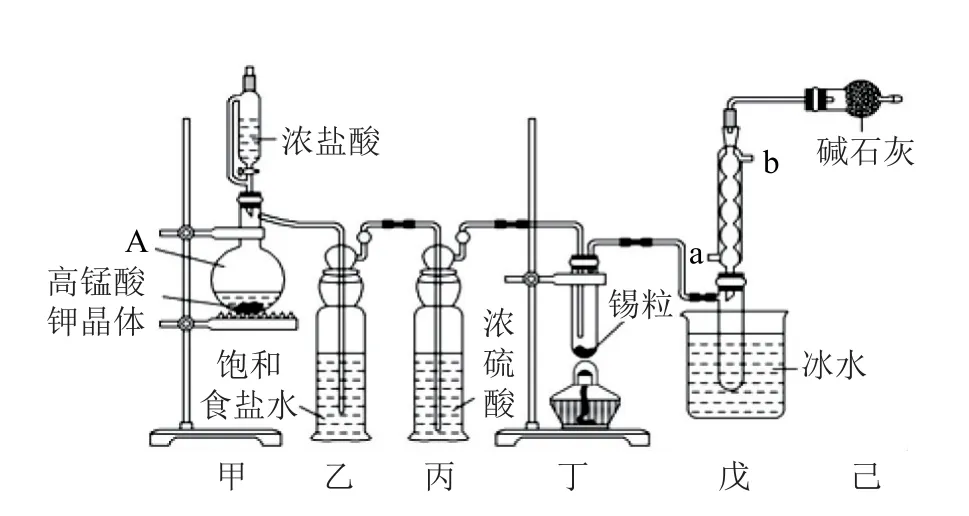
圖1
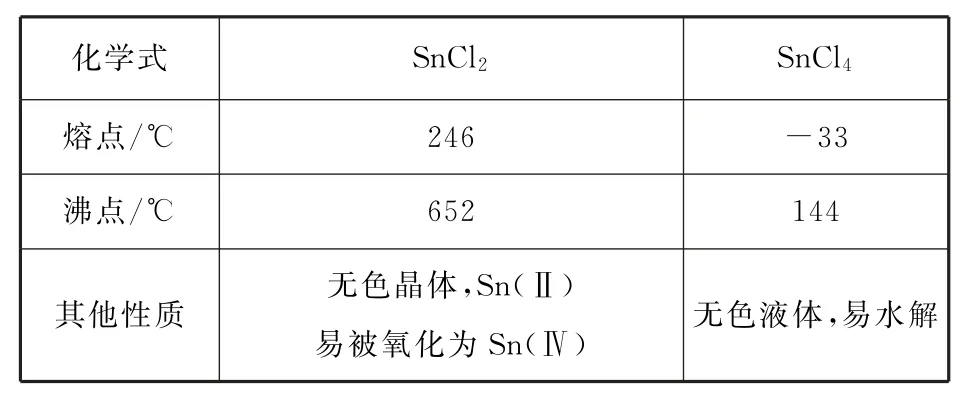
表1
回答下列問題:
(1)儀器A 中發生反應的離子方程式為______.
(2)將裝置按圖1所示連接好,檢查氣密性,慢慢滴入濃鹽酸,待觀察到_________(填現象)后,開始加熱丁裝置.錫熔化后適當增大氯氣流量并繼續加熱丁裝置.繼續加熱丁裝置的目的是促進氯氣與錫反應和_________.
(3)如果缺少乙裝置可能產生的后果是_________.
(4)戊裝置中球形冷凝管的冷水進口為_________(填“a”或“b”).
(5)己裝置中堿石灰的作用是_________.
(6)碘氧化法滴定分析產品中Sn(Ⅱ)的含量.準確稱取mg產品于錐形瓶中,用適量濃鹽酸溶解,以淀粉溶液作指示劑,用cmol·L-1碘標準溶液滴定.滴入最后1滴標準溶液,出現_________時達到滴定終點,此時消耗碘標準溶液VmL,則產品中Sn(Ⅱ)的質量分數為_________(用字母表示).

該實驗的目的為制備無水SnCl4,由裝置可以看出在丁處試管內發生反應制得目標產物,該實驗原理為.在明確實驗原理的基礎上,結合裝置圖,可知甲是氯氣發生裝置.(1)儀器A 中的離子反應方程式為10Cl-+16H++=5Cl2↑+8H2O+2Mn2+.(2)乙是除雜裝置,除去Cl2中混有的HCl雜質氣體,丙為干燥裝置,進入丁中的就是干燥純凈的Cl2,待觀察到丁裝置內充滿黃綠色氣體后,開始加熱裝置丁;結合題目所給信息,由SnCl2和SnCl4的熔、沸點數據可以看出,丁裝置的作用為制備SnCl4,并利用其沸點低的性質加熱以促進SnCl4汽化,使SnCl4蒸氣進入戊中便于收集;同時由于SnCl4的沸點較低,戊裝置作用為冷凝回流收集SnCl4,提高SnCl4的產率.(3)乙是除雜裝置,除去Cl2中混有的HCl雜質氣體.(4)冷凝管中的冷卻水應由下口進入.(5)制取SnCl4過程中由于Cl2不能完全反應,需要對尾氣進行處理,則己裝置中堿石灰的作用是吸收未反應的氯氣,防止污染空氣,同時可以防止水蒸氣進入戊裝置的試管中使產物水解.(6)對滴定終點的判斷描述可以套用答題模板:當滴入最后1滴碘水,溶液變藍,且30s內不恢復至無色,則達到滴定終點.再根據反應方程式進行計算,可得此時消耗碘標準溶液VmL,由Sn2++I2=Sn4++2I-,可知n(SnCl2)=n(I2)=cV×10-3mol,Sn(Ⅱ)的質量分數為
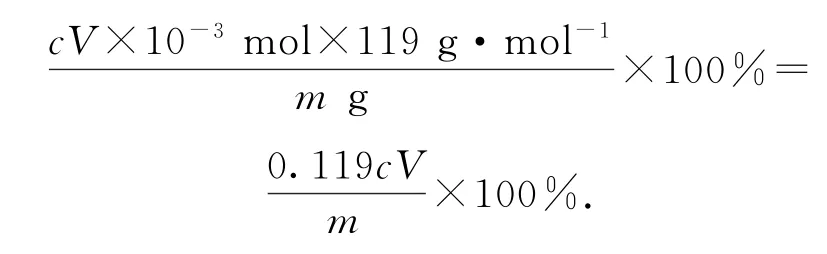
變式氫化鈣固體是登山運動員常用的能源提供劑.某興趣小組擬選用如圖2 所示的裝置制備氫化鈣.
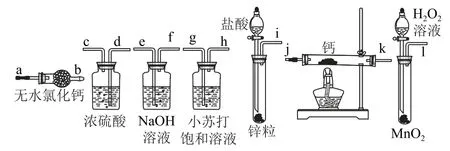
圖2
請回答下列問題:
(1)請選擇必要的裝置,按氣流方向連接順序為________(填儀器接口的字母編號).
(2)根據完整的實驗裝置進行實驗,實驗步驟如下:檢查裝置氣密性后,裝入藥品;打開分液漏斗活塞________(請按正確的順序填入下列步驟的標號).
A.加熱反應一段時間
B.收集氣體并檢驗純度
C.關閉分液漏斗活塞
D.停止加熱,充分冷卻
(3)實驗結束后,某同學取少量產物,小心加入水中,觀察到有氣泡冒出,溶液中加入酚酞后顯紅色,該同學據此判斷,上述實驗確有CaH2生成.
①寫出 CaH2與水反應的化學方程式________;
②該同學的判斷不正確,原因是_________.
(4)請設計一個實驗,用化學方法區分鈣與氫化鈣,寫出簡要實驗步驟及觀察到的現象_________.
(5)登山運動員常用氫化鈣作為能源提供劑,與氫氣相比,其優點是_________.
答案(1)i→e,f→d,c→j,k(或k,j)→a.
(2)B、A、D、C.
(3)①CaH2+2H2O=Ca(OH)2+2H2↑.
②金屬鈣與水反應也有類似現象.
(4)取適量氫化鈣,在加熱條件下與干燥氧氣反應,將反應氣相產物通過裝有無水硫酸銅的干燥管,觀察到白色變為藍色;取鈣做類似實驗,觀察不到白色變為藍色.
(5)氫化鈣是固體,攜帶方便.
2 驗證型實驗題
該類題型往往既考查物質的性質,又考查物質的制備,通常以對物質性質的考查為主.需要學生根據題目要求分析驗證物質的性質,確定實驗原理,尋找所需試劑、儀器及方法,對于多種性質的驗證,要根據互不干擾的原則確定性質驗證的順序.解這類題型的難點在于確定物質性質驗證的先后順序,要求學生要扎實掌握元素化學和實驗化學的基礎知識,對學生靈活運用知識解決實際問題的能力素養要求較高.
例2Fe3O4是一種非常重要的磁性材料,同時也可用作催化劑載體和微波吸收材料.Fe3O4有多種不同制法.甲同學查閱資料發現,溫度高于570℃時鐵與水蒸氣反應的氧化產物只有Fe3O4.該同學利用圖3裝置(部分裝置已略去)進行“鐵與水蒸氣反應”的實驗,并檢驗產物.

圖3
請回答下列問題:
(1)儀器D的名稱是________,E裝置的作用是_________.
(2)裝置B 中發生反應的化學方程式為_______.
(3)若甲同學稱取16.8gFe粉放于硬質玻璃管B中,在溫度高于570 ℃,反應一段時間后停止加熱,冷卻后稱得固體質量為20.0g,則實驗后的固體物質中氧化物的質量為________g;取實驗后的固體加入過量鹽酸充分反應,檢驗溶液中是否含有Fe2+的方法是向溶液中滴加_________.
A.酸性高錳酸鉀溶液
B.硫氰化鉀溶液再通氯氣
C.NaOH 溶液
D.鐵氰化鉀溶液

該實驗的目的是制備Fe3O4并驗證產物中是否有氫氣,原理為:用A 裝置產生水蒸氣,通入裝有還原鐵粉的B中,若發生反應則生成Fe3O4和H2.對生成的H2利用CuO 進行驗證,所以D 裝置作用為干燥H2,E 裝置中的CuO 可以和H2反應生成銅和水,通過E 中粉末顏色由黑變紅,可以檢驗生成的氫氣.根據反應前后固體質量的變化,利用差量法進行計算,由于鐵與水蒸氣反應的氧化產物只有Fe3O4,根據反應方程式:
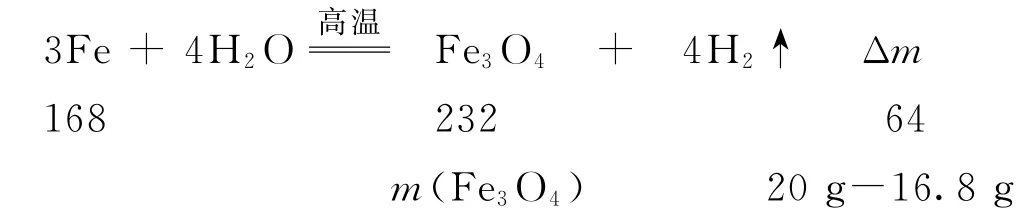
計算可知生成的Fe3O4的質量為11.6g,物質的量為0.05mol,則鐵的質量為20g-11.6g=8.4g,物質的量為0.15mol.向實驗后的固體中加入過量鹽酸充分反應,鐵粉過量,所以反應后的溶液中只有Fe2+.Fe2+的檢驗可以用可溶性堿溶液、鐵氰化鉀溶液、硫氰化鉀和氯水等.本題中用過量鹽酸溶解固體,不能用酸性高錳酸鉀溶液,因為溶液中有Cl-,容易被酸性高錳酸鉀溶液氧化,對Fe2+的檢驗存在干擾.
變式圖4虛線框中的裝置可用來檢驗濃硫酸與木炭粉在加熱條件下反應產生的所有氣體產物,填寫下列空白.
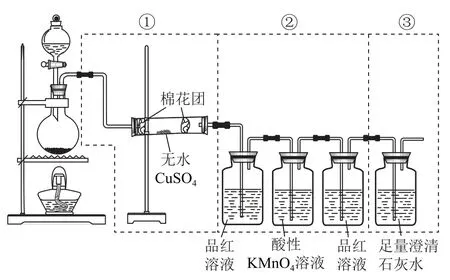
圖4
(1)如果將裝置中①②③三部分儀器的連接順序變為②①③,則可以檢出的物質是_________;不能檢出的物質是_________.
(2)如果將儀器的連接順序變為①③②,則可以檢出的物質是_________;不能檢出的物質是_________.
(3)如果將儀器的連接順序變為②③①,則可以檢出的物質是_________;不能檢出的物質是_________.
答案(1)SO2、CO2;H2O.(2)H2O;SO2、CO2.(3)SO2、CO2;H2O.
3 探究型實驗題
該類題型對學生來說難度較大,主要原因是學生不能準確把握出題人的意圖,不知道從何下手.在平時解題時可以利用本文的解題策略,靜下心來,認真讀題,首先從實驗目的出發,提出合理的假設,確定可行的原理,然后再根據實驗原理設計方案,通過實驗現象,分析得出結論.這種題型通常也是建立在物質制備或物質性質基礎上的探究,起點雖高,但是落點較低,學生一旦正確領悟了出題人的意圖,探究起來就得心應手,正確解答也不再困難.
例3某興趣小組設計實驗探究SO2與新制Cu(OH)2懸濁液反應的產物.按圖5連接好裝置(夾持裝置省略),打開磁攪拌器,先往CuCl2溶液中加入NaOH 溶液至恰好完全反應,再通入過量的SO2,三頸燒瓶中生成大量白色沉淀X.
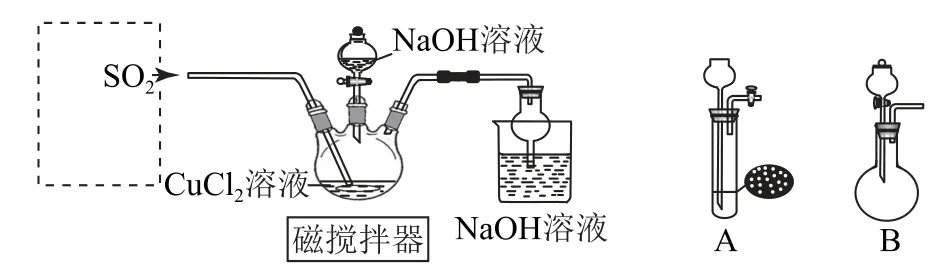
圖5
(1)制取SO2最適宜的試劑是_________.
A.Na2SO3固體與20%的硝酸
B.Na2SO3固體與20%的硫酸
C.Na2SO3固體與70%的硫酸
D.Na2SO3固體與18.4mol·L-1的硫酸
(2)根據選定的試劑,虛框中應選用_________(填“A”或“B”)裝置;通入SO2過程中不斷用磁攪拌器攪拌的目的是_________.
(3)甲同學推測X 可能為CuSO3.他取出少量洗滌后的X 加入足量稀硫酸進行實驗驗證,觀察到________,則甲同學推測錯誤.
(4)乙同學查閱資料:CuCl為白色固體,難溶于水,能溶于濃鹽酸形成;與氨水反應生成,在空氣中會立即被氧化成深藍色溶液,據此推測X可能為CuCl.該同學取出少量洗滌后的白色沉淀X,加入濃鹽酸,沉淀溶解,加水稀釋,又出現白色沉淀,據此得出乙同學推測正確.
①從平衡角度解釋加水稀釋重新產生白色沉淀的原因________.
②請再設計一種證明該白色沉淀為CuCl的方案:_________.
③三頸燒瓶中生成CuCl的離子方程式為____.

(1)該實驗是為了探究SO2和新制Cu(OH)2懸濁液反應的產物,虛框內應為SO2發生裝置,制備原理:用Na2SO3固體與70%的硫酸反應.因為70%的硫酸中存在少量的水,該濃度的硫酸可以電離出氫離子與亞硫酸鈉發生反應生成二氧化硫,若用濃硫酸,則不能電離出氫離子,而若硫酸濃度太小,SO2又可溶于水,使產率降低,因此70%的硫酸最佳.(2)由于亞硫酸鈉遇水溶解,發生裝置應選B,因為A裝置一般要求使用塊狀固體;攪拌的目的是:使反應物接觸更充分,加快反應速率.(3)甲同學推測X 可能為CuSO3,探究的原理為CuSO3+H2SO4=CuSO4+SO2↑+H2O.若未觀察到氣泡冒出,則甲同學推測錯誤.(4)由三頸燒瓶中加入的試劑CuCl2和查閱資料所得信息,學生不難推測出白色沉淀可能為CuCl,從平衡角度解釋加水稀釋重新產生白色沉淀是因為存在平衡:,加水使Cl-濃度減小,由于Q>K,平衡逆向移動,利用題給信息,可以用過量氨水設計實驗證明該白色沉淀為CuCl:向白色沉淀X中,加入過量的氨水,露置于空氣中迅速得到深藍色溶液.綜上所述,結合SO2有還原性,二價銅有氧化性,可以寫出三頸燒瓶中SO2與新制Cu(OH)2懸濁液(存在未反應完的CuCl2)反應生成CuCl的離子方程式為

變式某興趣小組為培養學生對科學探究的興趣,設計圖6所示實驗來探究與Cu2+的反應.
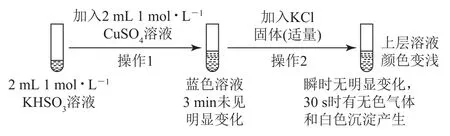
圖6
已知:氯化亞銅(CuCl)為白色立方結晶或白色粉末,難溶于水.回答下列問題:
(1)若用CuSO4·5H2O 配制100 mL 1 mol·L-1CuSO4溶液,需用托盤天平稱取CuSO4·5H2O 的質量為_________.甲同學在定容時采用圖7方式觀察,則所配制的CuSO4溶液濃度________(填“偏高”或“偏低”).

圖7
(2)將操作2生成的無色氣體通入氯化鐵溶液,_________(填實驗現象),說明該氣體為SO2,反應的離子方程式為_________.
(3)操作2生成的白色沉淀為_________(填化學式),生成該沉淀和無色氣體的反應離子方程式為________.
答案(1)25.0g;偏低.
(2)溶液由黃色變淺綠(或黃色變淺);SO2+.
高考中的實驗題,主要以實驗裝置圖為載體,以實驗設計及探究分析能力的考查為重點,以物質制備的探究型實驗題為命題趨勢,兼顧基本實驗操作、實驗方法、誤差分析、實驗計算等.因此不僅要求學生知識儲備要豐富,還對學生運用知識解釋現象、解決問題等能力提出了更高的要求,是對學生綜合能力的系統性考查,學生在運用自身知識體系的基礎上,根據解題策略,按先明確實驗目的,后分析實驗原理,最后再去解答問題的順序進行分析,可以做到目標明確,思路清晰,能又快又好地解答實驗題.
(完)

