解決高考實驗探究題的關鍵策略
李書霞
(清華大學附屬中學)
作為研究化學物質及其變化的重要手段,探究實驗能夠在實踐層面實現對學生創新能力和學科素養的發展,實驗探究題是高考中的重點和難點,最能體現能力立意的命題指導思想.
1 分析高考真題,梳理實驗探究的高頻考點

表1

圖1
通過分析近十年的高考真題,我們不難發現高頻考點聚焦在“探究物質性質和反應規律兩方面”.這些常考元素和物質(如硫和鐵的化合物)的價態和性質多變,能構建多種反應和轉化關系,以此作為載體創設情境,可以命制綜合性強、陌生度高、推理路徑長、思維容量大的實驗探究題.
2 預測和推測結合,探尋解決實驗探究題的關鍵策略
2.1 分析預測的角度——物質性質
物質性質主要是物理性質和化學性質兩個方面,物理性質包括“顏色、氣味、狀態、硬度、密度、熔點、沸點、溶解性”等;化學性質則涉及“穩定性、酸堿性、氧化性、還原性、配位性”等.在分析實驗探究題時,先關注題目中出現的關鍵物質,對其性質和可能發生的反應進行預測,從“價態和類別”兩個角度入手,先對單一物質進行分析預測,再對兩種或兩種以上物質混合時可能發生的反應再次進行分析預測.
【舉例】向某溶液體系中投入下列物質會引起的變化.
SO2:酸性、還原性、配位性.
Na2S:堿性、還原性、配位性、可能生成難溶的硫化物沉淀.
Na2SO3:弱堿性、還原性、配位性、可能生成難溶的亞硫酸鹽沉淀.
AgNO3:弱酸性、氧化性(Ag+或酸性條件下的)、配位性、可能生成難溶的銀鹽.
KI:中性、還原性、配位性.
K2C2O4:弱堿性、還原性(含+3價碳)、配位性、可能生成難溶的草酸鹽.
CuSO4或CuCl2:酸性、氧化性(可能生成0價或+1價銅)、配位性、可能生成難溶銅鹽.
FeCl3:酸性、氧化性、配位性、可能生成難溶的鐵鹽.
2.2 分析預測的角度——反應類型
1)預測反應
復雜的實驗探究題會出現多種物質混合,我們需要預測可能發生的變化和轉化關系.其實無論多復雜的體系,所能發生的反應無非以下三大類.
a)復分解反應:酸堿反應、生成沉淀的反應、生成弱電解質的反應等.
b)氧化還原反應:強氧化劑+強還原劑=弱氧化劑+弱還原劑.
c)配位反應:一般過渡金屬(或Al3+)作中心原子,Cl-、SCN-、CN-、H2O、NH3、CO、NO、等作為配體,多數配合物具有特征顏色.
2)預測反應之間的關系
面對具體物質和具體問題時,我們需要思考這些反應之間是什么關系,是競爭還是協同,速率快慢比較如何,反應程度大小怎樣,思考過程中可能遇到以下情況.
a)某些溶液混合后,沉淀反應速率快,而且溶解度很小,導致離子濃度迅速減小,無法再發生其他反應,例如亞硫酸鈉和硝酸銀溶液混合生成亞硫酸銀沉淀.
b)有些溶液混合后,發生配位反應的速率快,優先出現鮮明的配合物顏色,且配位反應平衡常數也較大,導致離子濃度很低,無法發生氧化還原反應,如草酸鉀和氯化鐵溶液混合生成翠綠色的草酸合鐵配合物.
c)有些溶液混合后也是配位反應速率快,優先出現鮮明的配合物顏色,但配位反應具有可逆性且平衡常數較小,氧化還原反應速率慢但平衡常數大,所以隨著時間的推移,氧化還原反應最終取勝.如將SO2通入FeCl3溶液中,先出現紅棕色的配合物,但放置較長時間后溶液顏色變為氧化還原反應后的淺綠色(Fe2+).
例1化學小組實驗探究SO2與AgNO3溶液的反應.
(1)實驗1用圖2所示裝置(夾持、加熱儀器略)制備SO2,將足量SO2通入AgNO3溶液中,迅速反應,得到無色溶液A 和白色沉淀B.

圖2
①濃H2SO4與Cu反應的化學方程式是____.
②試劑a是________.
(2)對體系中有關物質性質分析得出:沉淀B 可能為Ag2SO3、Ag2SO4或二者混合物.(資料:Ag2SO4微溶于水;Ag2SO3難溶于水.)
實驗2驗證B的成分,如圖3所示.

圖3
①寫出 Ag2SO3溶于氨水的離子方程式:________.
②加入鹽酸后沉淀D 大部分溶解,剩余少量沉淀F.推斷D 中主要是BaSO3,進而推斷B 中含有Ag2SO3.向濾液E 中加入一種試劑,可進一步證實B中含有Ag2SO3.所用試劑及現象是_________.
途徑1:實驗1中,SO2在AgNO3溶液中被氧化生成Ag2SO4,隨沉淀B進入D.
實驗3探究的產生途徑.
①向溶液A 中滴入過量鹽酸,產生白色沉淀,證明溶液中含有_________:取上層清液繼續滴加BaCl2溶液,未出現白色沉淀,可判斷B 中不含Ag2SO4.做出該判斷的理由:_______.
②實驗3的結論_________.
(4)實驗1中SO2與AgNO3溶液反應的離子方程式是_________.
(5)根據物質性質分析,SO2與AgNO3溶液應該可以發生氧化還原反應.將實驗1所得混合物放置一段時間,有Ag和生成.
(6)根據上述實驗所得結論為_________.

(1)首先依據上述思維模型進行主動預測,如圖4所示.
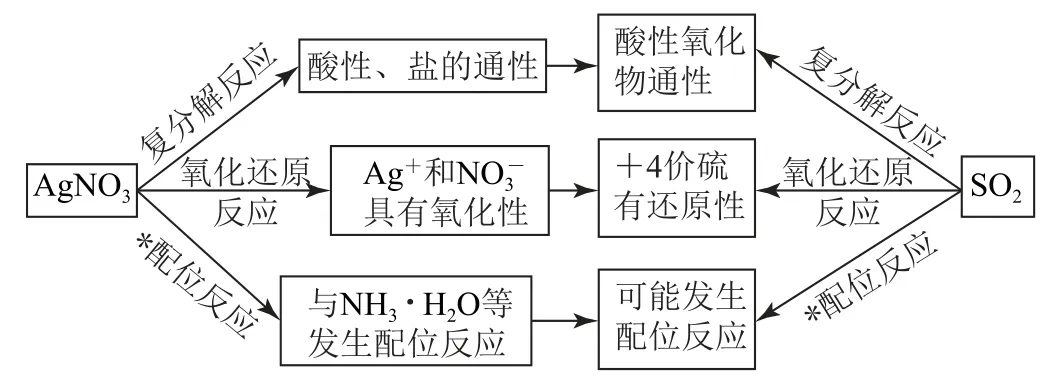
圖4
(2)結合題目所給的實驗現象進行合理推測.
對SO2通入AgNO3溶液中得到的白色沉淀B進行合理推測.
推測1:復分解反應——白色沉淀為Ag2SO3.
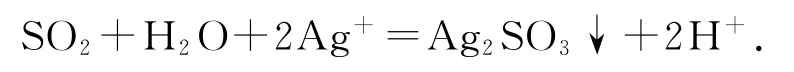
推測2:氧化還原反應——白色沉淀為Ag2SO4.
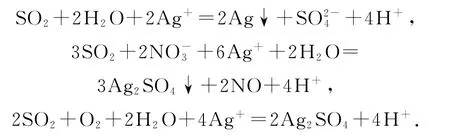
推測3:上述反應同時發生——白色沉淀為Ag2SO3和Ag2SO4.
(3)進一步結合題目所做的其他實驗進行深入分析和探究.
在此題目中我們看到,SO2與AgNO3溶液生成Ag2SO3的速率大于生成Ag和的速率,所以我們預測的配位反應和氧化還原反應沒有發生,只發生了沉淀反應;為什么在實驗1中+4價硫沒有被氧化,卻在實驗2中被氧化了呢? 推測可能是實驗2的堿性環境帶來的影響.
答案(1)①SO2↑+2H2O;②飽和NaHSO3溶液.
(3)①Ag+;Ag2SO4溶解度大于BaSO4,沒有BaSO4沉淀時,必定沒有Ag2SO4;②途徑1不產生,途徑2產生.
(4)2Ag++SO2+H2O=Ag2SO3↓+2H+.
(6)該實驗條件下,SO2與AgNO3溶液生成Ag2SO3的速率大于生成Ag和的速率,堿性溶液中更易被氧化為.
3 關注影響因素,突破反應原理探究的難點
3.1 影響反應原理的因素
在探究反應原理時,會遇到“反應方向、速率和限度”的問題,影響因素就顯得尤為重要.總結如表2所示.

表2
知道這些影響因素之后,還要具體分析這些因素之間的關系,比如溫度高可以加快反應速率,但可能不利于提升轉化率,那么就要兼顧二者的需求,選擇合適的溫度范圍;但是如果某反應使用了催化劑,在選擇溫度的時候,首要考慮的則是催化劑適宜的催化溫度;很多反應都存在副反應,主副反應之間通常是競爭關系,調控反應條件時要考慮對主副反應的影響是相反還是一致的.
3.2 改變條件可能產生的影響
1)溫度:速率、平衡、氣體溶解度、物質穩定性、催化劑活性、副反應.
2)pH:微粒存在形式、水解或電離平衡、氧化還原性強弱、競爭放電.3)濃度:速率、平衡、放電順序、氧化還原性強弱.4)藥品的滴加順序:酸堿性、微粒濃度相對大小、反應的先后.
3.3 氧化還原反應規律探究的注意事項
1)影響氧化性、還原性強弱的“三度”:溫度、濃度、酸堿度等.如酸性高錳酸鉀的氧化性比中性時強,濃硝酸比稀硝酸氧化性強等.
2)S2-、I-、Fe2+,題目中出現這些強還原性離子時,要意識到它們可能要被O2或其他物質氧化,通常要考慮空氣中O2對實驗造成的干擾.
3)若某氧化還原反應本該發生,卻因為其他反應的干擾未能觀察到預期現象,則排除干擾的實驗方案是:設計雙液原電池,將氧化劑和還原劑隔開,避免發生復分解或配位反應,導致離子濃度降低,無法進行氧化還原反應.
4)不主動干預時,化學反應速率通常會隨反應進行而逐漸減小,但有時也會出現先增大后減小的情況,可能有兩個原因:反應放熱導致體系溫度升高、生成了可以催化該反應的產物.
例2 實驗1向1mL0.1mol·L-1FeSO4溶液中加入1mL0.1mol·L-1AgNO3溶液,開始時,溶液無明顯變化,幾分鐘后,出現大量灰黑色渾濁,反應過程中溫度幾乎無變化,測定溶液中Ag+濃度隨反應時間的變化如圖5所示.

圖5
實驗2實驗開始時先向試管中加入幾滴Fe2(SO4)3溶液,重復實驗1,實驗結果與實驗1相同.

Ag+濃度隨反應時間的變化出現短時間內的斷崖式下降,且溶液溫度無變化,只能說明是自催化現象,實驗2 排除了產物之一Fe3+的影響,可得出的結論是:另一產物即灰黑色的銀單質催化了該反應.
例3文獻表明:相同條件下,草酸根的還原性強于Fe2+.為檢驗這一結論,完成如下實驗.資料:
ⅰ.草酸(H2C2O4)為二元弱酸.
ⅱ.三水三草酸合鐵(Ⅲ)酸鉀[K3Fe(C2O4)3·3H2O]為翠綠色晶體,光照易分解.其水溶液中存在:.
ⅲ.FeC2O4·2H2O 為黃色固體,微溶于水,可溶于強酸.
實驗1通過Fe3+和在溶液中的反應比較Fe2+和的還原性強弱,如表3所示.

表3
(2)取實驗1 中少量晶體洗凈,配成溶液,滴加KSCN 溶液,不變紅.繼續加入硫酸,溶液變紅,說明晶體中含有+3價的鐵元素.加硫酸后溶液變紅的原因是_________.
(3)經檢驗,翠綠色晶體為K3Fe(C2O4)3·3H2O.設計實驗,確認實驗1中沒有發生氧化還原反應的操作和現象是________.實驗1中未發生氧化還原反應的原因是_________.
(4)取實驗1中的翠綠色溶液光照一段時間,產生黃色渾濁且有氣泡產生.補全反應的離子方程式:
實驗2通過比較H2O2與反應的難易,判斷二者還原性的強弱,如表4所示.

表4
(5)證明Fe2+被氧化的實驗現象是________.
實驗3通過其他實驗方案比較Fe2+和的還原性強弱.
(7)用FeCl3溶液、K2C2O4溶液和其他試劑,設計實驗方案比較Fe2+和的還原性強弱.畫出裝置圖并描述預期現象________.

既然將FeCl3溶液、K2C2O4溶液直接混合后,二者優先發生配位反應,那么能否通過其他實驗方案比較Fe2+和的還原性強弱呢? 雙液原電池便是最好的選擇了,可以將氧化劑和還原劑隔離在兩個區域,避免直接混合發生其他反應干擾對氧化還原反應的判斷.但是設計雙液原電池之后對現象的描述不能僅限于“電流計指針偏轉”,因為兩極產生電勢差是很容易的,比如吸氧腐蝕.所以還要檢驗氧化還原反應的產物,最好是還原反應的產物,因為溶解氧是可能干擾實驗的,而還原產物則不受其干擾.所以此題中,在雙液原電池工作一段時間后,取燒杯中的溶液,滴加K3Fe(CN)6溶液檢測還原產物即Fe2+.
答案(1)+3.
(3)取少量實驗1 中的翠綠色溶液,滴加K3Fe(CN)6溶液,不出現藍色沉淀;Fe3+與生成穩定的[Fe(C2O4)3]3-,濃度降低,Fe3+的氧化性和的還原性減弱.
(5)Ⅱ中產生大量紅褐色沉淀或Ⅲ中得到翠綠色溶液.
(7)

圖6
電流計的指針偏轉,電池工作一段時間后,取少量左側燒杯中的溶液,滴加K3Fe(CN)6溶液,出現藍色沉淀.
(完)

