基于網絡藥理學和分子對接分析人參固本口服液的物質基礎和機制研究
李冰冰 王嵬 支運霞 李發余 王士雨 程國良 臧恒昌
人參固本口服液,由人參、地黃、熟地黃、山茱萸、山藥、牡丹皮、澤瀉、茯苓、天冬、麥冬等十味中藥組成,藥性溫和,具有滋陰益氣、固本培元的功效。藥理學研究未發現其毒性,具有抗疲勞、耐缺氧提高機體免疫力、清除自由基和抗脂質過氧化等作用[1,2],臨床可用于肺腎陰虛氣弱咳嗽、腎病綜合征、中醫辨證氣陰虛的慢性支氣管炎、慢性腎炎、白細胞減少癥和輔助治療證屬氣陰虛的肺結核等[1,3,4]。此方由六味地黃丸加味而成,方中六味地黃丸滋補肝腎、養陰清熱,天冬、麥冬生津增液、潤肺止咳,人參大補元氣,諸藥配合,滋陰補氣。同時,除茯苓外的9種中藥均是可用于保健食品的中藥,人參、山茱萸、茯苓、山藥又為“藥食同源”類中藥。《黃帝內經》中就有了食療對疾病的去除和預防作用[5]。因此人參固本口服液對陰虛氣虛患者均具有補益作用,普通人服用后也具有一定的提高機體免疫功能的作用。網絡藥理學作為藥物研究的新模式,對中藥/復方物質基礎、作用機制研究的發展起到了重要的作用[6]。本文通過網絡藥理學篩選出人參固本口服液活性成分、作用靶點,并進行聚類分析,通過靶點、通路的分析,預測其藥理作用及作用機制,為人參固本口服液臨床應用提供理論參考。
1 資料與方法
1.1 一般資料 從《中國藥典》(2015年版)查詢人參固本口服液中10味中藥的歸經,借助中藥系統藥理分析平臺(TCMSP,http://tcmspw.com/tcmsp.php)[7],檢索各中藥的化學成分;以BATMAN-TCM數據庫[8]和已發表文獻作為補充。結合口服生物利用度(OB≥30%)和類藥性(DL≥0.18),收集化學成分及相應靶點,根據Unitprot數據庫[9](http://www.Unitprot.org/)更正所有靶點的名稱,最終建立人參固本口服液的成分庫和靶點庫。
1.2 成分-靶點網絡、蛋白互作網絡的構建 利用Cytoscape軟件構建人參固本口服液的中藥-成分-靶點網絡[10]。將人參固本口服液的靶點信息導入String數據庫,設定物種為“Homo snpiens”,獲取全部蛋白-蛋白相互作用(PPI)網絡。
1.3 Hub網絡的提取 通過Cytoscape軟件中的Tools模塊,NetworkAnalyzer-Network Analysis-Analyze Network進行網絡分析獲取相關拓撲參數,首先選取節點Degree值的2倍中位數為篩選標準,其次以Betweenness centrality值、Closeness centrality值和neighborhood connectivity值的中位數作為篩選依據,提取出相應的Hub網絡。
1.4 生物通路富集分析 為了進一步了解上述篩選出的靶標基因的功能,將這些靶點導入Metascape數據庫[11](https://david.ncifcrf.gov/),進行GO(gene ontology)生物學過程(Biological Process,BP)、細胞組成(Cellular Component,CC)、分子功能(Molecular Function,MF)富集分析和KEGG(Kyoto Encyclopedia of Genes and Genomes)信號通路富集分析,并利用R 4.0.2軟件將其結果可視化。
1.5 分子對接 從TCMSP或ZINC數據庫[12](http://zinc.docking.org/)獲得Degree值前10成分的mol2格式文件,用Autodock Tool軟件處理后得到pdbqt格式文件。從PDB數據庫[13](https://www.rcsb.org/)下載關鍵靶蛋白的3D結構,運用Pymol軟件處理后得到pdbqt格式文件。用Autodock vina將成分和蛋白對接[14]。結合能≤-5.0 kJ/mol作為篩選標準,結合能數值越小,對接結果較好[15]。
2 結果
2.1 人參固本口服液活性成分 檢索人參固本口服液各中藥的化學成分,并以OB≥30%、DL≥0.18為篩選條件,最終得到61個成分。見表1。
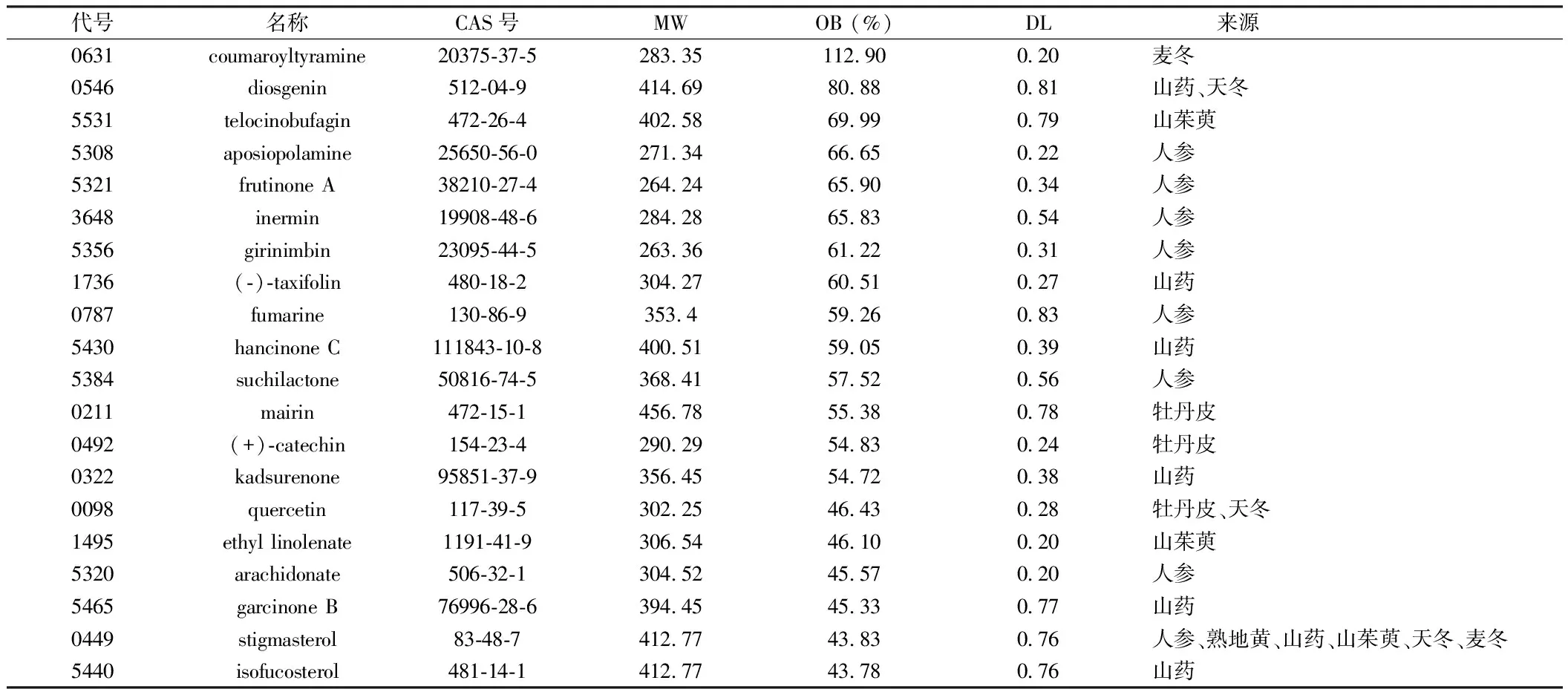
表1 人參固本口服液活性成分基本信息(OB前20位)
2.2 中藥-成分-靶點相互作用網絡 人參固本口服液中藥-成分-靶點網絡共包括294個節點(10個中藥節點、61個成分節點、223個靶點節點)和761條邊,“△”代表中藥,“〇”代表成分,“◇”代表靶點,每條邊則表示中藥成分及成分與靶點相互作用關系(見圖2)。按照Degree值,排名前10位的成分分別是quercetin(槲皮素)、kaempferol(山奈酚)、7-Methoxy-2-methyl isoflavone(7-甲氧基-2-甲基異黃酮)、β-sitosterol(β-谷甾醇)、stigmasterol(豆甾醇)、fumarine(原阿片堿)、tetrahydroalstonine(四氫雞骨常山堿)、kadsurenone(海風藤酮)、hederagenin(常春藤素)、hancinone C(山蒟酮C)。見圖1。

圖1 人參固本口服液中藥-成分-靶點網絡
2.3 中藥-歸經網絡 根據人參固本口服液各味藥的歸經信息,構建該方的中藥-歸經網絡。圖中黃色“□”節點代表中藥,綠色“○”節點表示歸經,綠色節點越大、顏色越深表明所屬歸經的中藥數目越多。網絡中五臟(腎、肺、心、肝、脾)的Degree值分別為9、5、5、4、3,其中,處方中僅麥冬歸經不包含腎經。歸經分析可見,人參固本口服液組方藥性溫和,對機體的整體調節大有裨益。見圖2。

圖2 人參固本口服液中藥-歸經網絡
2.4 PPI及Hub網絡構建 將223個人參固本口服液的作用靶點導入String數據庫,用Cytoscape軟件可視化,形成219個節點、3 937條邊的靶點的PPI網絡;根據網絡的拓撲學性質篩選Degree值、Betweenness centrality值、Closeness centrality值較大的節點進行分析,得到含有48個核心靶點的Hub網絡。按照Degree值從高到低,Hub網絡中共有11個靶點與其他47個靶點均有相互作用(即Degree值=47),這些靶點分別為:AKT1、CASP3、CXCL8、EGF、IL6、MAPK1、MMP9、PTGS2、TNF、TP53、VEGFA。見圖3。
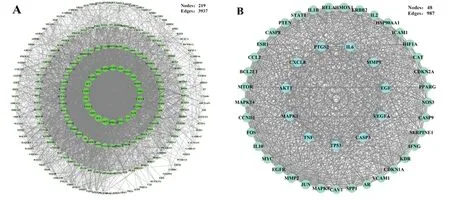
圖3 人參固本口服液的PPI網絡(A)及Hub網絡(B)
2.5 GO功能分析和KEGG通路分析 通過Metascape數據庫進行的GO功能富集分析得到GO條目1411個(P<0.01),其中BP條目1 347個,CC條目13個,MF條目51個,各類別分析中排名前20位的條目(CC 13個)。其中,BP主要涉及免疫調節、代謝過程、細胞功能調節、信號、應激反應等生物過程,CC主要包括膜區域、膜筏、膜微結構域等,MF主要包括轉錄因子結合、酶結合、細胞因子受體結合等。KEGG通路富集分析篩選得到126條(P<0.01)信號通路,與癌癥相關的疾病通路有25條,免疫相關的疾病通路有12條,心血管及血液系統相關的疾病通路有14條,與寄生蟲、真菌、病毒感染引起的疾病通路有18條,血糖調節的通路有9條,信號通路共38條。選Count值較大的前20條通路進行可視化。見圖4、5。


圖4 人參固本口服液作用靶點GO分析

圖5 人參固本口服液核心靶點KEGG富集分析的前20條通路氣泡圖
2.6 分子對接結果分析 將人參固本口服液中排序前10的核心成分分別與Hub網絡中的11個靶點進行分子對接。一般認為配體與受體結合的構象穩定時能量越低,發生的作用可能性越大,結合能≤-5.0 kJ/mol作為篩選標準,結合能≤-20.93 kJ/mol時則視為成分與靶點有較好的活性,結合能≤-29.34 kJ/mol時則結合活性強烈[15]。分子對接結果,圖中“〇”越大、顏色越深,表示成分與靶點的結合活性越強。所有對接結果均≤-20.93 kJ/mol,約60%的對接結果≤-29.34 kJ/mol。對接效果最好的靶點包括:AKT1、PTGS2、CXCL8、TNF、CASP3,對接效果最好的成分包括:fumarine、tetrahydroalstonine、β-sitosterol、stigmasterol、kaempferol。對其中的4個不同類型成分進行分析:β-sitosterol(甾體)、fumarine(生物堿)、7-Methoxy-2-methyl isoflavone(黃酮)、hancinone C(木脂素)與AKT1(PDB ID:6S9W)的對接位置與原有配體類似,均落入蛋白殘基形成的活性口袋中,結合能分別為-46.47、-43.54、-41.45和-36.01 kJ/mol。β-sitosterol羥基進入AKT1口袋內側,與氨基酸殘基(Ser205和Thr211)形成氫鍵,fumarine與AKT1的氨基酸殘基(Asn54和Asp274)形成氫鍵,與ARG273形成π-cation作用,7-Methoxy-2-methyl isoflavone與AKT1的氨基酸殘基(Trp80)形成π-π堆積,hancinone C與AKT1的氨基酸殘基(Asn53和Arg200)形成氫鍵。見圖6、7。
3 討論
人參固本口服液組方是由六味地黃丸、二黃丸化裁而成。六味地黃丸,腎肝脾三陰并補,以補腎陰為主。現代藥理學研究表明,六味地黃丸具有調節免疫、抗腫瘤、降血糖血脂等作用[16]。天冬補脾生水,地黃補腎養陰,人參補脾益氣,三藥并稱“三才”,是調治補益常用的基礎方[17]。二黃丸,出自《壽親養老新書》[18],由“三才”加熟地黃、麥冬組成,益氣養陰,使氣血旺盛,多用于治療心肺腎氣陰兩虛,具有延緩衰老的作用[19]。人參固本口服液,藥性溫和,氣陰同補,對機體的整體調節大有裨益。
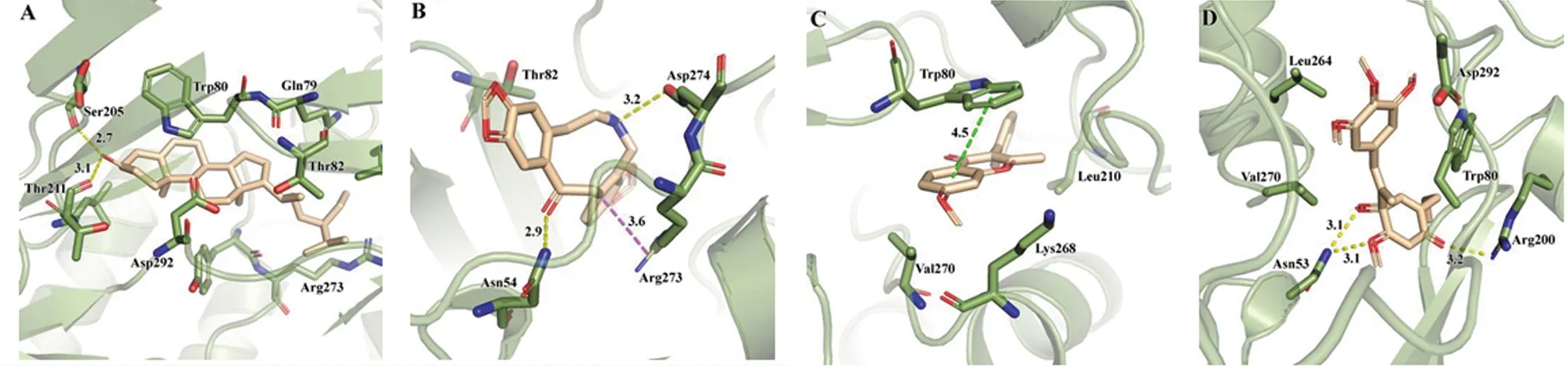
圖6 活性成分與AKT1相互作用分析(A:β-sitosterol,B:fumarine,C:7-Methoxy-2-methyl isoflavone,D:hancinone C)
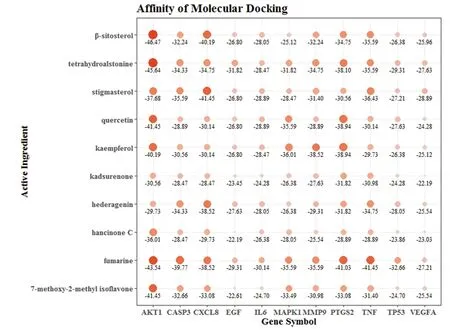
圖7 分子對接結果氣泡圖
本研究運用網絡藥理學方法,從人參固本口服液中得到61個有效成分,包括烯烴類、生物堿類、黃酮類、萜類、甾體類、木脂素類、糖苷類等,Degree值最高的5個成分為槲皮素、山奈酚、7-甲氧基-2-甲基異黃酮、β-谷甾醇、豆甾醇。組方歸經分析發現,人參固本口服液包含“五臟”歸經,以腎經為主,體現了補虛的遣方用藥特點[20]。從所有靶點的PPI網絡中得到48個核心靶點的Hub網絡,Hub網絡中有11個靶點的Degree值為47,這些靶點分別為:AKT1、CASP3、CXCL8、EGF、IL6、MAPK1、MMP9、PTGS2、TNF、TP53、VEGFA。對48核心靶點進行KEGG信號通路富集分析結果可知,涉及與癌癥相關的疾病通路有25條,免疫相關的疾病通路有12條,心血管及血液系統相關的疾病通路有14條,與寄生蟲、真菌、病毒感染引起的疾病通路有18條,調節血糖的通路9條,信號通路共38條。癌癥相關的疾病通路包括:胰腺癌、前列腺癌、乳腺癌、膀胱癌、子宮內膜癌、結腸直腸癌、膠質瘤、非小細胞肺癌、黑素瘤、慢性骨髓白血病、小細胞肺癌、甲狀腺癌、腎臟上皮腎細胞癌等。
AKT1是癌癥中最頻繁激活的增殖和存活途徑的核心成員[21],AKT1抑制劑能誘導肝癌細胞自噬死亡[22],活化的AKT1可以抑制細胞凋亡,促進細胞周期運行及細胞侵襲和轉移[23]。PTGS2是前列腺素生物合成的一個重要限速酶,正常組織中幾乎不表達,在多種惡心腫瘤中高度表達[24]。CASP3是細胞凋亡的主要執行者,通過特異性地裂解一系列底物而導致細胞凋亡。IL-6和TNF參與了慢性病貧血/缺鐵性貧血的發生發展[25]。TP53在癌癥治療方面有廣泛的研究[26,27],參與了多種細胞死亡通路,且可作為信號中心評估神經元損傷情況[28]。利用分子對接技術對主要活性成分和核心靶點的相互作用進行模擬,發現人參固本口服液的主要活性成分與關鍵靶點均具有強烈的結合能力,所有對接結合能均≤-20.93 kJ/mol,約60%的對接≤-29.34 kJ/mol。氫鍵、疏水作用、π-cation作用和π-π堆積可能是主要的結合形式。
人參固本口服液源于中醫經典方,肺腎同補,氣陰同調,既能治已病,還可治未病。“扶正固本”是中醫藥治療腫瘤的重要指導思想。人參固本口服液不僅能減輕癌癥患者化療過程中白細胞減少癥[1],還能調節機體免疫力,起到固本培元的作用。通過網絡藥理學預測和分子對接技術,從分子水平闡述了人參固本口服液通過多成分、多靶點、多通路發揮功效的整體調節,為人參固本口服液的臨床用藥和再開發提供重要理論依據。

