毛柳苷在缺血性腦損傷中對白介素4誘導蛋白1表達和小膠質細胞激活及表型的影響
劉文倩,趙順英,葉維貞,姜鳴鈺,陳文濤,陳青芳,溫少紅,董雯,劉向榮
我國面臨著嚴重的卒中負擔,卒中在所有死亡原因中位列第三,其中缺血性卒中占所有卒中的64.9%[1]。及時有效的治療能減少缺血性卒中的復發、致殘及死亡不良結局[2-3]。毛柳苷也稱紅景天苷,是我國傳統中藥紅景天的提取物,也是其主要的藥效成分。紅景天具有益氣活血的功效,可用于卒中后偏癱的治療。近年來的研究及本課題組的前期研究均發現,毛柳苷在缺血性腦損傷后可能通過抑制氧化應激、反應性膠質增生、調控小膠質細胞極化等機制發揮神經保護作用[4-5],但其作用詳細的分子機制尚不十分清楚。
白介素4誘導蛋白1(interleukin-4 induced protein 1,IL4I1)是在IL-4的誘導下產生的一種氨基酸氧化酶,可將苯丙氨酸氧化為苯丙酮酸,該反應同時釋放氨和過氧化氫[6]。IL4I1作為免疫調節蛋白參與機體免疫應答的過程[7]。針對多發性硬化的研究發現,IL4I1可調節小膠質細胞極化并促進神經髓鞘再生[8]。由此推測毛柳苷可能通過影響IL4I1的表達,進而調節腦缺血再灌注后小膠質細胞的激活和炎癥表型變化,從而發揮神經保護作用。
1 對象與方法
1.1 實驗對象及藥物 ①實驗動物:選取8~12周C57BL/6J雄性小鼠38只,體質量20.0±0.5 g(北京華阜康生物科技控股有限公司)。本實驗遵照動物倫理相關要求進行,實驗小鼠飼養于22~26 ℃,相對濕度50%~60%,12 h循環照明的環境中,自由攝食水。②小膠質細胞:BV2小鼠小膠質細胞(中國醫學科學院基礎醫學研究所細胞資源中心)復蘇后,培養于含10%胎牛血清(HyClone,美國)的基礎培養基(HyClone,美國)中。③實驗藥物:毛柳苷粉末(Sigma,美國)按1 mg/mL溶解于生理鹽水后備用。
1.2 模型制作與藥物注射 小鼠隨機分為3組:假手術組4只、腦缺血再灌注后注射毛柳苷組(簡稱毛柳苷組)17只、腦缺血再灌注后注射生理鹽水組(簡稱生理鹽水組)17只。
模型制作:小鼠經異氟烷麻醉,仰臥位,分離頸總動脈起始段,通過頸內動脈插入線栓至大腦中動脈,60 min后拔栓以恢復血流實現再灌注,逐層縫合皮膚。手術期間使用保溫墊,監測小鼠肛溫,保持在37.0±0.5 ℃。激光散斑儀(瑞沃德,中國)檢測缺血前基線、缺血后60 min的腦血流,缺血后60 min腦血流低于基線水平的30%為模型成功。腦缺血再灌注后10 min,毛柳苷組與生理鹽水組小鼠分別經尾靜脈按照10 mg/kg注射毛柳苷與生理鹽水,每天1次,持續28 d。
1.3 血清IL4I1濃度檢測
1.3.1 血清制備 采集假手術組及缺血再灌注(毛柳苷組和生理鹽水組)后48 h、7 d、28 d血清,其中假手術組4只,缺血再灌注28 d時每組各5只,其余時間點每組各4只。使用10%水合氯醛麻醉小鼠,通過摘眼球法獲取全血,靜置2 h后,在常溫下以4000 r/min離心15 min,取上清液即為血清。
1.3.2 ELISA法檢測血清IL4I1濃度 使用ELISA試劑盒(MyBioSource,美國)檢測小鼠血清中IL4I1的濃度。設置2個復孔,每孔加入40 μL血清、10 μL IL4I1抗體與50 μL辣根過氧化物酶標記生物素,37 ℃下避光反應60 min,清洗96孔板5次,先后加入底物溶液A與B各50 μL,37 ℃下避光反應10 min,加入50 μL終止液,10 min內在450 nm檢測光密度值,繪制標準曲線,計算各樣本的IL4I1濃度。
1.4 腦梗死體積測定 取毛柳苷組與生理鹽水組小鼠各4只,缺血再灌注后7 d取腦并進行冰凍切片6層,使用神經元特異核蛋白抗體(neuronal nuclei,NeuN)抗體,(Millipore,美國)進行免疫熒光染色標記6個層面的神經元,以確定梗死體積。通過Vectra Polaris全自動成像系統(Perkin-Elmer,美國)拍攝熒光圖片。使用Image J軟件統計不同層面的腦梗死體積,梗死體積=各層健側腦組織體積之和-各層損傷側正常腦組織體積之和。
1.5 小膠質細胞三維形態及突起長度和數量分析 取生理鹽水組與毛柳苷組小鼠各4只,缺血再灌注后7 d腦組織冰凍切片,進行離子化鈣結合適配分子1(ionized calcium binding adapter molecule 1,Iba1)熒光染色標記損傷區周圍小膠質細胞。使用LSM710激光共聚焦顯微鏡Z-stack拍攝小膠質細胞3D圖像,并通過Imaris 9.0.1軟件Filament插件計算小膠質細胞的突起長度、突起數量、突起的分叉點數量及突起的終末端點數量。
1.6 免疫組織熒光染色 取毛柳苷組與生理鹽水組缺血再灌注后7 d的腦組織冰凍切片,每組各4只小鼠,進行Iba1(和光純藥,日本)和CD16/32(BD Pharmingen,美國)及Iba1和CD206(R&D Systems,美國)免疫熒光共染,分別標記損傷區M1和M2型小膠質細胞。使用LSM710激光共聚焦顯微鏡(Carl Zeiss AG,德國)拍攝Iba1分別與CD16及CD206共定位圖像,Image J軟件統計M1、M2型小膠質細胞的數量。
1.7 BV2小膠質細胞不同表型IL4I1表達測定
1.7.1 BV2小膠質細胞培養與表型誘導 設置空白對照組為M0型小膠質細胞,使用脂多糖(lipopolysaccharide,LPS)(10 μg/mL,Sigma,美國)和INF-γ(10 μg/mL,Peprotech,美國)誘導BV2小膠質細胞極化為M1型小膠質細胞;使用IL-4(10 μg/mL)(Peprotech,美國)和IL-13(10 μg/mL)(Peprotech,美國)誘導BV2小膠質細胞極化為M2型小膠質細胞。
1.7.2 BV2小膠質細胞蛋白提取 收集M0型及誘導48 h后的M1型和M2型細胞,每107細胞使用500 μL放射免疫沉淀法緩沖液(radio immunoprecipitation assay buffer,RIPA)蛋白裂解液(索萊寶,中國)提取小膠質細胞蛋白,4 ℃,12 000 r/min離心20 min,取上清即為細胞蛋白裂解液。
1.7.3 蛋白印跡測定BV2小膠質細胞IL4I1表達使用10%的十二烷基磺酸鈉-聚丙烯酰胺凝膠(sodium dodecyl sulfonate-polyacrylamide gel electrophoresis,SDS-PAGE)進行電泳(每孔40 μg蛋白),后轉移到聚偏二氟乙烯膜(polyvinylidene,PVDF)。使用含0.1%吐溫20和5%胎牛血清白蛋白的Tris緩沖液室溫封閉膜60 min,兔來源抗鼠IL4I1抗體(博奧森,中國)、鼠來源抗鼠β-Actin抗體(景杰生物科技有限公司,中國)4 ℃孵育過夜,辣根過氧化物酶耦聯抗兔、抗鼠二抗(CST,美國)室溫孵育1 h,使用化學發光試劑盒(Abcam,英國)通過G:BOX化學發光成像系統(Syngene,英國)檢測蛋白條帶,并使用Image J分析圖像計算IL4I1相對表達量。
1.8 統計方法 使用GraphPad Prism 8.0.2軟件進行統計分析,計量資料符合正態分布,用表示,單時間點兩組比較采用獨立t檢驗;單時間點多組比較采用單因素方差分析,在整體差異有統計學意義的情況下進行Tukey檢驗兩兩比較;多時間點多組比較采用雙因素方差分析,在整體差異有統計學意義的情況下進行Bonferroni法兩兩比較。以P<0.05為差異具有統計學意義。
2 結果
2.1 腦缺血再灌注后血清IL4I1的表達 生理鹽水組腦缺血再灌注后48 h、7 d、28 d與假手術組相比血清中IL4I1濃度整體差異具有統計學意義(P=0.0235)。兩兩比較發現,與假手術組相比,生理鹽水組腦缺血再灌注后48 h血清中IL4I1濃度降低(P=0.0302);生理鹽水組腦缺血再灌注后7 d和28 d較48 h血清中IL4I1濃度有升高趨勢,但差異不具有統計學意義(P=0.8160,P=0.2874)。毛柳苷組與生理鹽水組腦缺血再灌注后48 h、7 d、28 d血清中IL4I1濃度整體差異有統計學意義(P<0.0001),兩兩比較發現兩組腦缺血再灌注后48 h血清中IL4I1濃度無差異(P=0.1581),毛柳苷組腦缺血再灌注后7 d和28 d血清中IL4I1濃度較生理鹽水組升高(P=0.0229,P=0.0076)。上述結果提示毛柳苷能促進小鼠缺血性腦損傷后早期及恢復期血清中IL4I1的表達(表1)。

表1 缺血再灌注后不同時間點不同組小鼠血清IL4I1濃度比較[單位:ng/L]
2.2 腦缺血再灌注后7 d腦梗死體積 NueN免疫熒光染色結果顯示,腦缺血再灌注后7 d毛柳苷組小鼠腦梗死體積顯著低于生理鹽水組腦梗死體積(16.47±5.44 mm3vs.30.20±8.90 mm3,P=0.0389),表明毛柳苷可降低小鼠缺血再灌注后的腦梗死體積(圖1)。
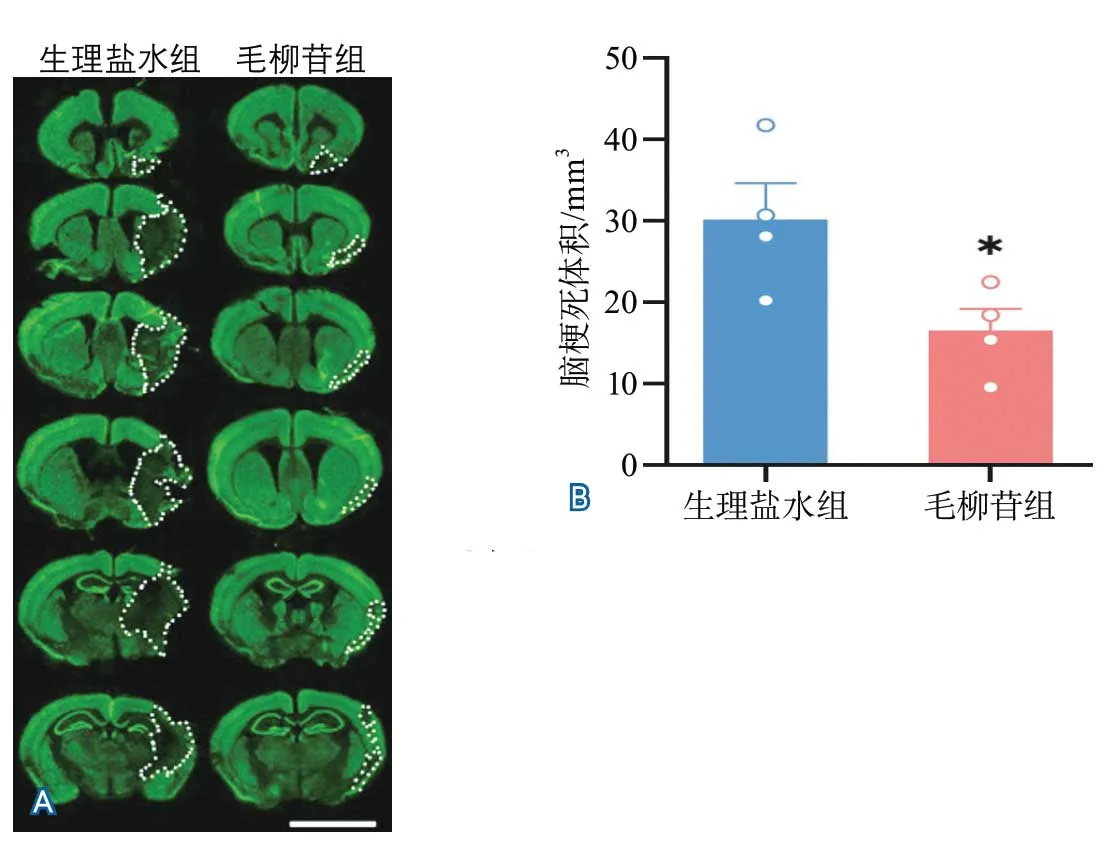
圖1 生理鹽水組和毛柳苷組小鼠缺血再灌注后7 d腦梗死體積比較
2.3 腦缺血再灌注后7 d小膠質細胞三維形態及突起變化 圖2顯示了腦缺血再灌注后7 d小鼠腦損傷區周圍小膠質細胞的三維形態。與生理鹽水組相比,毛柳苷組小膠質細胞的突起長度更長(110.60±24.93 μmvs. 95.64±27.65 μm,P=0.0040),單個小膠質細胞突起數量更多(104.60±60.21個vs. 50.58±33.47個,P<0.001),單個小膠質細胞突起的分叉點數量(53.43±33.99個vs. 24.83±16.41個,P<0.001)和終末端點數量(56.03±35.20個vs. 26.85±17.12個,P<0.001)均增多。結果提示毛柳苷可促進小鼠缺血性腦損傷后小膠質細胞的進一步活化,促進突起伸長,增加突起分支(圖3)。
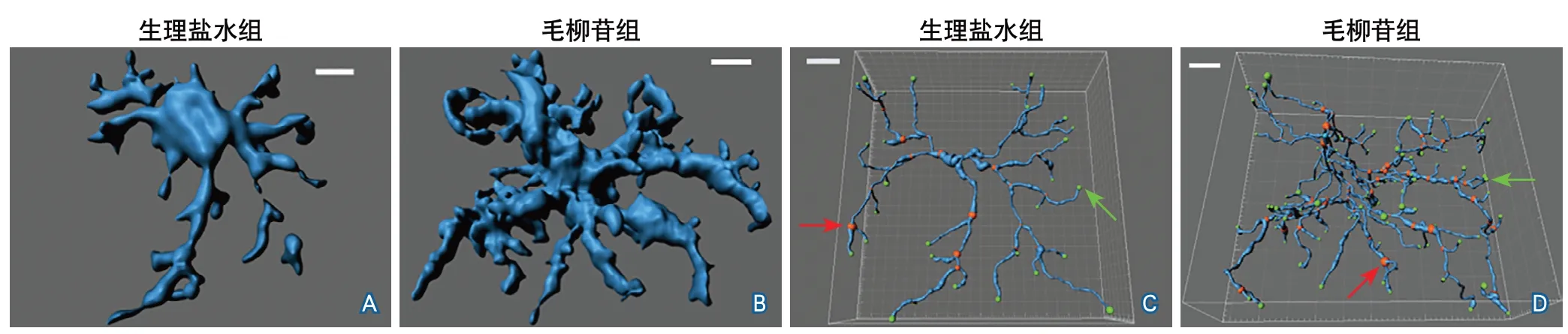
圖2 生理鹽水組和毛柳苷組缺血再灌注后7 d腦組織小膠質細胞三維形態
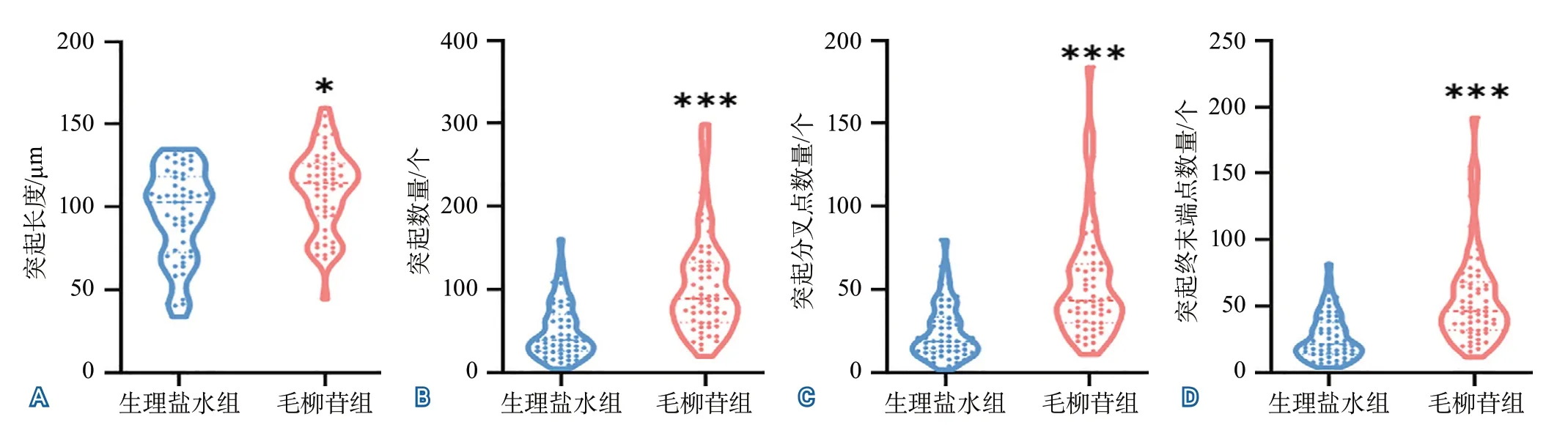
圖3 生理鹽水組和毛柳苷組缺血再灌注后7 d腦組織小膠質細胞突起長度與數量變化

2.4 腦缺血再灌注后小膠質細胞極化狀態 Iba1+CD16/32+標記損傷區域周圍M1型小膠質細胞,Iba1+CD206+標記M2型小膠質細胞。統計皮層與紋狀體區域小膠質細胞總數量、M1型與M2型小膠質細胞數量,結果顯示毛柳苷組與生理鹽水組腦缺血再灌注后7 d皮層及紋狀體區域小膠質細胞總數差異無統計學意義。與生理鹽水組相比,毛柳苷組腦缺血再灌注后7 d梗死區域周圍皮層及紋狀體的M1型小膠質細胞數量減少(皮層:P=0.0407,紋狀體:P=0.0032),M2型小膠質細胞數量顯著增多(皮層:P=0.0206,紋狀體:P=0.0075)(表2)。上述結果提示毛柳苷可促進小鼠缺血性腦損傷后小膠質細胞向M2型抗炎表型小膠質細胞極化(圖4)。
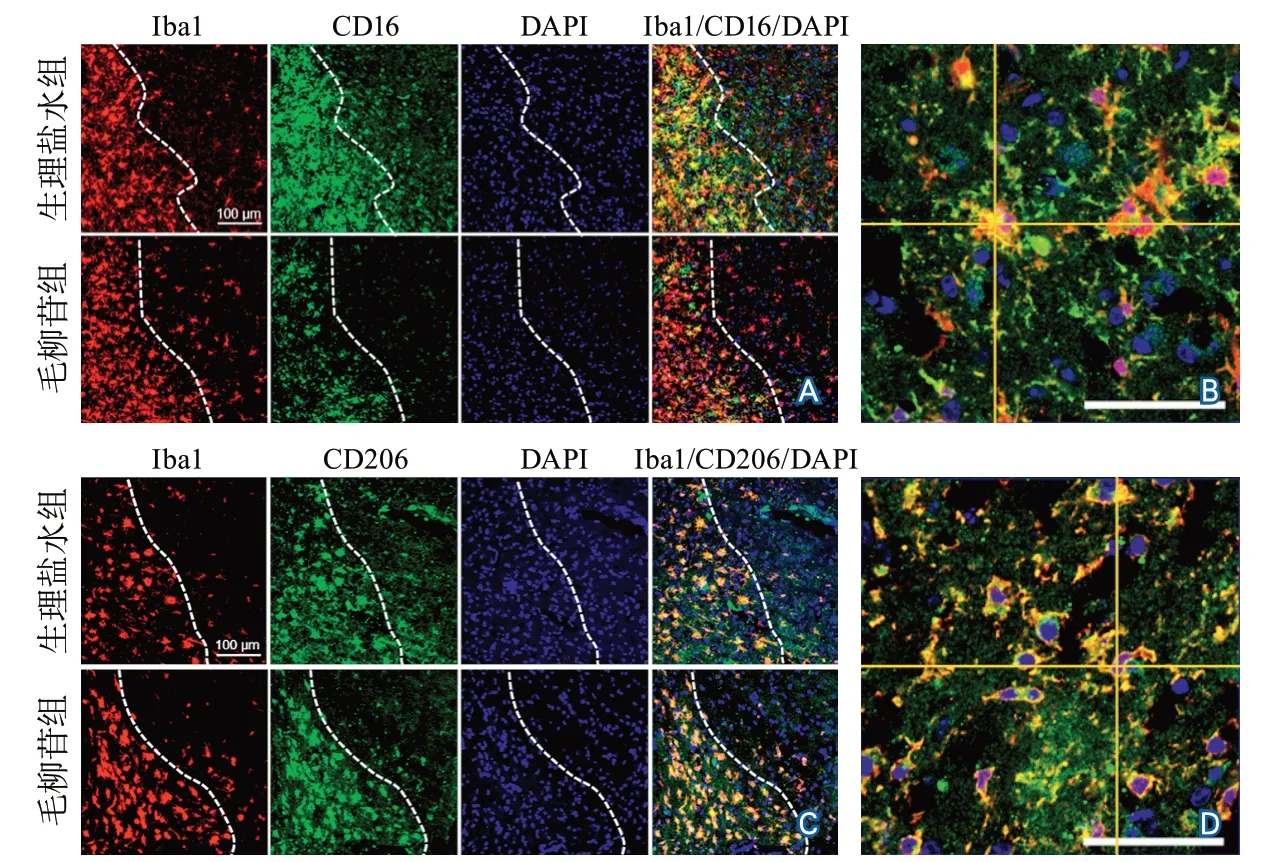
圖4 生理鹽水組和毛柳苷組缺血再灌注后7 d腦組織小膠質細胞極化狀態
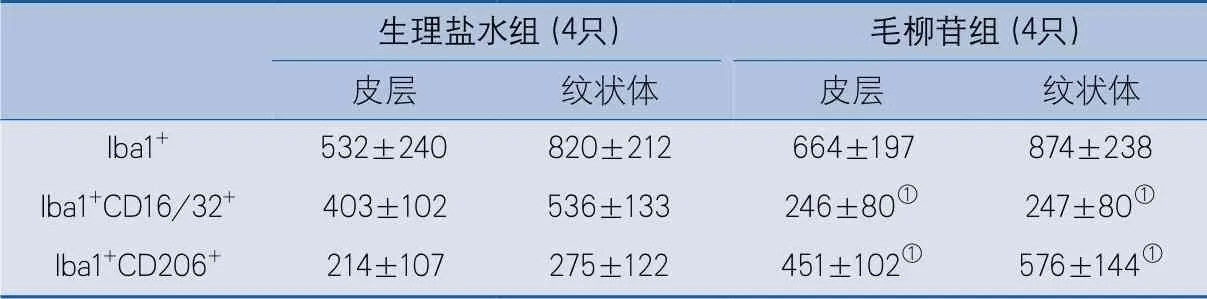
表2 生理鹽水組和毛柳苷組缺血再灌注后7 d腦組織小膠質細胞不同表型數量[單位:個/mm2]
2.5 BV2小膠質細胞不同極化表型IL4I1的表達水平 檢測BV2小膠細胞不同表型(M0、M1、M2)中IL4I1的表達情況。結果顯示,三種表型的小膠質細胞IL4I1的表達差異整體具有統計學差異(P=0.001)。與M0型相比,M1型與M2型BV2小膠質細胞IL4I1表達均下降(P=0.0008,P=0.0155),M1型與M2型相比IL4I1表達下降(P=0.0406)。表明小膠質細胞在激活狀態下降低IL4I1表達,M1型比M2型下降更多(圖5)。
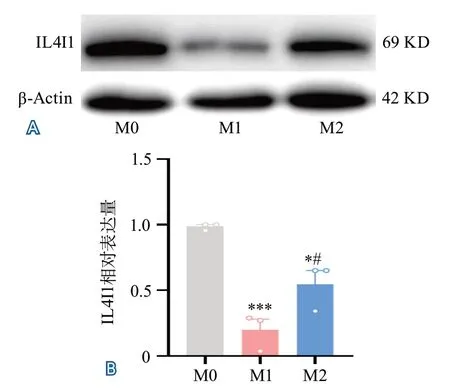
圖5 BV2小膠質細胞不同極化狀態下IL4I1表達情況
3 討論
急性缺血性卒中是致殘率較高的疾病,腦組織損傷后由于氧化應激、興奮性毒性作用導致神經細胞死亡,造成感覺、運動神經功能損傷[9-10],因此腦缺血后進行神經保護治療尤為重要。在本課題組前期的研究中,發現毛柳苷可通過調節小鼠腦缺血再灌注后14 d小膠質細胞極化促進少突膠質細胞分化及有髓神經纖維髓鞘的再生,從而保護神經功能,減少小鼠腦缺血后的認知功能障礙[4]。但前期實驗對毛柳苷是否影響缺血早期的腦組織損傷范圍并沒有進行分析,本實驗發現,在腦缺血損傷早期,毛柳苷可減少腦梗死體積。
IL4I1參與機體抗感染防御,通過抑制T細胞增殖分化及限制B細胞增殖發揮免疫抑制作用,抑制機體抗腫瘤免疫反應,參與腫瘤免疫逃逸[11-12]。本實驗發現缺血性腦損傷發生后48 h,小鼠血清中IL4I1濃度下降,隨著損傷恢復到28 d又逐漸回升,而毛柳苷能夠減輕腦缺血后7 d IL4I1水平的下降程度,促進恢復期IL4I1濃度回升。缺血性腦損傷后血清中IL4I1濃度變化與損傷發生和恢復相關,因此IL4I1可能成為新的缺血性腦損傷診斷與預后的生物標志物。
小膠質細胞是中樞神經系統的固有免疫細胞,小膠質細胞在生理狀態下為靜息狀態(M0),在疾病狀態下可激活為促炎表型(M1)和抗炎表型(M2)。M1型細胞分泌IL-1β、TNF-α等促炎細胞因子介導神經炎癥[13];M2型細胞則分泌精氨酸酶-1、轉化生長因子-β等細胞因子抑制炎癥反應[14]。損傷發生后小膠質細胞由纖細分支狀變為短厚突起多分支狀,便于快速地應答[15-17]。本實驗發現毛柳苷使缺血區周圍小膠質細胞呈現出多突起分支狀,增加了小膠質細胞的監測范圍,促使其更快地感知損傷區域的炎癥并發揮炎癥調節作用。另外,毛柳苷促使腦組織損傷區周圍的小膠質細胞由M1促炎表型向M2抗炎表型轉化。而M2型細胞的增多有助于損傷區域的炎癥修復,保護神經細胞,提示毛柳苷可能通過調節小膠質細胞極化,抑制腦損傷區域的炎癥,保護神經功能。本實驗中BV2小膠質細胞IL4I1表達的研究發現,活化后小膠質細胞不同表型中,IL4I1表達均降低,其中M1型較M2型細胞表達有更明顯的下降趨勢,提示IL4I1可能在小膠質細胞激活和表型轉化中發揮重要作用。結合本實驗缺血性腦損傷后毛柳苷促進腦組織IL4I1表達,且有研究發現IL4I1可調節巨噬細胞/小膠質細胞的極化[8,18],提示毛柳苷可能通過促進缺血性腦損傷后免疫調節蛋白IL4I1的表達,調節小膠質細胞的激活與極化。不過,本實驗中未對IL4I1在缺血性腦損傷后小膠質細胞極化中的調節作用及機制進行研究,因此免疫調節蛋白IL4I1對小膠質細胞極化的調節作用仍有待深入研究。
【點睛】本研究通過小鼠腦缺血再灌注模型和細胞培養,探索了毛柳苷在缺血性腦損傷后腦保護作用的分子機制,提示毛柳苷可能通過促進IL4I1表達調節小膠質細胞激活與極化,從而達到神經保護的作用。

