結(jié)直腸癌TP53相關(guān)外泌體的差異蛋白分析*
朱 琳,張 澤,賈 坤,周茜寧,周 光△
1.解放軍總醫(yī)院第一醫(yī)學(xué)中心檢驗科,北京 100853;2.解放軍總醫(yī)院第六醫(yī)學(xué)中心檢驗科,n北京 100037;3.首都醫(yī)科大學(xué)附屬北京友誼醫(yī)院臨床檢驗中心,北京 100050
在全球,結(jié)直腸癌(CRC)的發(fā)病率和死亡率僅次于肺癌及乳腺癌,居所有腫瘤的第三位[1]。抑癌基因的失活和癌基因的激活是CRC發(fā)生、發(fā)展的關(guān)鍵。在已發(fā)現(xiàn)的人類腫瘤細(xì)胞中,TP53基因突變率從10%(造血干細(xì)胞惡性腫瘤)到50%~70%(卵巢癌、大腸癌、頭頸癌)[2]。一旦TP53基因發(fā)生突變,就會喪失野生型TP53基因所具有的抑癌功能,同時獲得許多癌基因的特殊功能[3]。外泌體是細(xì)胞內(nèi)多泡體與細(xì)胞膜融后釋放到細(xì)胞外的納米級膜性囊泡,直徑30~100 nm,內(nèi)部包含有微小RNA(miRNA)、信使RNA(mRNA)和細(xì)胞質(zhì)蛋白,由多種細(xì)胞分泌,介導(dǎo)細(xì)胞間物質(zhì)與信息傳遞[4-5]。腫瘤來源的外泌體存在于腫瘤細(xì)胞培養(yǎng)上清液、腫瘤患者血漿或者惡性滲出液中,通過改變腫瘤微環(huán)境,促進腫瘤血管新生和腫瘤轉(zhuǎn)移,以及直接作用于腫瘤細(xì)胞等途徑,影響腫瘤的進展[6]。確定腫瘤相關(guān)的外泌體蛋白和RNA,能使這些囊泡成為新的生物標(biāo)記來源并用來監(jiān)測健康狀態(tài)。因此,本文比較分析了TP53基因突變、敲除及野生的腫瘤細(xì)胞分泌外泌體的蛋白質(zhì)組差異,探討突變的TP53基因?qū)δ[瘤微環(huán)境中的分泌蛋白質(zhì)的影響。
1 材料與方法
1.1細(xì)胞系來源 人類CRC TP53野生型[HCT116-p53(WT)]細(xì)胞株購自美國標(biāo)準(zhǔn)生物品收藏中心(ATCC);TP53敲除型[HCT116-p53(-/-)]細(xì)胞株由約翰霍普金斯大學(xué)Bert VOGLESTEIN教授饋贈。
1.2臨床樣本 用于驗證的CRC患者均依據(jù)《結(jié)直腸癌診療指南(2019年版)》并經(jīng)病理確診,其血清均來自中國醫(yī)學(xué)科學(xué)院腫瘤醫(yī)院腹部外科的住院患者,共62例,其中男32例,女30例,年齡27~81歲,中位年齡64歲。采取外周血前經(jīng)患者本人知情同意,并且術(shù)前未經(jīng)任何放化療。健康對照組血清取自解放軍總醫(yī)院的體檢健康人群,血液生化指標(biāo)檢測正常,腹部B超結(jié)果正常,并排除人類免疫缺陷病毒、乙型肝炎病毒和梅毒感染者,共61例,其中男35例,女26例,年齡25~73歲,中位年齡50歲。
1.3主要儀器與試劑 飛利浦CM120型透射電子顯微鏡(荷蘭); AB SCIEX 5600質(zhì)譜儀(美國);Agilent technologies超高效液相色譜(美國)。Santa Cruz Biotech兔抗人p53、HSP70多克隆抗體(美國);Sigma-Aldrich鼠抗人β-actin單克隆抗體(美國)。Qrigene的 TP53 MUTANT (R273H)重組質(zhì)粒(pCMV6-Myc-DDK-AC)(美國);天根生物DH5α大腸埃希菌感受態(tài)細(xì)菌(北京)。SBI ExoQuick外泌體提取液(美國),優(yōu)爾生RB1的酶聯(lián)免疫吸附試驗(ELISA)試劑盒(武漢);AB SCIEX iTRAQ 4重標(biāo)記試劑盒(美國)。
1.4外泌體的提取 將HCT116-p53(WT)、HCT116-p53(-/-)和HCT116-p53(R273H)細(xì)胞培養(yǎng)上清液進行濃縮后,加入等體積的ExoQuick上下顛倒混勻,冷藏靜置過夜;混合物于4℃條件下,1 500×g離心30 min,棄上清,沉淀即為富集的外泌體,少部分沉淀重懸在1 mL的1×PBS中用作電鏡觀察,剩余的沉淀用含有蛋白酶抑制劑的蛋白裂解液提取蛋白,-80 ℃冰箱保存?zhèn)溆谩?/p>
1.5外泌體的電鏡觀察 取重懸在1×PBS中的外泌體溶液1滴,載于直徑2 mm的銅網(wǎng)上。滴加2%磷鎢酸溶液,室溫負(fù)染10 min,濾紙吸干負(fù)染液后白熾燈下烤干約2 min,將此銅網(wǎng)置于透射電鏡下,于80 kV下觀察外泌體形態(tài),在鏡下用標(biāo)尺量取外泌體的直徑并拍攝照片。
1.6外泌體蛋白的提取和定量 在富集的外泌體沉淀中,加入100 μL的蛋白裂解液混勻,冰上放置30 min以充分裂解外泌體,12 000×g,4 ℃離心15 min后取上清,分裝-80 ℃冰箱保存?zhèn)溆谩radford法測定樣品蛋白的濃度,具體方法參照Coomassie Plus Protein Assay說明書。
1.7質(zhì)譜分析 采用iTRAQ標(biāo)記和高精度質(zhì)譜鑒定相結(jié)合的同位素標(biāo)記相對和絕對定量聯(lián)合液相色譜串聯(lián)質(zhì)譜(iTRAQ-LC-MS/MS)策略。
1.7.1多肽濃度的檢測 酶切后的多肽樣品溶于1‰ FA后采用BCA法測定多肽濃度。標(biāo)準(zhǔn)品采用血管緊張素Ⅱ配成1.00、0.50、0.25、0.10、0.05及0.00 g/L的不同濃度梯度,取不同濃度的標(biāo)準(zhǔn)品10 μL和多肽樣品分別加入96孔板中,再加入200 μL配好的工作液,室溫放置10 min,顯色后在酶標(biāo)儀的波長562 nm處測其吸光度,根據(jù)標(biāo)準(zhǔn)品的濃度及其相應(yīng)的吸光度值制作標(biāo)準(zhǔn)曲線,計算出樣品濃度。
1.7.2iTRAQ標(biāo)記 iTRAQ 4重標(biāo)記試劑盒室溫平衡半小時后,加入70 μL乙醇混勻。在樣品中加入36 μL TEAB緩沖液,室溫下14 800 r/min離心5 min,棄去沉淀,將樣品溶液轉(zhuǎn)入新的離心管中,測pH值大于8時進行iTRAQ標(biāo)記。將iTRAQ試劑加入含樣品的離心管中,振蕩混勻后離心,室溫避光反應(yīng)2 h標(biāo)記多肽。之后加入等體積的滅菌水終止反應(yīng),充分振蕩,高速離心后放入旋轉(zhuǎn)蒸發(fā)儀,真空干燥,標(biāo)記的多肽可避光于-80 ℃冰箱保存。
1.7.3質(zhì)譜鑒定 質(zhì)譜條件設(shè)定為:掃描質(zhì)荷比為400~1 800的離子;離子電荷數(shù)大于2;噴霧電壓設(shè)定為2 000 V;真空規(guī)溫度設(shè)定為250 ℃;一級質(zhì)譜自動增益設(shè)定為1 000 000,分辨率設(shè)定為30 000;二級質(zhì)譜自動增益設(shè)定為30 000,分辨率設(shè)定為7 500;母離子分離窗口設(shè)定為3;離子注射時間設(shè)定為150 ms。所得質(zhì)譜圖用MASCOT軟件檢索,所用數(shù)據(jù)庫為人類的蛋白質(zhì)數(shù)據(jù)庫(ftp.ncbi.nihIgov/)。
1.7.4蛋白定量結(jié)果校正與差異蛋白選取 將原始的蛋白定量結(jié)果進行l(wèi)og2轉(zhuǎn)換,然后分析定量結(jié)果的分布。如果定量結(jié)果為典型正態(tài)分布時,分別計算該正態(tài)分布的均值和標(biāo)準(zhǔn)差值;如果均值不為0,說明蛋白的上樣量有差異,需要通過校正的方法校正上樣量差異,將每個蛋白的定量結(jié)果均減去均值,新的值作為蛋白定量值,校正后的蛋白比值仍為正態(tài)分布,而其均值應(yīng)為0。
差異蛋白的選取采用重復(fù)的方法進行顯著蛋白選取。計算每個蛋白在兩次重復(fù)之間定量結(jié)果之間的變化值,取95%的蛋白的變化值均小于設(shè)定值時的卡值作為顯著性蛋白選取的依據(jù),蛋白比值大于該卡值的蛋白作為顯著性差異蛋白。
1.8生物信息學(xué)通路分析 KEGG通路分析工具采用DAVID數(shù)據(jù)分析軟件。將差異蛋白的基因名稱上傳至DAVID網(wǎng)站后,選擇Pathways選項進行通路富集分析,通路富集的參數(shù)為默認(rèn)參數(shù)。采用PANTHER網(wǎng)絡(luò)分析軟件對差異蛋白進行細(xì)胞定位、分子功能、生物學(xué)過程的分析,將差異蛋白號上傳至PANTHER網(wǎng)站,種屬選擇人類,選擇對應(yīng)的biological process、molecular function、cellular component選項進行分析。網(wǎng)絡(luò)富集分析采用IPA軟件進行,差異蛋白號及比值上傳至IPA網(wǎng)站后,選擇canonical pathways選項分析顯著性變化蛋白的經(jīng)典通路富集。
1.9統(tǒng)計學(xué)處理 采用SPSS17.0統(tǒng)計學(xué)軟件進行統(tǒng)計學(xué)處理。ELISA數(shù)據(jù)結(jié)果根據(jù)適用情況選擇Mann-Whitney 檢驗。以P<0.05 為差異有統(tǒng)計學(xué)意義。
2 結(jié) 果
2.13種細(xì)胞系來源的外泌體的鑒定 采用ExoQuick試劑盒提取HCT116-p53(WT)、HCT116-p53(-/-)和HCT116-p53(R273H)細(xì)胞培養(yǎng)上清中的外泌體,在透射電鏡下觀察,如圖1A顯示3種細(xì)胞系來源的外泌體均呈大小不一的圓盤狀,由脂質(zhì)雙分子層包裹的小囊泡,直徑在30~100 nm。圖1B展示的是用免疫印跡檢測3種細(xì)胞系分泌的外泌體標(biāo)志性分子熱休克70(HSP70),均在70×103處顯示出條帶信號。

注:A為3種細(xì)胞系來源的外泌體經(jīng)負(fù)染后在透射電鏡下的形態(tài),呈大小不一的圓盤狀,標(biāo)尺為100 nm,放大倍數(shù)為120 000;B為免疫印跡檢測3種細(xì)胞系來源的外泌體的標(biāo)志性蛋白HSP70,1代表細(xì)胞全蛋白,2代表外泌體蛋白。
2.23種細(xì)胞系分泌外泌體的差異表達(dá)蛋白質(zhì)譜 將HCT116-p53(WT)-外泌體的蛋白設(shè)為reference 后,最終鑒定到3 437個蛋白,其中3 173個蛋白具有精確的定量信息;對這些蛋白進行整理,去除技術(shù)重復(fù)和生物重復(fù)各自的CV>0.5的數(shù)據(jù)后得到可信的蛋白數(shù)是3 003個。以P-value<0.05,卡值1.6,以及生物學(xué)重復(fù)ratio>0.625且<1.6為判斷標(biāo)準(zhǔn),得到最終每組間的差異蛋白:HCT116-p53(WT)-外泌體和HCT116-p53(R273H)-外泌體有144個差異蛋白,HCT116-p53(WT)-外泌體和HCT116-p53(-/-)-外泌體有480個差異蛋白。其中有34個差異蛋白在HCT116-p53(WT)和HCT116-p53(R273H)組和HCT116-p53(WT)和HCT116-p53(-/-)組中共同存在,見圖2,主要富集了細(xì)胞周期相關(guān)的分子,包括E2F4、CCNB1、HSP90AA1、PCM1、PSMD12,這與TP53基因的主要功能是一致的。
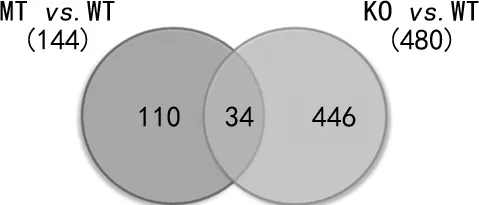
圖2 HCT116-p53(WT)比HCT116-p53(R273H)與HCT116-p53(WT)比HCT116-p53(-/-)組的蛋白比較
2.3差異蛋白質(zhì)的生物信息學(xué)分析 利用GO注釋分別分析了HCT116-p53(WT)比HCT116-p53(R273H)組和HCT116-p53(WT)比HCT116-p53(-/-)組差異蛋白的亞細(xì)胞定位、參與的生物學(xué)過程及其分子功能,顯示在圖3中,可以看出大部分差異蛋白定位于細(xì)胞質(zhì)、細(xì)胞骨架、細(xì)胞外基質(zhì)。主要參與代謝過程、細(xì)胞的生物學(xué)過程、免疫系統(tǒng)過程、細(xì)胞組分的組織、凋亡、應(yīng)激、增殖、細(xì)胞黏附等生物學(xué)過程,在功能上主要分為催化活性、結(jié)合功能、轉(zhuǎn)錄翻譯調(diào)控、細(xì)胞骨架組裝、受體活性、物質(zhì)轉(zhuǎn)運。
IPA分析顯示,HCT116-p53(WT)和HCT116-p53(R273H)組的差異蛋白主要富集在泛素化、mTOR信號通路、DNA損傷修復(fù)通路中,選擇性地富集了損傷修復(fù)因子、信號轉(zhuǎn)導(dǎo)分子等,HCT116-p53(WT)和HCT116-p53(-/-)組的差異蛋白主要集中在泛素化、EIF2信號通路、糖酵解通路中,如圖4。
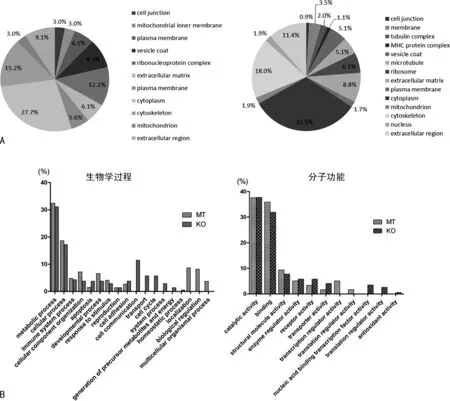
注:A為兩組差異蛋白的亞細(xì)胞定位分析,左圖是HCT116-p53(WT)比HCT116-p53(R273H)組,右圖是HCT116-p53(WT)比HCT116-p53(-/-)組;B為左側(cè)為兩組差異蛋白參與的生物學(xué)過程,Y軸的百分比為相應(yīng)蛋白質(zhì)占全部具有生物學(xué)進程注釋蛋白質(zhì)的比例;右側(cè)為兩組差異蛋白的功能分類,Y軸的百分比為相應(yīng)的蛋白質(zhì)占全部具有分子功能注釋蛋白質(zhì)的比例;MT代表HCT116-p53(WT)比 HCT116-p53(R273H)組的差異蛋白,KO代表HCT116-p53(WT)比 HCT116-p53(-/-)組的差異蛋白。
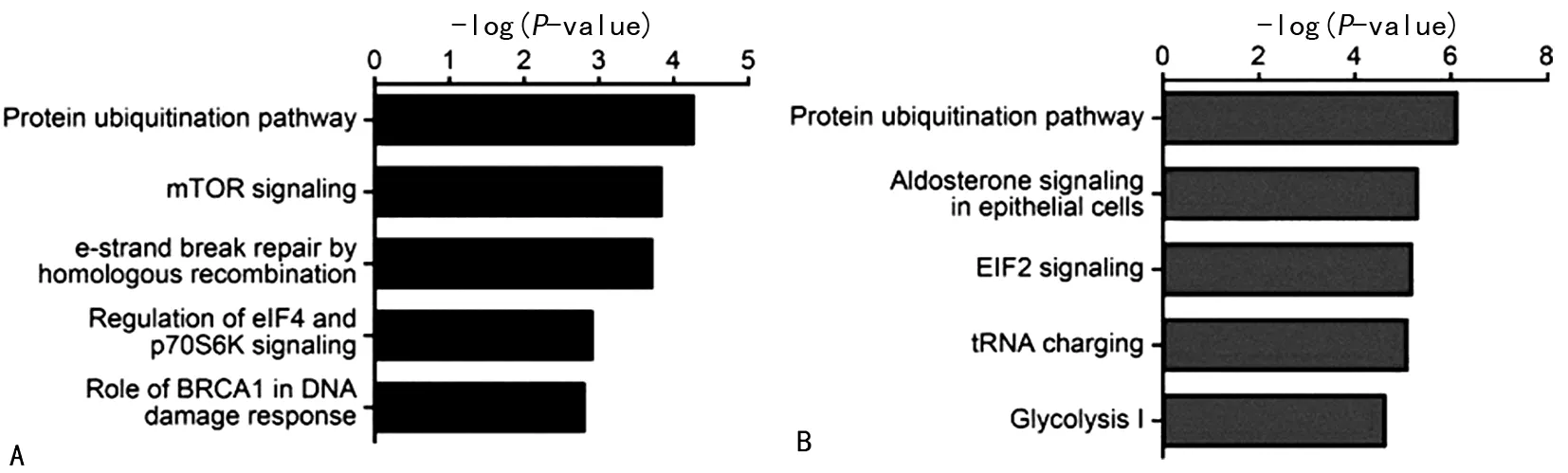
注:A為是HCT116-p53(WT)比HCT116-p53(R273H)組的差異蛋白富集通路;B為HCT116-p53(WT)比HCT116-p53(-/-)組差異蛋白富集通路。
2.4差異蛋白RB1的血清學(xué)驗證 用ELISA試劑盒檢測了年齡、性別相匹配的61例健康對照者和62例CRC患者的血清RB1水平,性別組、年齡組和疾病組的RB1指標(biāo)經(jīng)K-S檢驗均為非正態(tài)分布,結(jié)果用M(P25~P75)表示,結(jié)果見表1。健康對照組血清RB1濃度中位數(shù)是0.512 3 ng/mL,檢測區(qū)間為0.081 5~2.469 0 ng/mL,而CRC患者的血清RB1濃度中位數(shù)是1.085 2 ng/mL,檢測區(qū)間為0.153 2~5.096 0 ng/mL。經(jīng)過Mann-Whitney秩和檢驗,二者差異具有統(tǒng)計學(xué)意義(P<0.05)。同時,健康對照組中的血清RB1濃度與其年齡、性別之間差異無統(tǒng)計學(xué)意義(P>0.05)。

表1 血清RB1表達(dá)水平及其臨床參數(shù)相關(guān)性[M(P25~P75)]
3 討 論
外泌體是由細(xì)胞內(nèi)多泡體與細(xì)胞膜融后釋放到細(xì)胞外的納米級膜性小囊泡,直徑在30~100 nm之間,表面含有大量與其來源和功能密切相關(guān)的蛋白質(zhì)和脂質(zhì)成分,內(nèi)部包含有miRNA、mRNA和蛋白,因為內(nèi)部成分在脂質(zhì)膜的保護下具有充分的生物學(xué)活性,可以有效發(fā)揮對受體細(xì)胞的調(diào)節(jié)作用[7]。作為一種新的信息傳遞載體,外泌體和靶細(xì)胞之間的相互作用可以憑借其表面的生物活性脂、膜受體的轉(zhuǎn)移、蛋白質(zhì)的交付對靶細(xì)胞進行直接作用[8-9],通過改變靶細(xì)胞的蛋白表達(dá)、基因調(diào)控網(wǎng)絡(luò)或者表觀遺傳編程等來發(fā)揮重要生物學(xué)功能[10]。
近年來針對結(jié)直腸癌細(xì)胞分泌的外泌體的研究屢有報道,比如研究發(fā)現(xiàn)CRC細(xì)胞的外泌體含有27種和細(xì)胞周期相關(guān)的mRNA,可有效促進內(nèi)皮細(xì)胞的生長及血管形成[11-12]。用流式細(xì)胞術(shù)對CRC患者血漿中的外泌體進行定量,發(fā)現(xiàn)腫瘤患者的外泌體量顯著高于健康對照組,并且CRC患者血漿中外泌體的含量和CEA值的水平相一致,和腫瘤的分化程度及患者生存期相反[13]。有文獻(xiàn)證實,273位點是CRC TP53基因突變熱點,與腫瘤的發(fā)生密切相關(guān)[14-16],因此TP53基因的273位點成為目前研究腫瘤發(fā)生、發(fā)展的熱點。腫瘤的發(fā)展離不開腫瘤微環(huán)境,所以確定突變的TP53對腫瘤微環(huán)境的影響是十分必要的。雖然目前已知突變的TP53是如何影響腫瘤細(xì)胞生物學(xué)行為,但突變的TP53對腫瘤細(xì)胞分泌到腫瘤微環(huán)境中的分泌蛋白質(zhì)的影響卻知之甚少。為了檢測是否TP53的狀態(tài)影響外泌體的組成和行為,本文從TP53野生型、TP53突變型、TP53敲除型的HCT116結(jié)直腸癌細(xì)胞系培養(yǎng)上清中純化出外泌體進行研究。利用iTRAQ-LC-MS/MS對外泌體進行蛋白質(zhì)組學(xué)分析,結(jié)果顯示TP53狀態(tài)可以改變外泌體的成分。本研究的結(jié)果提示突變的TP53可以通過外泌體改變細(xì)胞的信號釋放,為周圍的腫瘤細(xì)胞提供生長條件。盡管還并不清楚TP53突變是如何分選外泌體中蛋白的,但是結(jié)果顯示TP53突變型和TP53野生型的CRC細(xì)胞系分泌的外泌體差異蛋白主要富集在泛素化通路,而泛素化涉及外泌體內(nèi)容物的分選[17],所以推測突變的TP53通過影響外泌體中的泛素化蛋白來進一步調(diào)節(jié)分選其他內(nèi)容物進入外泌體,從而為腫瘤的發(fā)展創(chuàng)造有利條件。
此外,本文從HCT116-p53(R273H)和HCT116-p53(WT)與HCT116-p53(-/-)和HCT116-p53(WT)這兩組差異蛋白中選擇及和CRC有關(guān),并且與TP53(WT)相比均上調(diào)的視網(wǎng)膜母細(xì)胞瘤蛋白(RB1)進行后續(xù)的血清學(xué)驗證分析。RB1是一種細(xì)胞周期調(diào)控蛋白,可以通過抑制細(xì)胞周期進程防止細(xì)胞過度生長,被CDK3/cyclin-C磷酸化后促進細(xì)胞周期從G0至G1轉(zhuǎn)變。RB1還是一種染色體改造酶(甲基化酶和乙酰化酶)的招募蛋白。這個基因缺陷可以引起兒童視網(wǎng)膜母細(xì)胞瘤、膀胱癌、骨肉瘤,在多種腫瘤中為一種抑癌蛋白。研究顯示,RB1功能的丟失能充分誘導(dǎo)干細(xì)胞不受控的增殖[18]。然而,與它作為抑癌蛋白經(jīng)典的角色相矛盾,CRC細(xì)胞保留抑癌蛋白RB1的表達(dá),CRC組織較癌旁組織表達(dá)的RB1水平更高,并且較少發(fā)生RB1基因的丟失或者突變[19]。RB1基因在CRC中的mRNA和蛋白表達(dá)水平都比正常腸黏膜要高,RB1在人類多種腫瘤中都是滅活的,目前公認(rèn)CRC中RB1蛋白的活性通常是存在甚至是放大的[20]。此外,研究發(fā)現(xiàn)RB1蛋白和通常在CRC高表達(dá)的抗凋亡Bcl-2相關(guān)的永生基因蛋白(BAG-1)相互作用,CRC中RB1的表達(dá)受到BAG-1抗凋亡活性的嚴(yán)格控制。與之前的報道一致,核內(nèi)的BAG-1通過提高NF-κB的活性來促進細(xì)胞生存,研究人員證實了BAG-1提高NF-κB活性的能力可以被RB1表達(dá)抑制而抑制。因此,RB1可能有個新的功能,即通過調(diào)節(jié)BAG-1的功能促進細(xì)胞生存[21]。本文在年齡、性別相匹配的61例健康成人和62例CRC患者的血清中利用ELISA檢測了RB1水平。結(jié)果表明,CRC患者的血清RB1水平明顯高于健康對照組,差異有統(tǒng)計學(xué)意義(P=0.001 2),與本文的iTRAQ定量結(jié)果相吻合。
綜上所述,可以推測表達(dá)高水平RB1的外泌體作為腫瘤細(xì)胞間信號交流的介質(zhì),可以抑制腫瘤細(xì)胞的凋亡,從而促進腫瘤的進展。

